Voidakseen ymmärtää molekyyligeometriaa, polariteettia ja muita vastaavia ominaisuuksia, on tunnettava tietyn yhdisteen perusominaisuudet ja sen Lewis-rakenne. SF4 on kemiallinen kaava rikkitetrafluoridille. Se on väritön syövyttävä kaasu, jota käytetään useiden orgaanisten fluoriyhdisteiden synteesissä. SF4 on melko vaarallinen yhdiste, mutta sitä käytetään laajalti kemian ja lääketeollisuuden yrityksissä.
| Molekyylin nimi | Rikkitetrafluoridi ( SF4) |
| Valenssielektronien määrä molekyylissä | 34 |
| SF4:n hybridisaatio | sp3 hybridisaatio |
| Sidekulmat | 102 astetta ja 173 astetta |
| SF4:n molekyyligeometria | Trigonaalinen kaksoispyramidaali |
Ymmärtääksemme tämän molekyylin ominaisuuksia, kuten sen reaktiivisuutta, napaisuutta ja muuta, on ensin tunnettava SF4:n Lewis-rakenne.
Sisältö
SF4:n molekyyligeometria
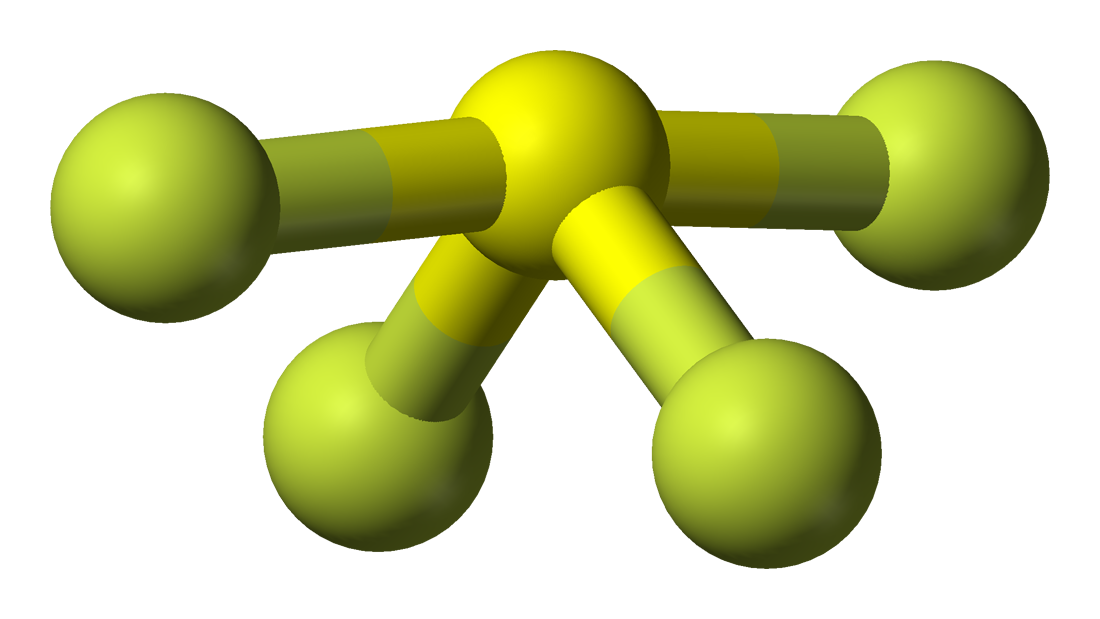
Tämän molekyylin molekyyligeometria on helppo ymmärtää molekyylikaavan tai VSEPR-mallin avulla. Molekyylikaava auttaa tietämään kyseisessä yhdisteessä olevien atomien tarkan määrän ja tyypin. Tässä yhdisteessä on yksi rikkiatomi ja neljä fluoriatomia, joten se muistuttaa molekyylikaavaa AX4E.
Molekyyleillä, joiden molekyylikaava on AX4E, on trigonaalinen bipyramidi molekyyligeometria. Tässä kaksi fluoriatomia, jotka muodostavat sidoksia rikkiatomin kanssa, ovat ekvatoriaalisilla paikoilla ja loput kaksi ovat aksiaalisilla paikoilla. Koska keskeisellä atomilla on yksi yksinäinen pari, se hylkii sidoselektroniparia, mikä muuttaa muotoa hieman ja saa sen näyttämään sirkkeliltä. Elektronit noudattavat tätä VSEPR-säännön mukaista järjestysmallia, jotta yksinäisten elektroniparien väliset repulsiovoimat saataisiin minimoitua ja molekyylin stabiilius maksimoitua.
SF4:llä on siis trigonaalinen bipyramidi molekyyligeometria.
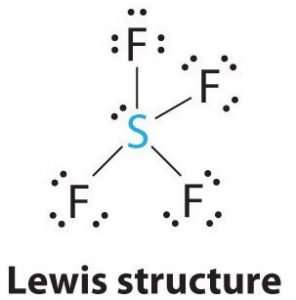
SF4:n Lewis-rakenne
Lewis-rakenne on kuvallinen esitys molekyylin sidoksista ja valenssielektroneista. Kahden atomin välille muodostuneet sidokset kuvataan viivoilla, kun taas valenssielektronit, jotka eivät muodosta sidoksia, esitetään pisteinä. Valenssielektroneita, jotka osallistuvat sidosten muodostamiseen, kutsutaan sidoselektronipareiksi, kun taas elektroneja, jotka eivät osallistu tai muodosta sidoksia, kutsutaan ei-sitoviksi elektronipareiksi tai yksinäisiksi pareiksi.
Ja piirtääksemme SF4:n Lewis-rakenteen, meidän on ensin tiedettävä tämän molekyylin valenssielektronien kokonaismäärä.
Kuten varmaan näkee, tässä yhdisteessä on yksi rikkiatomi ja neljä fluoriatomia. Jotta tiedämme tämän yhdisteen valenssielektronien kokonaismäärän, meidän on tiedettävä molempien atomien valenssielektronit erikseen.
- Rikin valenssielektronit: 6
- Floorin valenssielektronit: 4* (7)
( koska fluoriatomeja on neljä, meidän on otettava huomioon kaikkien atomien valenssielektronit)
SF4:n valenssielektronien kokonaismäärä = rikin valenssielektronien määrä + fluorin valenssielektronien määrä
= 6 + 28
= 34 valenssielektronia
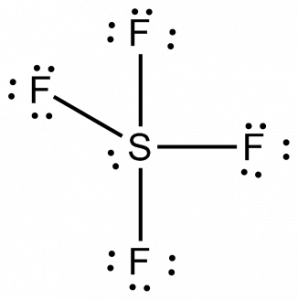
Nyt, kun tiedämme valenssielektronien kokonaismäärän, meidän olisi helppo ymmärtää atomien välisten sidosten muodostuminen ja myös molekyylin täydellinen järjestely.
Rikki on tämän molekyylin keskeinen atomi, koska se on vähiten elektronegatiivinen, ja neljä fluoriatomia muodostaa sidoksia tämän keskeisen atomin sivuilla. Jokainen fluoriatomi muodostaa sidoksen keskusatomin kanssa, mikä tarkoittaa, että molekyylirakenteessa on neljä sidosta, joissa käytetään neljä fluoriatomin valenssielektronia ja neljä rikkiatomin elektronia. Nyt käytetään siis kahdeksan valenssielektronia, jolloin valenssielektronien määrä vähenee 34:stä 24:ään. Kaikilla fluoriatomeilla on kuusi valenssielektronia, ja keskeisellä atomilla on kaksi valenssielektronia.
Piirrä viivoja S:n ja F:n välille osoittaaksesi sidoksia ja käytä pisteitä yksinäisten elektroniparien kohdalla. Kullakin fluoriatomilla on kolme paria 6 valenssielektronia ( esitetty pisteinä) atomissa, sekä yksi sidos rikin kanssa. Keskusatomilla sen sijaan on kaksi valenssielektronia ja neljä sidosta.
Keskusatomilla, rikillä, on siis SF4:n Lewis-rakenteessa yksi yksinäinen elektronipari ja neljä sidoselektroniparia. Samalla jokaisella fluoriatomilla on kolme yksinäistä elektroniparia.
Onko SF4 polaarinen?
Kun tiedämme kyseisen yhdisteen Lewis-rakenteen ja molekyyligeometrian, on helpompi kuvata molekyylin poolisuutta. Tässä tapauksessa yksi yksinäinen pari keskeisellä rikkiatomilla ja neljä sidoselektroniparia johtavat elektronien epäsymmetriseen jakautumiseen keskeisellä atomilla.
Kuin molekyylin muoto on kuin vipuvarsi, kaksi fluoriatomia voi kumota toistensa dipolimomentin, mutta loput kaksi eivät elektronien sijoittelun vuoksi. Ja koska fluoriatomit ovat elektronegatiivisempia kuin rikkiatomit, varaus jakautuu epätasaisesti. Näin ollen dipolimomentti ei kumoudu, mikä tekee molekyylistä polaarisen. Joten kyllä, SF4 on polaarinen.
SF4:n hybridisaatio
Tutustuaksemme SF4-molekyylin hybridisaatioon, tarkastellaan ensin keskeisen atomin elektronitiheyden alueita.
Raudalla on neljä sidoselektroniparia ja yksi yksinäinen pari, joten sen elektronitiheysalueita on yhteensä 5. Rikkiatomi käyttää siis viittä hybridisoitunutta orbitaalia, yhtä 3s-orbitaalia, kolmea 3p-orbitaalia ja yhtä 3d-orbitaalia. Tämä elektronien sijoittelu atomin ympärillä ja hybridisoituneet orbitaalit johtavat sp3d-hybridisaatioon. Hybridisaation tuntemiseen voidaan käyttää myös steriililukua; tässä rikkiatomin steriililuku on 5.
Siten SF4:llä on sp3d-hybridisaatio.
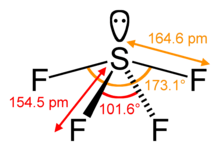
SF4 Sidekulmat ja muoto
Keskeinen rikkiatomi muodostaa neljä sidosta viereisten fluoriatomien kanssa ja sillä on yksi yksinäinen elektronipari. Ekvatoriaalisilla paikoilla olevien fluoriatomien sidoskulmat ovat 102 astetta ja aksiaalisilla 173 astetta, jotka poikkeavat hieman trigonaalisesta bipyramidaalisesta molekyyligeometriasta johtaen see-saw-muotoon.
Keskiatomin yksinäinen pari johtaa siihen, että sidekulmat muuttuvat ekvatoriaalisten fluoriatomien osalta 120 asteesta 102 asteeseen ja aksiaalisten fluoriatomien osalta 173 asteeseen 180 asteen sijaan.
Loppuhuomautukset
Kaikkien ominaisuuksien yhteenvetona voidaan sanoa,
- Rikkitetrafluoridilla on 34 valenssielektronia, joista se muodostaa Lewis-rakenteessaan neljä kovalenttista sidosta ja yhden yksinäisen elektroniparin sentraaliatomille.
- Kullakin fluoriatomilla on kolme yksinäistä paria.
- SF4:n molekyyligeometria on kaavan AX4E mukainen; se muodostaa see-saw-muodon ja sillä on trigonaalinen bipyramidaalinen molekyyligeometria.
- SF4:llä on sp3d-hybridisaatio ja se on luonteeltaan polaarinen.