Multiplex Ligation-dependent Probe Amplification (MLPA) on molekyylitekniikka, jonka MRC-Holland kehitti vuonna 2002. Pähkinänkuoressa MLPA on herkkä tekniikka, joka mahdollistaa nukleiinihapposekvenssien kvantifioinnin nopeasti ja tehokkaasti. Sitä käytetään monissa laboratorioissa eri puolilla maailmaa, ja sitä voidaan käyttää geenin kopiolukumuutosten (kuten deleetioiden tai duplikaatioiden) havaitsemiseen, DNA:n metylaatiotilanteen tunnistamiseen, yhden nukleotidin polymorfismien (SNP) ja pistemutaatioiden havaitsemiseen sekä mRNA:n kvantifiointiin. Siksi sitä käytetään monilla tutkimus- ja diagnostiikka-aloilla, kuten muun muassa sytogenetiikassa, syöpätutkimuksessa ja ihmisgenetiikassa.
Miten se toimii?
MLPA koostuu seuraavista vaiheista (kuva 1):
- Denaturointi
- Hybridisointi
- Liigaus
- Amplifiointi (PCR:llä)
- Fragmenttien erottelu ja data-analyysi
Kuvio 1 – MLPA-tekniikan visualisointi (mukailtu lähteestä Schouten, Jan P., et al.1). Näemme myös tyypillisen MLPA-analyysin avulla saadun elektropherogrammin, jossa näkyy eksoni 46:n deleetio (punainen nuoli). (Elektropherogrammi mukailtu lähteestä https://commons.wikimedia.org/wiki/File:MLPA_in_GeneMarker.jpg)
1 – Denaturointi ja 2 – Hybridisointi
Denaturointiin kuuluu annealattujen DNA-juosteiden erottaminen, jolloin kaksijuosteisesta DNA:sta tulee yksijuosteista.
Hybridisoinnissa DNA-näyte hybridisoidaan spesifisten koettimien kanssa. Koska kyseessä on multipleksitekniikka, voit analysoida kutakin näytettä jopa 60:llä koettimella samanaikaisesti ja siten kohdistaa analyysin eri kohtiin!
Näissä koettimissa on alukesekvenssi, joka sitoutuu PCR-alkuaineeseen monistusprosessissa. Kaikilla eri koettimilla on sama alukkeeseen sitoutuva sekvenssi. Lisäksi koettimilla on myös kohdekohtaan komplementaarinen hybridisaatiosekvenssi, jonka avulla koetin sitoutuu DNA:han. Molemmat koettimet hybridisoituvat DNA-juosteen vierekkäisiin kohtiin.
Yksi parin koettimista sisältää puskurisekvenssin, joka on eripituinen kussakin kohdekohdassa. Puskurisekvenssin pituus muuttuu eri koettimien välillä, mikä mahdollistaa multipleksoinnin. Voit siis odottaa, että jokaisella monistustuotteella on yksilöllinen pituus!
3-Ligaatio
Ligaatiovaiheessa kaksi koetinta sidotaan yhteen. Tässä vaiheessa käytetään erityistä entsyymiä nimeltä DNA-ligaasi. Se sitoo koettimet, jotka ovat jo hybridisoituneet kohdekohdan DNA-juosteen vierekkäisiin kohtiin. MLPA-protokollissa käytetty ligaasi on ligaasi-65, NAD-riippuvainen ligaasientsyymi, joka voi olla hyödyllinen myös muissa sovelluksissa.
Kysymys kuuluu: jos tavoitteenamme on ligatoida molemmat koettimet, miksi ne ovat alun perin erillisiä molekyylejä? No, molemmat koettimet sisältävät PCR-primerien sitoutumiskohdat. Tämä tarkoittaa, että jos käyttäisimme koettimia yhtenä molekyylinä, saisimme monistustuotteen, vaikka DNA:n kohdekohtaa ei olisikaan, jolloin saisimme epäspesifisen monistuksen. Entsyymi ligaasi on erittäin spesifinen: jos koettimen ja kohdekohdan välillä on yhtään epäsuhtaa, ligaasi ei pysty sitomaan koettimia eikä monistusta tapahdu. Näin ollen MLPA havaitsee spesifisiä pistemutaatioita ja erottaa jopa pseudogeenit ja todellisen kohdegeenin toisistaan.
4-Amplifikaatio
Seuraava vaihe on amplifikaatio, joka on pohjimmiltaan polymeraasiketjureaktio (PCR) (taulukko 1). PCR-vaihetta varten lisätään polymeraasi, dNTP:t sekä etu- ja käänteisaloitin. Koska kaikilla koettimilla on sama PCR-primer-sekvenssi, on tarpeen lisätä vain yksi pari universaaleja alukkeita kaikkien kohteidemme tutkimiseksi. Eteenpäin suuntautuva alukke on fluoresenssimerkitty, mikä mahdollistaa visualisoinnin ja kvantifioinnin analyysin aikana.
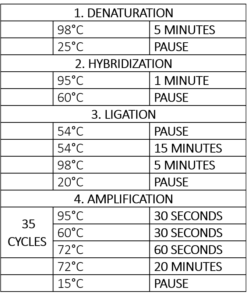
Taulukko 1 – Lämpökirjoittimen ohjelma MLPA-reaktiota varten
5-Fragmenttien erottelu ja datan analyysi
Monistamisen jälkeen fragmentit erotetaan toisistaan kapillaarielektroforeesilla. Kapillaarielektroforeesissa fragmentit erotetaan niiden pituuden perusteella ja eri pituiset fragmentit esitetään piikkikuvioina, joita kutsutaan elektropherogrammiksi (kuva 1). Jokaisella amplikonilla on erilainen tunnettu koko, joka johtuu kunkin spesifisen koettimen puskurisekvenssistä, ja siksi jokainen amplikoni voidaan kvantifioida data-analyysin aikana.
Kapillaarielektroforeesilla saadut tiedot ovat syötteenä analyysille. MRC- Holland tarjoaa data-analyysiä varten ilmaisen Coffalyser-ohjelmiston.
Vertaamalla kutakin näytettä vertailunäytteiden joukkoon saadaan luotainten suhde. Tämä koettimien suhde kertoo meille, kuinka monta kopionumeroa geenillä on. Koska useimmat ihmisen geenit ovat diploideja, jos näytteessä on kaksi kopiota, suhdeluku on 1,0; eli näytteen koettimilla on saatu sama määrä geenejä kuin vertailunäytteessä.
Jos taas suhdeluku on 0,5, yksilössä oli vain yksi kopio geenistä, mikä tarkoittaa todennäköisesti kohdegeenin heterotsygoottista deletoitumista. Jos taas suhdeluku on 1,5, kyseessä on todennäköisesti geenin heterotsygoottinen duplikaatio.
MRC-Holland tarjoaa monia erilaisia sarjoja, joista saattaa löytyä ratkaisu ongelmaasi. Jos kuitenkin haluat löytää jotakin hieman hämärämpää tai tutkia jotakin, jota ei ole missään kitissä, voit suunnitella omat koettimesi. Suosittelen lukemaan huolellisesti synteettisten koettimien suunnitteluprotokollan.
MLPA:n edut
- MLPA on erittäin herkkä, vankka ja korkean läpimenon tekniikka.
- Se pystyy erottamaan pistemutaatiot sekä geenien duplikaation/deleaktion. Siksi sillä on suuri etu verrattuna muihin tekniikoihin, kuten sekvensointiin, joilla voidaan löytää vain pistemutaatioita. Lisäksi toisin kuin FISH:llä, MLPA:lla voidaan havaita pienet geenimuutokset.
- Tulokset ovat saatavilla 24 tunnin kuluessa, ja koska kyseessä on multipleksireaktio, se mahdollistaa nopean ja tehokkaan tiedonkeruun.
- MMLPA-protokollan pienet muutokset mahdollistavat monenlaisia sovelluksia. Esimerkiksi lisäämällä ylimääräinen sulatusvaihe voidaan MLPA:ta käyttää myös DNA:n metylaatiomallien havaitsemiseen (metylaatiospesifinen MLPA (MS-MLPA)).
MLPA:n rajoitukset
- MLPA on erittäin herkkä epäpuhtauksille. Siksi näytteiden valmistuksessa ja tekniikan suorittamisessa on noudatettava äärimmäistä varovaisuutta.
- Harvinaisesta polymorfismista tai mutaatiosta johtuen koettimen signaali voi heikentyä, jolloin voi olla tarpeen testata se muilla tekniikoilla.
MLPA on loistava tekniikka, jota voidaan käyttää monipuolisesti ja joka antaa tuloksia nopeasti ja tehokkaasti. Se ei kuitenkaan ole ongelmaton. Kuten kaikki tiedämme, jokaisella tekniikalla on tiettyjä haittoja, ja jokainen sovellus on tutkittava perusteellisesti, jotta voimme varmistaa, että käytämme tehokkainta ja herkintä tekniikkaa.
Oletko koskaan käyttänyt MLPA:ta? Mitä mieltä olet tästä tekniikasta?