Flavivirukset (Flaviviradae) ovat suuri viruspatogeeniperhe, joka on vastuussa vakavien sairauksien ja kuolleisuuden aiheuttamisesta ihmisille ja eläimille. Perheeseen kuuluu kolme sukua: Flavivirus, Pestivirus ja Hepacivirus. Flavivirus-sukuun, joka on kolmesta suvusta suurin, kuuluu yli 70 virusta, kuten Dengue-virus (DV), Japanin enkefaliittivirus (JEV), Länsi-Niilin virus (WNV), Keltaisen kuumeen virus (YFV) ja Zika-virus (ZIKV). Flavivirukset ovat morfologiselta muodoltaan yhtenäisiä, ja niillä on ikosaedrinen kapsidi ja tiiviisti istuva, piikkimäinen kuori. Kapsidin koko on noin 30 nm ja koko virionin koko 45 nm. Flavivirusten genomi on noin 10 kb:n kokoinen yksisäikeinen sense-RNA. Se koodaa kolmea rakenneproteiinia: kapsidia (C-proteiini), kalvoa (M, joka ilmentyy prM:nä, M:n esiasteena, ja kuorta (E-proteiini) sekä seitsemää ei-rakenteellista proteiinia: NS1, NS2A, NS2B, NS3, NS4A, NS4B ja NS5 (kuva 1 a.b).
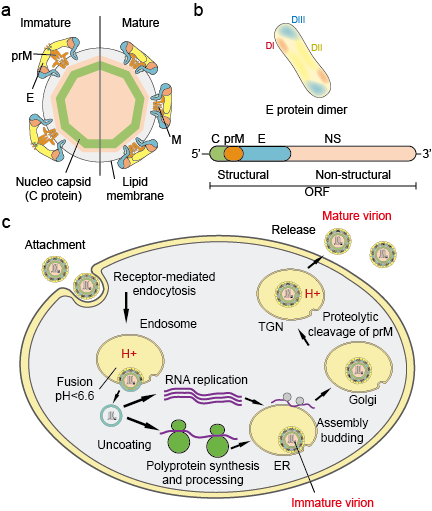
Kuva 1. Flaviviruspartikkelit (a), proteiinit (b) ja elinkaari (c).
Browse All Flavivirus Related Products
Flaviviruksen elinkaari:
Virukset kiinnittyvät isäntäsolun pintaan ja pääsevät sen jälkeen soluun reseptorivälitteisen endosytoosin avulla (kuva 1c). Flaviviruksille on tunnistettu useita primaarireseptoreita ja matala-affiniteettisia yhteisreseptoreita. Endosomaalisen vesikkelin happamoituminen käynnistää virionin konformaatiomuutokset, virus- ja solukalvojen sulautumisen ja hiukkasen hajoamisen. Kun genomi on vapautunut sytoplasmaan, positiivinen RNA käännetään yhdeksi polyproteiiniksi, jota virus- ja isäntäproteaasit prosessoivat yhteistranslationaalisesti ja posttranslationaalisesti. Genomin replikaatio tapahtuu solunsisäisillä kalvoilla. Viruksen kokoaminen tapahtuu endoplasmisen retikulumin (ER) pinnalla, kun rakenneproteiinit ja äskettäin syntetisoitu RNA nupoutuvat ER:n lumeniin. Näin syntyvät ei-infektiiviset, epäkypsät virus- ja subviruspartikkelit kulkeutuvat trans-Golgi-verkoston (TGN) kautta. Isännän proteaasi furiini pilkkoo epäkypsät virionipartikkelit, jolloin syntyy kypsiä, infektiivisiä partikkeleita. Furiini pilkkoo myös subviruspartikkelit. Kypsät virionit ja subviruspartikkelit vapautuvat tämän jälkeen eksosytoosin kautta.
Flavivirusten epidemiologia:
Hyttysen välittämät flavivirukset tarttuvat luonnossa yhdessä tai useammassa erillisessä tai päällekkäisessä syklissä, johon kuuluu hyttysvektori, yleensä Aedes-hyttyset YFV:n ja DENV:n osalta ja Culex-hyttyset JEV:n ja WNV:n osalta, ja nisäkäs- tai lintuisäntä. Hyttysten ja selkärankaisten isäntien välisiä siirtymiä kutsutaan horisontaalisiksi siirroiksi, ja ne aiheuttavat taudin selkärankaisissa. Horisontaalisesta siirtymisestä poiketen hyttysten levittämät flavivirukset voivat säilyä ympäristössä vertikaalisen eli sukupolvelta toiselle tapahtuvan siirtymisen kautta, mikä mahdollistaa flavivirusten leviämisen pelkästään hyttysissä. Suorimmat todisteet, jotka tukevat hyttysten levittämien flavivirusten vertikaalista siirtymistä, ovat peräisin viruksen eristämisestä tartunnan saaneista toukista oletettavasti transovariaalisen siirtymisen kautta. Tämä havainto on yhdenmukainen sen kanssa, että virusantigeenejä on havaittu tartunnan saaneiden hyttysten munasarjakudoksissa. (Kuva 2)
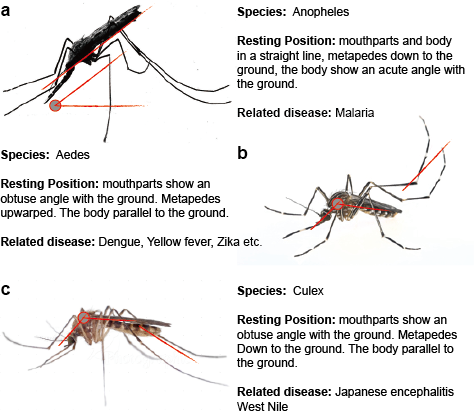
Kuva 2. Kolme tyypillistä hyttystä, jotka levittävät tauteja.
Flaviviruksilla on maailmanlaajuinen levinneisyys, ja jotkin suvun jäsenet muodostavat merkittävän kansanterveydellisen ongelman (esim. keltakuumevirus , denguevirus , Länsi-Niilin virus ja Japanin enkefaliittivirus ), johon liittyy suuri sairastuvuus ja/tai kuolleisuus. Viime vuosikymmenen aikana flavivirusten esiintyvyys on lisääntynyt, ja ne muodostavat riskin yli kolmelle miljardille ihmiselle maailmanlaajuisesti, mikä tekee niistä nousevien tautien paradigman.
Viimeisten 50 vuoden aikana monien flavivirusten, kuten dengueviruksen, Länsi-Niilin viruksen ja keltakuumeviruksen, esiintyvyys, taudin vakavuus ja/tai maantieteellinen levinneisyysalue ovat lisääntyneet dramaattisesti. Ympäristöstä peräisin olevilla viruspatogeeneilla on suhteellisen yhtenäiset epidemiologiset ominaisuudet. Hyttyset, punkit ja puremakärpäset toimivat useimpien ihmisen virustautien vektoreina. Ihmisten tautia esiintyy silloin, kun vektorit ovat aktiivisia, tyypillisesti keväällä, kesällä ja syksyllä lauhkeissa ilmastoissa, ja niillä on usein selviä epidemiologisia piirteitä, jotka vastaavat vektorin elinympäristöä (kuva 3).
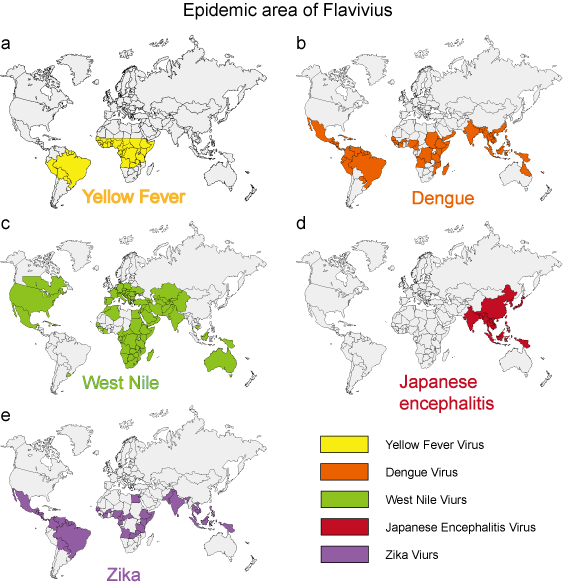
Kuva 3. Epidemia-alueet. Viiden tyypillisen flaviviruksen epidemia-alue.
Muodot:
Flavivirukset vaihtelevat suuresti patogeenisen potentiaalinsa ja ihmistauteja tuottavien mekanismiensa suhteen (taulukko 1). Sekä hyttysten että punkkien levittämien flavivirusten aiheuttama ihmisinfektio saa alkunsa viruksen laskeutumisesta ihon läpi tartunnan saaneen niveljalkaisen syljen välityksellä. Virus lisääntyy paikallisesti ja alueellisissa imusolmukkeissa ja aiheuttaa viremian. Tärkeimpiä oireyhtymiä ja esimerkkejä aiheuttajina olevista flaviviruksista ovat: enkefaliitti (japanin enkefaliitti), kuumeinen sairaus, johon liittyy ihottumaa (denguevirus), verenvuotokuume (Kyasanurin metsätautivirus ja joskus denguevirus) ja verenvuotokuume, johon liittyy hepatiitti (keltakuumevirus).
Taulukko 1 Yleiskatsaus tärkeimpiin flaviviruksiin
| Viruslajit | Tartunnanlevittäjä | Maantieteellinen leviäminen | Syndrooma. |
|---|---|---|---|
| Keltainen kuume | Hyttynen (Aedes) | Katso kuva 3a | Hemorraginen kuume |
| Dengue-kuume | Hyttynen (Aedes, Stegomyia) |
Katso kuva 3b | Dengue-oireyhtymä, DHF, DSS |
| Länsi-Niilin kuume | Hyttynen (Culex), punkit (Argasidae) |
Katso kuva 3c | Dengue-oireyhtymä, enkefaliitti |
| Japanin enkefaliitti | Hyttynen (Culex) | Katso kuva 3d | Enkefaliitti |
| Zika | Hyttynen (Aedes) | Katso kuva 3e | Mikrokefalia |
Diagnostiikka:
Eri flavivirusten kliininen diagnoosi ei ole luotettava epäspesifisten oireiden vuoksi, ja laboratoriodiagnoosi on pakollinen taudin etiologian varmistamiseksi. Flavivirusinfektioissa virusta voidaan löytää seerumista tai plasmasta yleensä 2-7 päivää taudin puhkeamisen jälkeen, ja tämän vireemisen vaiheen kesto ja todettu viruskuorma vaihtelevat infektoivan viruksen mukaan (taulukko 2). Yleensä 5-7 päivän kuluttua tartunnan alkamisesta syntyy immuunivaste infektiota vastaan, ja IgM-vasta-aineet saavuttavat huippunsa 15 päivän kuluttua. Nämä IgM-vasta-aineet voivat kestää kuukausista (kuten DENV:n tapauksessa) vuosiin (kuten WNV-infektioiden tapauksessa). IgG-vasta-aineiden ilmaantuminen tapahtuu 8-10 päivän kuluttua tartunnan alkamisesta, ja niitä voidaan havaita koko elämän ajan. Kunkin flaviviruksen erityispiirteet vaikuttavat merkittävästi diagnostisiin algoritmeihin, joita on sovellettava flavivirusinfektioiden tunnistamisessa. Yleisesti ottaen monet laboratoriot ovat valinneet serologiset testit flavivirusten aiheuttamien infektioiden diagnosoimiseksi niiden tarkkuuden ja korkeisiin laatustandardeihin perustuvien kaupallisten testien saatavuuden vuoksi. Serologisten ristireaktioiden esiintyminen eri virusten välillä ja vasta-aineiden havaitsemiseen joissakin infektioissa tarvittava aika haittaavat kuitenkin serologian käyttökelpoisuutta akuuttien flavivirustartuntojen diagnoosivälineenä. Viruksen eristäminen on ”kultainen standardi” menetelmä varmistetun flavivirusdiagnoosin saamiseksi.
Browse All Flavivirus ELSIA Kit and Flavivirus RDT Products
Table 2. Flavivirusdiagnoosialgoritmit.
| Akuutti vaihe | Toipilasvaihe | Suositeltava näyte† | Viruskuormitus odotettavissa | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, viruksen eristys | IgM, IgG | Serum, plasma ja kudos | Korkea |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, viruksen eristys | IgM, IgG | Serum, plas, CSF ja PBMC:t | Jopa 106 virionia/ml |
| WNV | RT-PCR, IgM, IgG | IgM, IgG | CSF ja seerumi | Low |
| JEV | RT-PCR, IgM, IgG | IgM, IgG | CSF, seerumi, veri ja PBMC | Matalat |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF ja seerumi | Low |
| Gould E A, Solomon T. Patogeeniset flavivirukset . The Lancet, 2008, 371(9611): 500-509. | |
| Gaunt M W, Sall A A, de Lamballerie X, et al. Flavivirusten fylogeneettiset suhteet korreloivat niiden epidemiologian, tautien assosiaatioiden ja biogeografian kanssa . Journal of General Virology, 2001, 82(8): 1867-1876. | |
| Kuno G, Chang G J J, Tsuchiya K R, et al. Phylogeny of the genus Flavivirus . Journal of virology, 1998, 72(1): 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle . Nature Reviews Microbiology, 2005, 3(1): 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Flavivirusten ja hyttysten väliset vuorovaikutukset. Viruses, 2014, 6(11): 4703-4730. |