Introduction
Tämä sappiteiden epiteelistä alkunsa saava kasvain eli kolangiokarsinooma (CC) edustaa 10 %:a hepatobiliäärisistä kasvaimista ja 2 %:a pahanlaatuisista kasvaimista.1,2 CC voidaan jakaa kolmeen alatyyppiin sen mukaan, mikä on niiden anatominen alkuperä sappiteiden sisällä: intrahepaattinen tai perifeerinen CC (ICC), perihilaarinen CC tai Klatskinin kasvain (PHC) ja distaalinen CC.
PHC, joka on tämän tarkistuksen aiheena, on yleisin, ja sen osuus kaikista CC:istä on noin 40-60 prosenttia.2,3 Tämä kasvain on aggressiivinen ja äänetön, ja sillä on epäspesifiset oireet pitkälle edistyneeseen vaiheeseen asti, mikä johtaa myöhäiseen diagnoosiin ja lyhyeen elinaikaan, joka on lyhytaikainen, ilman leikkaushoitoa, ja joka vaihtelee välillä 6 ja 1 2 kuukautta.4 Leikkaus, joka on ainoa käytettävissä oleva parantava vaihtoehto, on diagnoosihetkellä mahdollinen vain noin 47 prosentilla potilaista.5-8 Tämän kasvaimen tärkeimmät ennustetekijät liittyvät yleensä leikkausvaihtoehtoihin, ja tärkeimpiä tekijöitä ovat kasvaimen vaihe, koko, ganglioiden ja verisuonten osallistuminen, maksansisäiset etäpesäkkeet ja histologinen tyyppi.9-11
Anatominen tila
PHC:n valtaama anatominen tila rajautuisi distaalisella tasolla kystisen kanavan sisääntuloon ja proksimaalisella tasolla oikean ja vasemman maksakanavan haarautumiseen.1,12 Yleisimmin käytettyihin luokituksiin kuuluvat kaikki CC, jotka saavat alkunsa sappitiehyiden yhtymäkohdasta tai sen ympäristöstä. Eräät ryhmät ovat esittäneet, että maksan parenkyymistä peräisin olevat CC voivat joskus tunkeutua sappitiehyeen yhtymäkohtaan, jolloin ne saavat alkunsa oikean porttilaskimohaaran takimmaisen lähteen ja falciformisen ligamentin rajaamasta anatomisesta tilasta.13-15 Näitä ICC:itä, jotka koskevat sappitiehyeen yhtymäkohtaa, hoidettaisiin samalla tavalla kuin ekstrahepaattista alkuperää olevia kasvaimia, ja niiden eloonjäämisennustetta verrattaisiin samankaltaisesti samassa vaiheessa oleviin PHC:hin. Ne ovat yleensä pitkälle kehittyneitä kasvaimia, joilla on paikallinen verisuoni- ja imusolmukeinvaasio. Epäilykset näiden kasvainten biologisesta käyttäytymisestä ovat saaneet monet ryhmät sulkemaan ne pois perihilarikasvainten joukosta. Ebatan ym. julkaisemassa tutkimuksessa13,15 , jossa tutkittiin 250 potilasta, jotka oli leikattu CC:n vuoksi ja joilla oli mukana sappitiehyt, analysoitiin vaihetta ja eloonjäämistä sen mukaan, oliko kasvain maksansisäinen ja mukana oli mukana sappitiehyt (ICC) vai oliko kasvain lähtöisin ekstrahepaattisesta sappitiehyestä (PHC). Yhteensä 83 potilaalla oli ICC ja 167 PHC. Vaiheita verrattaessa todettiin, että ICC-potilailla verisuonten ja imusolmukkeiden osallistuminen oli yleisempää ja TNM-luokitus oli korkeampi kuin PHC-ryhmässä: 59 prosentilla potilaista oli vaiheet iii ja iv, kun PHC-ryhmässä vastaava luku oli 38 prosenttia. Jos eloonjääminen kuitenkin jaetaan vaiheiden mukaan molemmissa ryhmissä, tilastollisesti merkitseviä eroja ei ole viiden vuoden kohdalla, ja PHC-ryhmässä kokonaiseloonjääminen on hieman korkeampi (20 % vs. 29 %; P = 0,057), joten voidaan päätellä, että hoito ja eloonjääminen ovat vertailukelpoisia. Diagnostisten testien ja histopatologisen tietämyksen parantuessa voimme tulevaisuudessa ehkä paremmin määritellä, ovatko ne kaksi erillistä entiteettiä vai ovatko ne kliinisesti ja biologisesti samoja.
Histopatologiset ominaisuudet
90 % PHC:stä on adenokarsinoomia. 10 % on adenoskamaattisia tai levyepiteelikarsinoomia, joihin on joissakin tapauksissa liittynyt sappiteiden kivettymistä, kystoja tai poikkeavuuksia. Kasvaimen ulkonäön, kasvutyypin sekä PHC:n biologisen ja kliinisen käyttäytymisen mukaan ne luokitellaan16,17:
- –
Kasvain tai ”massaa muodostava” CC: tämä on yleisin ICC:n esiintymismuoto, vaikka sitä esiintyy myös suuressa osassa PHC:tä. Sille on ominaista kasvainmassan muodostuminen, jolla on selvästi määritellyt marginaalit. Siinä on merkittävä fibroottinen reaktio, ja myös keskeinen nekroosi on yleistä. Tämä kasvain saa alkunsa sappitiehyen aukosta, tunkeutuu seinämään ja leviää kasvamalla kolmiulotteisesti muodostaen kyhmymäisen massan, joka aiheuttaa obstruktiivisia oireita.16-19
- –
Infiltroiva periduktaalinen CC: Tämäntyyppiset kasvaimet kasvavat sappitiehyttä pitkin konsentrisena pitkittäisenä paksuuntumana sidekudoksen läpi kanavan ympärillä aiheuttaen ahtauman tai täydellisen tukkeutumisen kyseessä olevaan sappitiehyeeseen.19 Suurin osa PHC:stä on tätä tyyppiä, ja niitä on vaikea tunnistaa kuvantamismenetelmillä.17
- –
Intraduktaalinen tai intraduktaalinen papillaarinen CC: tälle lajille on ominaista, että sappitiehyessä on pinnallisia ja intraluminaalisia kasvaimia. Ne tuottavat limaa ja aiheuttavat kanavien osittaisen tukkeutumisen ja laajentumisen.16 Tämän kasvaimen pahanlaatuisuusaste on alhainen, ja se on yleensä pienikokoinen, vaikka se voi levitä sappitiehyen liman läpi synnyttäen useita kasvaimia (papilomatoosi tai papillaarinen karsinomatoosi).20
Tämän erilaistamisen tärkeys piilee eloonjäämiskestävyydessä esiintyvissä vaihteluissa, jotka riippuvat kyseisestä alatyypistä. Useat tutkimukset ovat osoittaneet, että potilailla, joilla on intraduktaalinen papillaarinen tyyppi, on parempi ennuste kuin potilailla, joilla on skleraalis-nodulaarinen muunnos,21 keskimääräinen elossaoloaika on 55 kuukautta ja 33 kuukautta,22 kun taas vaskulaarinen ja ganglionien osallistuminen on harvinaisempaa intraduktaalisen papillaarisen alatyypin yhteydessä.
Yhteenvetona voidaan todeta, että suurin osa PHC:stä on adenokarsinoomia, joilla on periduktaalinen kasvutapa, mikä antaa niille huonomman ennusteen, kun taas intraduktaalisen kasvun omaava muunnos on harvinaisin, vaikka sillä on parempi ennuste.
Staging-järjestelmät
PHC:n staging-järjestelmät voidaan erottaa leikkausta edeltäviin ja leikkauksen jälkeisiin luokituksiin. Ensin mainituista, joita käytetään leikkausta suunniteltaessa, tärkein järjestelmä on Bismuth-Corlette-luokitus. Se osoittaa, mikä lohko on ensisijaisesti vaurioitunut, ja näin ollen se osoittaa, minkä tyyppistä hepatektomiaa olisi käytettävä (kuva 1).23 Tämä luokitus keksittiin 1970-luvulla, eikä siinä oteta huomioon imusolmukkeiden osallistumista eikä etäpesäkkeitä, joten sen ennusteellinen arvo on nykyään vähäisempi.
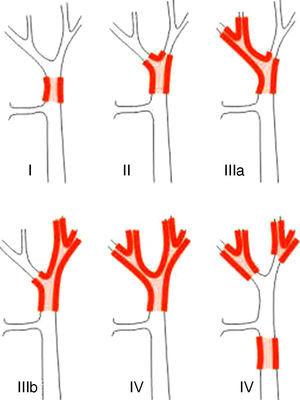
Bismuth-Corlette23-luokitus.
Muutama Yhdysvalloissa käytössä oleva preoperatiivinen luokitus on New Yorkissa sijaitsevan Memorial Sloan Ketteringin Syöpäkeskuksessa työskentelevien Jarnaginin ym. julkaisema luokitus10 . Tämän luokituksen tarkoituksena on ennustaa kasvainten resektiokelpoisuutta ottamalla huomioon kolme paikallista laajentumistekijää. Nämä tekijät ovat sappitiehyen laajeneminen, verisuonten osallistuminen ja lohkon surkastuminen. Tässä luokituksessa ei oteta huomioon imusolmukkeiden osallistumista eikä etäpesäkkeitä, joten sillä on vähemmän ennustearvoa. Koska leikattavuus vaihtelee ryhmittäin, kun taas suuntaus on kohti yhä aggressiivisempia hoitoja, sen arvo riippuu kunkin keskuksen kriteereistä, joiden mukaan luokitus ei ole leikattavissa. Paikallisen osallisuuden ei pitäisi enää olla leikkauskelvottomuuden kriteeri sillä edellytyksellä, että kirurgisella resektiolla pystytään saavuttamaan R0-arvo.
Leikkauksen jälkeisistä luokituksista yleisimmin käytetty on UICC:n (Union for International Cancer Control) TNM-luokitus, seitsemäs painos.12 Tässä luokituksessa otetaan huomioon patologiset tiedot, kuten paikallinen laajeneminen, verisuonten osallistuminen, imusolmukkeiden osallistuminen ja etäpesäkkeet, jotta saadaan aikaan luokitus, joka sisältää kasvaimen laajenemisen ja on luonteeltaan ennusteellinen.
Viime aikoina ”Japanese Study Group on Perihilar Cholangiocarcinoma” (JSGPH) julkaisi tutkimuksen, jossa ehdotettiin ”Union for International Cancer Controlin” luokituksen muuttamista. Peruserot on esitetty taulukossa 1, ja ne koostuvat pääasiassa13:
-
Bismut IV:tä ei pidetä T4:nä. JSGPH:n luokituksessa ei siis oteta huomioon bilateraalista sappitiehyiden laajenemista huonona ennusteena, jos saavutetaan R0-resektio.
-
Vaiheiden osalta siinä priorisoidaan imusolmukkeiden mukanaolo huonoimpana ennusteena. Sen vuoksi ne katsovat imusolmukkeiden osallistumisen olevan vaiheessa iva eikä iiib (TNM7).
Vertailu UICC:n TNM 7 -luokittelun ja JSGPH:n ehdotuksen välisistä peruseroista.
| Tuumoriluokitus | UICC | JSGPH ehdotus | |
|---|---|---|---|
| Tis. | Carcinoma in situ | ||
| T1 | Kasvain rajoittuu sappitiehen | ||
| T2a | Ylittää kanavan seinämän ja tunkeutuu perihilariseen rasvakudokseen | ||
| T2b | Tunkeutuu maksaparenchymaan | ||
| T3 | Maksavaltimon/suonen yksipuolinen invaasio | ||
| T4 | Invaasio HA/PV:n päähaaraan, Vismutti IV, tai Bismuth III ja A/V:n kontralateraalinen invaasio | HA/PV:n päähaaran invaasio, jossa on molemminpuolinen vaskulaarinen tai kontralateraalinen invaasio | |
| TNM-stadium | |||
| 0 | Tis N0 M0 | ||
| I | T1 N0 M0 | ||
| II | T2 N0 M0 | ||
| IIIa | T3 N0 M0 | ||
| IIIb | T1-3 N1 M0 | T4 N0 M0 | |
| Iva | T4 N× M0 | T× N1 M0 | T× N1 M0 |
| Ivb | T× N× M1 | ||
HA, maksavaltimo; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, kasvaimen imusolmukemetastaasi; UICC, Union for International Cancer Control; PV, porttilaskimo.
Euroopan tasolla on luotu kirurgisesti hoidettujen perihilarikasvainten kansainvälinen rekisteri, jota johtaa ”International Cholangiocarcinoma Group for the Staging of PHC”. Tämä ryhmä on julkaissut uuden luokituksen1 , jossa otetaan huomioon kasvaimen koko sekä sappitie-, laskimo-, valtimo-, ganglio- ja etäpesäkkeiden osallistuminen sekä preoperatiivisesti että postoperatiivisesti. Luokituksen rajoituksena on kuitenkin se, että siinä ainoastaan kuvataan kasvaimen ominaisuudet ja suoritettava leikkaus ilman, että potilaat jaetaan ryhmiin tai vaiheisiin näiden muuttujien perusteella. Tämän vuoksi ei ole mahdollista tehdä ennusteellisia johtopäätöksiä, eikä eri ryhmien tuloksia voida vertailla keskenään.
Edellisistä julkaisuista käy ilmi, että preoperatiivinen luokitus, jota käytetään nykyään yleisimmin resektiotyypistä päätettäessä, on Bismuth-Corlette-luokitus, kun taas pitkän aikavälin ennusteen määrittelyyn käytetään TNM 7 -luokitusta.
Diagnostiset strategiat
PHC:hen liittyvät yleisimmät oireet ovat: keltaisuus (90 %), laihtuminen ja vatsakipu (35 %), kutina (26 %) ja akuutti sappitietulehdus (10 %).17 Näiden oireiden vuoksi alustava diagnoosi tehdään tavallisesti vatsaontelon ultraäänitutkimuksella, ja se on hyvä seulontatesti. Muita diagnostisia testejä tämäntyyppisille kasvaimille olisivat:
- –
Vatsan doppler-ultraääni: sen avulla voidaan arvioida valtimoiden ja portaalin läpäisevyyttä (tromboosia), mikä voi vaikuttaa kasvaimen resektiokykyyn ja hoitostrategiaan, vaikkakaan se ei ole ensisijainen testi verisuonten osallisuuden arviointiin.
- –
Abdominaalinen aksiaalinen tietokonetomografia: tämä on hyödyllinen primaarikasvaimen ja taudin laajenemisen diagnosoinnissa, ja sen herkkyys on 80 % sappiteiden laajenemisen arvioinnissa. Se on ensisijainen tekniikka verisuonten anatomian preoperatiivisessa arvioinnissa, ja sen herkkyys on 93 % valtimoiden ja 87 % portaalien osallistumisen arvioinnissa. Sen herkkyys imusolmukkeiden osallistumisen preoperatiivisessa arvioinnissa on alhainen (50 %).14,24 Se on hyödyllinen myös volumetristen testien suorittamisessa ja kirurgisen resektion jälkeen jäljellä olevan maksan tilavuuden laskemisessa. Se on myös edullisin testi preoperatiiviseen staging-tutkimukseen.
- –
Magneettiresonanssikuvaus ja magneettiresonanssikolangiografia (RM-kolangiografia): paras testi primaarikasvaimen diagnosoimiseksi ja sappitiehyen laajenemisen arvioimiseksi. Sen herkkyys on 86-100 %, ja se on parempi kuin suora kolangiografia, ja se on myös noninvasiivinen testi.25 Toisaalta sen herkkyys verisuonten osallistumisen arvioinnissa on alhainen (73 %) ja herkkyys 80 % maksan parenkyymin tunkeutumisen suhteen.
- –
Suora kolangiografia: endoskooppinen retrogradinen kolangiopankreatografia (ERCP) ja läpikuultava maksan kolangiografia (TPHC): nämä antavat tietoa sappitietukoksen asteesta ja mahdollistavat näytteiden ottamisen leesiosta sytologiaa varten, ja niiden herkkyys on 20 %. Ne on nyt korvattu diagnostiikassa MR-kolangiografialla. Ne ovat erittäin käyttökelpoisia preoperatiivisessa sappitiehyiden tyhjennyksessä ja PHC:n palliatiivisessa hoidossa, jossa asetetaan mieluiten metallipäällysteisiä stenttejä26.-28
- –
Endoskooppinen ultraäänitutkimus: se on hyödyllinen arvioitaessa ganglionien osallisuutta keliakiatrungon ja peripankreoosin alueella, määriteltäessä preoperatiivista vaiheistusta ja mahdollistaessa hienon neulan aspiraatiobiopsioiden ottamisen.
- –
Positroniemissiotomografia: tästä on hyötyä tutkittaessa potilaita, joilla epäillään etäpesäkkeitä sekä adenopatioiden osallisuutta keliakian runkoalueella. Sen herkkyys on kiistanalainen, ja se voi vaihdella 38 %:sta 90 %:iin julkaistuista sarjoista riippuen.14,24,29
- –
Kasvainmerkkiaineet: niiden käyttökelpoisuus on rajallinen, ja CA 19.9 on yleisimmin käytetty. Useimmissa tutkimuksissa näitä on arvioitu haiman kasvaimissa ja vähäisemmässä määrin CC:ssä määrittelemättä niiden sijaintia tai ominaisuuksia. Näiden merkkiaineiden seerumipitoisuuksiin vaikuttavat voimakkaasti sappitieobstruktio ja keltaisuus, koska ne poistuvat sappiteitse. On ehdotettu erilaisia normaaliarvoja hepatopatian (300U/ml) tai keltaisuuden (1000U/ml) esiintymisen mukaan, kun taas haimasyövässä herkkyys on yli 70 % ja spesifisyys yli 95 %. Sen pitoisuus näillä potilailla vaihtelee suuresti, eikä se korreloi kasvaimen koon kanssa, vaikkakin se korreloi etäpesäkkeiden esiintymisen kanssa. Tämän merkkiaineen herkkyyttä ja spesifisyyttä voidaan lisätä yhdistämällä se CEA:n kanssa ennen kaikkea Lewis A -negatiivisissa tapauksissa (jotka eivät tuota CA 19.9:ää).30
Yllä olevista tiedoista voidaan päätellä, että PHC:n diagnosoinnissa tutkimus aloitetaan yleensä ultraäänitutkimuksella. Tämä tapahtuu keltaisuutta sairastavan potilaan yhteydessä, kun taas tietokonetomografia ja MR-kolangiografia ovat parhaita vaiheistustutkimuksia ja suositeltavimpia ennen leikkausta. Magneettikuvausta tai tietokonetomografiaa voidaan käyttää tilavuustutkimuksiin sen mukaan, millaisia laitteita tai tietokoneohjelmia kussakin sairaalassa on käytettävissä. Jos on epäilyksiä imusolmukkeisiin leviämisestä, mikä voi olla vasta-aihe leikkaukselle, suositellaan positroniemissiotomografiaa tai ohutneula-aspiraatioendoskopiaa.
Ei-korvattavuuskriteerit
Leikkaus on PHC:n ainoa parantava hoitomuoto, ja se tarjoaa parhaan pitkän aikavälin eloonjäämismahdollisuuden. Kirurgista resektiota varten hyväksytyt kriteerit ovat laajentuneet viime vuosina niistä, jotka Memorial Sloan Ketteringin syöpäkeskuksen työryhmä kuvasi alun perin Burken ym.31 vuonna 1998, kunnes viime aikoina on otettu käyttöön lähestymistapoja, joissa käytetään verisuonten resektiota ja laajennettuja hepatektomioita.3,5,32-34 Leikkaamattomuuden kriteerit vaihtelevat sairaaloittain, ja yleisimpiä ovat: verisuonten osallistuminen toiselta puolelta ja kontralateraalinen sappiteiden osallistuminen toisen tason radikaalien jakoon asti, etäiset maksametastaasit, molempien maksalohkojen verisuonten osallistuminen, ekstrahepaattinen tai vatsakalvon ulkopuolinen osallistuminen ja keliakiatrungon, ylemmän suoliliepeenvaltimon tai paraaortan alueen adenopaattinen osallistuminen.3,5,8,31.
De Jongin ym.34 julkaisemassa monikeskustutkimuksessa, jossa analysoitiin 305 potilasta, jotka leikattiin PHC:n vuoksi seitsemässä eri keskuksessa Yhdysvalloissa ja Euroopassa ja johon sisältyi myös potilaita, joilla oli porttilaskimotauti, monimuuttuja-analyysissä ainoat kaksi tilastollisesti merkitsevää ennustetekijää olivat resektiomarginaalin osallistuminen ja imusolmukkeiden osallistuminen (P=.02). Ebatan ym. julkaisemassa tutkimuksessa15 , jossa analysoitiin 1352 potilasta, jotka leikattiin kahdeksassa japanilaisessa sairaalassa kuratiivisessa tarkoituksessa PHC:n vuoksi, tilastollisesti merkitsevien ennustetekijöiden monimuuttuja-analyysi osoitti, että tilastollisesti merkitseviä ennustetekijöitä olivat verisuonten tunkeutuminen, haiman tunkeutuminen, imusolmukkeiden mukanaolo, etäpesäkkeiden esiintyminen ja resektiomarginaalin mukanaolo. Imusolmukkeiden osallistuminen ja etäpesäke olivat tekijöitä, jotka johtivat huonompaan eloonjäämiseen viiden vuoden kuluttua verrattuna muihin tekijöihin (10 %, 20 % ja 63 %). Nämä tulokset tukevat leikkauksen käyttöä näissä kasvaimissa, jos paikallisesta levinneisyydestä huolimatta on mahdollista tehdä R0-resektio, ottaen huomioon, että elossaoloaikaa on mahdollista pidentää viiteen vuoteen paikallisesta levinneisyydestä riippumatta.
Kaikkien edellä esitettyjen näkökohtien vuoksi suositellaan, että kukin tapaus arvioidaan yksilöllisesti ja että leikkaukseen turvaudutaan, jos R0-resektio voidaan tehdä, jos ei ole etämetastaaseja eikä vatsakalvontulehdusta. Kahdenvälisen sappitie- ja paikallisen verisuonitulehduksen ei näin ollen pitäisi olla leikkauskelvottomuuskriteeri, jos on mahdollista leikata siten, että yli 30 prosenttia maksan tilavuudesta säilyy ja saavutetaan onkologinen resektio.
Terapeuttiset strategiatSappitiehyen tyhjennys
Kun otetaan huomioon, että suurimmalla osalla PHC-potilaista on keltaisuutta, yksi tärkeimmistä ongelmista koskee preoperatiivisen sappitiehyen tyhjennyksen hyötyjä. Tähän ei kuitenkaan liity komplikaatioita, ja ne, jotka liittyvät ERCP:hen ja stentin asettamiseen, ovat seuraavat: haimatulehdus, pohjukaissuolen perforaatio, pohjukaissuolen migraatio, katetrin tukkeutuminen ja, mikä tärkeintä, sappitietulehdus. CTPH-tyhjennykseen liittyy vähemmän preoperatiivista kolangiittia, mutta siihen liittyy verenvuotoa, katetrin siirtymistä, jopa 5 prosenttia kasvaimen leviämistä katetrin liikeradalle sekä epämukavuutta ja kipua sisääntulovyöhykkeellä. Kaiken kaikkiaan julkaistujen tutkimusten mukaan ERCP:hen liittyy 60 %:n sairastuvuus, ja vastaava luku CTPH:n osalta on 31 %.14,35
Yllämainituista syistä johtuen on kyseenalaistettu preoperatiivisen sappitiehyiden tyhjennyksen käyttökelpoisuus hepatobiliopankreasikirurgiassa.36,37 Näissä tutkimuksissa, jotka kattavat kaikenlaiset hepatobiliäärikirurgiset leikkaustoimenpiteet, on käynyt ilmi, että preoperatiivinen sappitiehyiden tyhjennys potilailla, joilla on keltatautitauti, lisää siihen liittyvää sairastuvuutta ilman, että se kuitenkaan parantaisi eloonjäämismahdollisuuksia, ja että se lisää lähinnä komplikaatioita, joihin liittyy infektioita. Fargesin ym. vuonna 2013 julkaisemassa eurooppalaisessa monikeskustutkimuksessa38 analysoitiin takautuvasti 366 potilasta, joille oli tehty hepatektomia tai laajennettu hepatektomia ja sappiteiden resektio PHC:n vuoksi. Heidät luokiteltiin sen mukaan, oliko preoperatiivinen sappitie-dreenaus tehty vai ei. Ryhmään, jossa ei ollut preoperatiivista salaojitusta (non-PBD), kuului 186 potilasta, ja ryhmään, jossa oli tehty sappitie-dreenaus (PBD), 180 potilasta. Ryhmät olivat homogeenisia iän, kasvaimen vaiheen ja portaaliresektion suhteen. PBD-ryhmässä tehtiin enemmän oikeanpuoleisia hepatektomioita (56 % vs. 44 %). Kun molempia ryhmiä verrattiin suoritetun leikkaustyypin mukaan, oikeanpuoleisen hepatektomian saaneilla potilailla esiintyi enemmän postoperatiivista maksan vajaatoimintaa, jos he kuuluivat ryhmään, jossa ei ollut PBD:tä, ja ilmaantuvuus oli 16 % verrattuna 4 %:iin PBD-ryhmässä (P=.009). Monimuuttuja-analyysissä tekijöistä, jotka liittyivät korkeampaan kuolleisuuteen oikeanpuoleisen hepatektomian ryhmässä, bilirubiinipitoisuus alle 3 mg/dl ennen leikkausta oli tilastollisesti merkitsevä tekijä. Jos kuitenkin verrattiin vasemmanpuoleisen hepatektomian potilaiden molempia ryhmiä, PBD-ryhmässä esiintyi enemmän postoperatiivista sepsistä, 6 %, verrattuna 0 %:iin ryhmässä, jossa ei ollut PBD-ryhmää (P=.014). Tämä tutkimus osoittaa, että vaikka on totta, että sappitiehyen tyhjennys lisää postoperatiivisen sepsiksen ilmaantuvuutta, sappitiehyen tyhjennys olisi tehtävä niille potilaille, joille aiotaan tehdä oikea hepatektomia postoperatiiviseen maksan vajaatoimintaan liittyvän sairastuvuuden vähentämiseksi, ja muut tutkimukset tukevat tätä teoriaa39. Kun otetaan huomioon, että PHC:n hoidossa ainoat tutkimukset, jotka ovat osoittaneet paremman eloonjäämisajan, ovat tutkimuksia, jotka tukevat laajoja resektioita R0-resektion saavuttamiseksi, sappitiehyiden tyhjennystä suositellaan silloin, kun leikkaus on indikoitu, ja se saattaa lopulta vaatia laajamittaista hepatektomiaa, joka käsittää yli 50 % maksan tilavuudesta, tai trisegmentektomiaa, tai jos on sappitietulehdus. Bilirubiinipitoisuuden raja-arvosta, joka indikoi tyhjennystä, on kiistelty, ja >10mg/dl on yksi yleisimmin käytetyistä.5,37 On suositeltavaa, että sappitiehyen tyhjennys tehdään CTPH:lla ja että ulkoinen tyhjennys sijoitetaan, jolloin vältetään kasvaimen manipulointi. Näin infektioiden esiintyvyys on pienempi kuin CPRE:llä, ja niiden potilaiden kohdalla, joiden bilirubiiniarvot eivät normalisoidu, voidaan käyttää bilateraalista sappitie-dreeniä.35,40
Kasvaimen leviämistä punktiokohtaan on kuvattu jopa 5-10 %:ssa tapauksista, joissa käytettiin CTPH:ta,14,24 vaikkakaan näissä tutkimuksissa ei täsmennetä, milloin käytettiin ulkoista tai sisäistä ulkoista dreneerausta, eikä niissä oteta huomioon leikkauksen suorittamiseen kulunutta aikaa. Jotkut kirjoittajat suosittelevat endoskooppisesti sijoitetun nasobiliary-dreenin käyttöä leviämisen estämiseksi punktiokohdassa, jolloin sappitulehduksen ja stentin tukkeutumisen ilmaantuvuus on pienempi kuin CPRE:n yhteydessä41. Samoissa tutkimuksissa kuitenkin myönnetään, että preoperatiivisen bilateraalisen sappitiehyen tyhjennyksen toteuttaminen tällä järjestelmällä on vaikeaa, mikä vaikeuttaa bilirubiinipitoisuuden normalisoimista ennen leikkausta potilailla, joilla unilateraalinen tyhjennys ei ole onnistunut.42
Vähentääksemme preoperatiivisen sappitiehyen tyhjennyksen jälkeistä infektioihin liittyvää sairastuvuutta ehdotetaan, että sappitiehyeestä viljellään systemaattisesti sappitiehyen tyhjennyksen jälkeen ja leikkauksen aikana. Useat tutkimukset ovat osoittaneet, että 78-94 % näistä viljelmistä on positiivisia tyhjennetyillä potilailla verrattuna 20-30 %:iin tyhjentämättömillä potilailla,43-45 ja enterokokki on yleisin eristetty organismi. Nämä ryhmät puolustavat ennaltaehkäisevien antibioottien käyttöä, sillä vaikka ne lisäävät eristettyjen lajien antibioottiresistenssiä, julkaistuissa tutkimuksissa on osoitettu, että näin saavutetaan leikkauksen jälkeinen infektiosairastuvuus, joka on samanlainen kuin salaojittamattomilla ryhmillä. Valittu antibiootti riippuu viljelmistä ja antibioottikuvasta, vaikka suurin osa ryhmistä käytti vähintään kolmannen sukupolven kefalosporiinia tai fluorokinoloneja+metronidatsolia, kun viljelmää ei ollut saatavilla tai kun se oli negatiivinen.43,44,46
Palliatiivista sappitie-dreeniä käytetään potilailla, joille ei voida tehdä resektiota. Tyhjennys voidaan tehdä ERCP:llä, jolloin pinnoitettu metallistentti jätetään, tai CTPH:lla niissä tapauksissa, joissa ERCP:llä ei ole mahdollista saada aikaan molempien sappiteiden oikeaa tyhjennystä.
Siten lopullisesti preoperatiivista sappitiehyen tyhjennystä tulisi käyttää kaikilla potilailla, joiden bilirubiini on yli tai yhtä suuri kuin 10 mg/dl, ja niillä potilailla, joilla maksan resektio on yli 50 %:n suuruinen maksan tilavuudesta. Lähestymistapa riippuu sairaalasta, vaikkakin CTPH:ta ja ulkoista tyhjennystä suositellaan kasvaimen manipuloinnin välttämiseksi ja sappitietulehduksen vähäisemmän esiintyvyyden vuoksi. Jotkut kirjoittajat suosittelevat, että tyhjennetyt potilaat saavat sappiviljelmiin sopivia profylaktisia antibiootteja.
Preoperatiivinen portaaliembolisaatio
Preoperatiivinen portaaliembolisaatio kuvattiin 1980-luvulla, aluksi Makuuchi ym.47 ja sittemmin Kinoshita ym.48 Portaaliembolisaatiolla pyritään lisäämään jäljellä olevaa maksatilavuutta niissä tapauksissa, joissa sitä pidetään preoperatiivisessa tilavuuden mittauksessa riittämättömänä, ja näin vähennetään postoperatiivisen maksan vajaatoiminnan todennäköisyyttä. Higuchin ja Yamamoton äskettäin julkaisemassa metaanalyysissä49 , johon kuului 836 potilasta, joilla oli PHC ja joille tehtiin preoperatiivinen portaaliembolisaatio, sairastuvuus oli 1 prosentti ja kuolleisuus 0,09 prosenttia. Kasvaimen eteneminen toimenpiteen aikana, joka esti leikkauksen, oli 19,4 prosenttia. Nämä tulokset tukevat ajatusta siitä, että sen käyttö PHC:ssä on perusteltua niillä potilailla, joiden jäljellä oleva preoperatiivinen maksatilavuus on alle 30 %.
Staging-laparoskopia
Kun ei-invasiivisten kuvantamistutkimusten herkkyydessä ja spesifisyydessä on viime vuosina tapahtunut edistystä, staging-laparoskopia on jäämässä pois käytöstä. Tärkeimmät leikkauskelvottomuuden kriteerit ovat imusolmukkeiden osallistuminen, sappitiehyen laajeneminen ja verisuonten tunkeutuminen. Näitä on vaikea arvioida laparoskopiassa, jonka tarkkuus ja tehokkuus ovat laskeneet jo vuosia. Tämä käy ilmi Rotellarin ja Pardon äskettäisestä tarkistuksesta50 , jossa tarkkuus oli 41 prosenttia ja tehokkuus 72 prosenttia vuonna 2002 ja 14 prosenttia ja 32 prosenttia vuonna 2011 julkaistuissa tutkimuksissa. Tämä lasku johtuu pääasiassa ei-invasiivisten testien, kuten MR-kolangiografian, kehittymisestä. Sen tehokkuus paranee, jos valitaan potilaat, joilla on suuri riski vatsakalvon leviämiseen tai maksametastaasien syntymiseen, jolloin vältytään tarpeettomilta laparotomioilta.50-52 Ei-invasiivisia kuvantamistekniikoita suositellaan pitkälle edenneissä vaiheissa (T2/3/4), joissa vatsakalvon tai imusolmukkeiden osallistuminen voi olla pitkälle edennyttä ja joita ei voida lävistää kaikukuvausendoskopian avulla, ennen kuin luodaan preoperatiivinen sappiteiden tyhjennys. Teemme aina staging-laparoskopian käyttäen intraoperatiivista ultraäänitutkimusta parantaaksemme herkkyyttä paikallisen alueen ja imusolmukkeiden osallistumisen suhteen.53
Kirurginen hoito
Kirurginen hoito on edelleen PHC:n ainoa parantava hoito,3,14 ja sillä saavutetaan 20-40 prosentin eloonjäämisprosentti viidessä vuodessa (taulukko 2).10,11 Kirurginen resektio on aina suoritettava, jos R0-resektio on mahdollista saavuttaa. Tärkeimmät tekijät, jotka vaikuttavat eloonjäämiseen leikkauksen jälkeen, ovat resektiorajojen osallistuminen joko mikroskooppisesti (R1) tai makroskooppisesti (R2) yhdessä imusolmukkeiden osallistumisen kanssa (N1 ja N2).14,17,44,54 Useat tutkimukset ovat osoittaneet, että eloonjäämisennuste paranee, jos resektiota laajennetaan negatiivisten marginaalien luomiseksi.3,5,33,45 Ehdotettuja tekniikoita ovat laajennettu hepatektomia, jossa resekoidaan kaudaattisegmentti, sappitiehyiden resektio, hilarinen lymfadektomia keliakian runkoon asti ja rekonstruktio hepatojejunostomialla.
Survival Following Resection of the PHC According to the Series Published.
| Tekijä | Vuosi | Tapaukset | Selviytyminen 5 vuoden kuluttua (%) |
|---|---|---|---|
| DeOliveira ym. | 2007 | 35 | 10 |
| Lladó ym. | 2008 | 62 | 43 |
| Figueras ym. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20.2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Survival following hepatic resection due to perihilar cholangiocarcinoma.
Vain 2 vuoden seuranta.
Ensimmäisen kerran Neuhaus ym. kuvaama ”ei kosketusta tekniikka”.32 tarkoittaa maksan hilumin lohkoresektiota ilman kasvaimen manipulointia, mikä lisää potilaiden elossaoloaikaa 5 vuoteen yli 15 prosentissa tapauksista.3,33,34,55 Tämä tekniikka koostuu periaatteessa porttilaskimon ja oikean maksavaltimon resektiosta silloin, kun ne ovat lähellä kasvainta, jolloin estetään sen dissektio, jos tämä edellyttää kasvaimen manipulointia, sekä täydellisestä sappitieresektiosta, johon liittyy laaja lymfadenektomia aina keliakian juurelle asti, ja rekonstruktiosta hepaticojejunostomialla. On suositeltavaa valita oikea maksalohko (Neuhausin mukaan olennainen ”koskemattomuustekniikka”)33 sillä edellytyksellä, että kasvaimen laajeneminen mahdollistaa oikean maksavaltimon, joka on lähimpänä kasvainta, poistamisen. Tämäntyyppinen radikaalileikkaus johtaa hyväksyttävään postoperatiiviseen sairastuvuuteen, joka on 50-70 prosenttia kyseisestä sarjasta riippuen, ja kuolleisuus on 10-20 prosenttia.3,5 PHC-potilaiden eloonjäämisaste 5 vuoden kuluttua on 20-40 %, kun taas tutkimuksissa, joissa on julkaistu porttilaskimon resektio, ja sarjoissa, joissa on käytetty ”no-touch-tekniikkaa”, eloonjäämisaste on 58 % 5 vuoden kuluttua (kuvat 2 ja 3).3,5,33
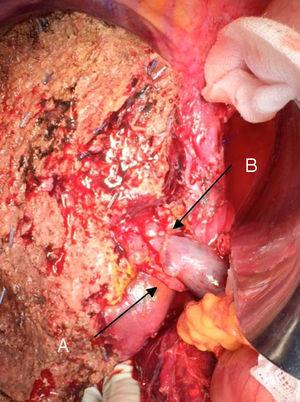
Vasemmanpuoleinen hepatektomia Klatskinin kasvaimen vuoksi, porttilaskimon resektio: (A) oikeanpuoleinen maksavaltimo ylemmästä mesenteriumista; (B) porttilaskimo.
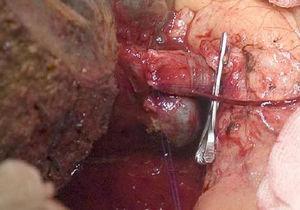
Oikea hepatektomia ja porttilaskimon rekonstruktio.
On myös tärkeää korostaa viimeaikaisia tutkimustuloksia, jotka osoittavat, että porttilaskimon resektio lisää niiden potilaiden eloonjäämisaikaa, joilla on preoperatiivinen verisuonten osallistuminen. Heidän eloonjäämisnopeutensa on jopa sama tai korkeampi kuin niiden potilaiden, joilla ei ole preoperatiivista verisuonitulehdusta ja joille ei näin ollen tehty portaaliresektiota.33,56,57 Näissä tutkimuksissa maksan ja verisuonten komplikaatioiden ilmaantuvuus on samankaltainen kuin ryhmässä, jossa ei ole tehty portaaliresektiota, lukuun ottamatta niitä potilaita, joille on tehty valtimoiden resektio, sillä näillä potilailla sairastuvuus on suurempi kuin muilla. Kaikkien näiden seikkojen vuoksi suositellaan leikkausta niille potilaille, joilla on yksipuolinen portaalin osallistuminen tai jotka ovat osallistuneet confluenssiin preoperatiivisissa testeissä, suorittamalla en-bloc-resektio ja verisuonirekonstruktio. Valtimoiden resektiota ja rekonstruktiota ei suositella, ellei valtimo ole selvästi vaurioitunut, koska tämä liittyy huonompiin postoperatiivisiin tuloksiin, joten tällaisissa tapauksissa oikea hepatektomia on parempi vaihtoehto.
Yhteenvetona voidaan todeta, että noudatettavat kirurgiset periaatteet ovat seuraavat: radikaalileikkaus, johon kuuluu sappitie- ja kaudaattiresektio ja lymfadenektomia, R0-marginaalilla ja ilman kasvaimen manipulointia, vaikka tähän liittyykin porttilaskimon ja maksavaltimon resektio ja rekonstruktio.
Johtopäätökset
Nykytilanteessa ainoa parantava hoitomuoto on kirurginen resektio. Radikaali en-bloc-resektio ja verisuonirekonstruktio on tekniikka, jolla on saavutettu korkein eloonjäämisaste pitkällä aikavälillä. Leikkauksen jälkeisen sairastuvuuden vähentämiseksi on suositeltavaa tehdä sappitiehyen tyhjennys maksan vajaatoiminnan estämiseksi, antibioottiprofylaksia tyhjennyksen jälkeen ja portaaliembolisaatio, kun maksan jäljellä oleva tilavuus on tulevaisuudessa alle 30 prosenttia. R0-resektio, imusolmukkeiden osallistuminen ja etämetastaasit ovat edelleen tärkeimmät ennustetekijät.
Interesseiden ristiriita
Tätä tarkistusta ei ole esitelty tai julkaistu osittain tai kokonaan missään lehdessä tai kongressissa.
Tämä tarkistusta ei ole esitetty tai julkaistu osittain tai kokonaan missään lehdessä tai kongressissa.