Kemia auttaa meitä ymmärtämään ympäröivän maailman ominaisuuksia ja koostumusta. Täällä opit aineen olomuodoista sekä paljon yhdestä tietystä olomuodosta (kolme arvausta – se ei ole kiinteä tai nestemäinen…).
Aineen olomuodot
Lämpötilasta, paineesta ja aineen ominaisuuksista riippuen aine voi saada erilaisia olomuotoja. Kutsumme näitä fysikaalisia muotoja aineen olomuodoiksi. On olemassa kolme hyvin tunnettua aineen olomuotoa: Kiinteät aineet, nesteet ja kaasut. Myös muita olomuotoja on olemassa. Niitä ovat esimerkiksi plasma (kaasun kaltainen aineen olomuoto, mutta se sisältää vapaasti liikkuvia elektroneja ja ioneja – atomeja, jotka ovat menettäneet elektroneja) ja Bose-Einsteinin kondensaatit (BEC) (aineen aallot, joita voi esiintyä joidenkin atomityyppien kohdalla erittäin kylmissä lämpötiloissa).
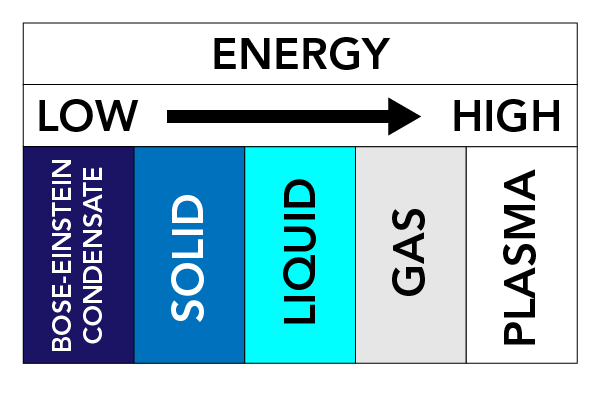
Hiukkasten väliset voimat ja hiukkasiin kohdistuva paine pitävät hiukkaset yhdessä. Jos lämmitämme ainetta (lisäämme energiaa), hiukkaset alkavat liikkua nopeammin ja niillä on taipumus levitä toisistaan. Tällä hiukkasten liikkeellä on suuri vaikutus aineen tilaan.
Kiinteät aineet
Kiinteissä aineissa hiukkasia yhdessä pitävät voimat ovat suhteellisen voimakkaita, ja hiukkaset pysyvät hyvin lähellä toisiaan. Hiukkaset voivat värähdellä, mutta ne eivät juurikaan liiku. Siksi kiinteät aineet ovat kovia ja jäykkiä. Itsekseen jätettynä kiinteät aineet säilyttävät muotonsa.
Nesteet
Nesteissä hiukkasten väliset voimat ovat heikompia kuin kiinteissä aineissa. Hiukkaset ovat edelleen melko lähellä toisiaan, mutta voivat liikkua vapaasti. Nesteet voivat virrata ympäriinsä astian sisällä, eikä niillä ole mitään tiettyä kiinteää muotoa.
Kaasut
Kaasuihin on vaikea suhtautua, koska ne ovat usein näkymättömiä, mutta niitä on kaikkialla. Ne voi tuntea, kun esimerkiksi tuuli puhaltaa. Niitä voi joskus haistaa, kun esimerkiksi haistaa kypsennettävän ruoan hajun tai kun haisunäätä on pahoinpidelty. Jotkut kaasut ovat tärkeitä terveydellemme (esim. happi), kun taas toiset voivat olla tappavia (esim. rikkivety ja kloori). Ennen leikkausta saatat saada kemikaaleja sisältävää nukutuskaasua, joka lievittää kipua ja tekee sinut tajuttomaksi toimenpiteen ajaksi. Kaasut aiheuttavat myös räjähdysten voiman. Tutustutaanpa tarkemmin kaasuihin.
Kaasujen tyypit
On olemassa alkuainekaasuja (koostuvat yhdestä alkuaineesta) ja kaasuja, jotka ovat yhdisteitä (koostuvat useammasta kuin yhdestä alkuaineesta). Alkuainekaasujen symbolit löytyvät mistä tahansa alkuaineiden jaksollisesta järjestelmästä. Ne on esitetty tiivistetysti alla olevassa taulukossa.
Diatomaattinen kaasu |
Kemiallinen kaava |
Monatominen Kaasu |
Kemiallinen kaava |
|
Vety |
H2 |
Helium |
He |
|
Happi |
O2 |
Neon |
Ne |
|
Typpi |
N2 |
Argon |
Ar |
|
Fluori |
F2 |
Krypton |
Kr |
|
Kloori |
Cl2 |
Xenon |
Xe |
Kaksiatomisella kaasulla tarkoitetaan kaasua, jonka perusyksikkönä on kahdesta toisiinsa liittyneestä atomista koostuva molekyyli. Yksiatominen kaasu on kaasu, jonka perusyksikkö on yksi atomi. Useimmat kaasut ovat kuitenkin yhdisteitä, joissa kaksi tai useampi eri alkuaine on kemiallisesti yhdistynyt. Yleisin niistä on vesihöyry, H2O. Seuraavassa luetellaan joidenkin yhdyskaasujen nimet, kaavat ja käyttötarkoitukset:
Yleisnimi |
Kemiallinen kaava |
Missä olet tavallisesti löytyy |
|
Hiilidioksidi |
CO2 |
Atmosfääri, autojen pakokaasut, pop, keuhkomme |
|
propaani |
C3H8 |
grillit, retkikeittimet, joidenkin ajoneuvojen polttoaine |
|
Metaani |
CH4 |
Kasvihuonekaasupäästöjen komponentti. kaasu ja maakaasu |
|
Ammonia |
NH3 |
Käytetään lannoitteiden valmistukseen, puhdistusaineet |