Introducción
Esta neoplasia, originada en el epitelio de las vías biliares, o colangiocarcinoma (CC), representa el 10% de los tumores hepatobiliares y el 2% de los tumores malignos.1,2 El CC puede dividirse en 3 subtipos, según su origen anatómico dentro de la vía biliar: el CC intrahepático o periférico (CCI), el CC perihiliar o tumor de Klatskin (TK) y el CC distal.
El TK, objeto de esta revisión, es el más frecuente, y representa alrededor del 40%-60% de todos los CC.2,3 Este tumor es agresivo y silencioso, con síntomas inespecíficos hasta estadios avanzados, lo que conlleva un diagnóstico tardío y una corta supervivencia sin cirugía de 6 a 12 meses.4 La cirugía, que es la única opción curativa disponible, sólo es posible en aproximadamente el 47% de los pacientes en el momento del diagnóstico.5-8 Los factores pronósticos más importantes de este tumor suelen estar asociados a las opciones quirúrgicas, siendo el estadio tumoral, el tamaño, la afectación ganglionar y vascular, las metástasis intrahepáticas y el tipo histológico los factores más importantes.9-11
Espacio anatómico
El espacio anatómico ocupado por la APS estaría delimitado por la entrada al conducto quístico a nivel distal, y la bifurcación de los conductos hepáticos derecho e izquierdo a nivel proximal.1,12 Las clasificaciones más utilizadas incluyen todos los CC que se originan en la confluencia biliar o sus alrededores. Algunos grupos han sugerido que los CC originados en el parénquima hepático a veces pueden invadir la confluencia biliar, con un origen en el espacio anatómico delimitado por la fuente de la rama posterior de la vena porta derecha y el ligamento falciforme.13-15 Estos CCI que afectan a la confluencia biliar se tratarían de la misma forma que los tumores de origen extrahepático, y la supervivencia es similar a la de los CPS en el mismo estadio. Suelen ser tumores muy desarrollados con invasión vascular y ganglionar locorregional. Las dudas sobre el comportamiento biológico de estos tumores han llevado a muchos grupos a excluirlos de los tumores perihilares. En un estudio publicado por Ebata et al.13,15 de 250 pacientes resecados por CC con afectación de la confluencia, se analizó el estadio y la supervivencia en función de si el tumor era intrahepático con afectación de la confluencia (CCI), o si el origen del tumor estaba en la vía biliar extrahepática (PHC). Un total de 83 pacientes presentaban ICC y 167 PHC. Cuando se compararon los estadios, los pacientes con CPI mostraron una mayor frecuencia de afectación vascular y ganglionar, con un TNM superior al del grupo de APS, presentando los estadios iii y iv en el 59% de los casos, frente al 38% del grupo de APS. No obstante, si se divide la supervivencia según los estadios en ambos grupos, no hay diferencias estadísticamente significativas a los 5 años, con una supervivencia global ligeramente superior en el grupo de APS (20% vs 29%, respectivamente; P=.057), por lo que se concluyó que son comparables en cuanto a tratamiento y supervivencia. Con la mejora de las pruebas diagnósticas y el conocimiento histopatológico, en el futuro podremos definir mejor si son 2 entidades distintas o si son clínica y biológicamente lo mismo.
Características histopatológicas
El 90% de los PHC son adenocarcinomas. El 10% son carcinomas adenoescamosos o escamosos, que en algunos casos se han asociado a antecedentes de litiasis, quistes o anomalías de las vías biliares. Según el aspecto del tumor, el tipo de crecimiento y el comportamiento biológico y clínico de la CPH, se clasifican en16,17:
- –
CC tumoral o «formador de masa»: es la forma de presentación más frecuente en la CPI, aunque también puede encontrarse en un gran número de CPH. Se caracteriza por la formación de una masa tumoral con márgenes claramente definidos. Presenta una importante reacción fibrótica y también es frecuente la necrosis central. Este tumor se origina en el orificio de la vía biliar, invadiendo la pared y diseminándose al crecer tridimensionalmente, formando una masa nodular que da lugar a síntomas obstructivos.16-19
- –
CC periductal infiltrante: los tumores de este tipo crecen a lo largo de una vía biliar en forma de engrosamiento longitudinal concéntrico a través del tejido conectivo que rodea el conducto, causando estenosis u obstrucción completa de la vía biliar afectada.19 La mayoría de los CPS son de este tipo, y son difíciles de identificar mediante técnicas de imagen.17
- –
CC intraductal o papilar intraductal: esta variedad se caracteriza por la presencia de tumores superficiales e intraluminales en el conducto biliar. Producen mucina y provocan la obstrucción y dilatación parcial de los conductos.16 Este tumor tiene un bajo grado de malignidad y suele ser de pequeño tamaño, aunque puede diseminarse a través de la mucosa biliar, dando lugar a múltiples tumores (papilomatosis o carcinomatosis papilar).20
La importancia de esta diferenciación radica en las variaciones de supervivencia según el subtipo de que se trate. Varios estudios han demostrado que los pacientes con el tipo papilar intraductal tienen un mejor pronóstico que los de las variedades esclero-nodulares,21 con una supervivencia media de 55 y 33 meses, respectivamente,22 mientras que la afectación vascular y ganglionar es menos frecuente en el subtipo papilar intraductal.
En resumen, la mayoría de los APS son adenocarcinomas con un patrón de crecimiento periductal que les confiere un peor pronóstico, mientras que la variante con crecimiento intraductal es la menos frecuente, aunque tiene un mejor pronóstico.
Sistemas de estadificación
Los sistemas de estadificación de los APS pueden diferenciarse en clasificaciones pre y postoperatorias. De las primeras, que se utilizan al planificar la cirugía, el sistema más importante es la clasificación de Bismuth-Corlette. Ésta indica cuál es el lóbulo preferentemente afectado y, por tanto, muestra el tipo de hepatectomía que debe utilizarse (Fig. 1).23 Esta clasificación se inventó en los años 70 y no tiene en cuenta la afectación de los ganglios linfáticos ni las metástasis, por lo que actualmente tiene menos valor pronóstico.
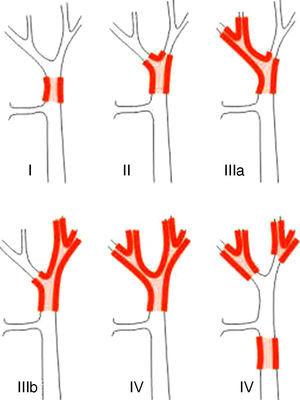
La clasificación de Bismuth-Corlette23.
Otra clasificación preoperatoria utilizada en EEUU es la publicada por Jarnagin et al.10 del Memorial Sloan Kettering Cancer Centre, Nueva York. Esta clasificación pretende predecir la resecabilidad de los tumores, teniendo en cuenta 3 factores de extensión local. Éstos son la extensión biliar, la afectación vascular y la atrofia del lóbulo. Esta clasificación no tiene en cuenta la afectación de los ganglios linfáticos ni las metástasis, por lo que su valor pronóstico es menor. Como la resecabilidad difiere de un grupo a otro, mientras que la tendencia es hacia tratamientos cada vez más agresivos, su valor dependerá de los criterios de no resecabilidad de cada centro. En la actualidad, la afectación local no debería ser un criterio de no resecabilidad, a condición de que seamos capaces de conseguir un R0 con la resección quirúrgica.
De las clasificaciones postoperatorias, la más utilizada es la clasificación TNM de la Unión para el Control Internacional del Cáncer (UICC), séptima edición.12 Esta clasificación tiene en cuenta datos patológicos como la extensión local, la afectación vascular, la afectación de los ganglios linfáticos y las metástasis, para establecer una clasificación que incluye la extensión del tumor y es de carácter pronóstico.
Recientemente el «Japanese Study Group on Perihilar Cholangiocarcinoma» (JSGPH) publicó un estudio en el que se proponía modificar la clasificación de la «Union for International Cancer Control». Las diferencias básicas se muestran en la Tabla 1, y consisten principalmente en13:
-
No considerar el bismuto IV como T4. Por tanto, la clasificación de la JSGPH no tiene en cuenta la extensión biliar bilateral como mal pronóstico si se consigue una resección R0.
-
Respecto a los estadios, prioriza la afectación ganglionar como peor pronóstico. Por tanto, consideran la afectación ganglionar como estadio iva y no iiib (TNM7).
Comparación de las diferencias básicas entre la clasificación TNM 7 de la UICC y la propuesta por la JSGPH.
| Clasificación de los tumores | UICC | Propuesta de la JSGPH |
|---|---|---|
| Tis | Carcinoma in situ | |
| T1 | Tumor confinado en la vía biliar | |
| T2a | Supera la pared del conducto e invade el tejido adiposo perihilar | |
| T2b | Invade el parénquima hepático | |
| T3 | Invasión unilateral de la arteria/vena hepática | |
| T4 | Invasión de la rama principal de la HA/PV, Bismuto IV, o Bismuto III con invasión contralateral de la A/V | Invasión vascular de la rama principal de la HA/PV con invasión bilateral vascular o contralateral |
| TNM estadio | ||
| 0 | Tis N0 M0 | |
| I | T1 N0 M0 | |
| II | T2 N0 M0 | |
| IIIa | T3 N0 M0 | |
| IIIb | T1-3 N1 M0 | T4 N0 M0 |
| Iva | T4 N× M0 | T× N1 M0 |
| Ivb | T× N× M1 | |
HA, arteria hepática; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, metástasis en los ganglios linfáticos del tumor; UICC, Union for International Cancer Control; PV, vena porta.
A nivel europeo se ha creado un registro internacional de tumores perihiliares tratados quirúrgicamente, liderado por el «International Cholangiocarcinoma Group for the Staging of PHC». Este grupo ha publicado una nueva clasificación1 que tiene en cuenta el tamaño del tumor, junto con la afectación biliar, venosa, arterial, ganglionar y metastásica, tanto en el preoperatorio como en el postoperatorio. Sin embargo, las restricciones de esta clasificación son que se limita a describir las características del tumor y la cirugía a realizar, sin llegar a dividir a los pacientes en grupos o estadios en función de estas variables. En consecuencia, no es posible extraer conclusiones pronósticas y tampoco es posible comparar los resultados de los diferentes grupos.
Publicaciones anteriores muestran que la clasificación preoperatoria más utilizada actualmente para decidir el tipo de resección es la de Bismuth-Corlette, mientras que la clasificación TNM 7 se utiliza para definir el pronóstico a largo plazo.
Estrategias de diagnóstico
Los síntomas que se asocian con mayor frecuencia a la APS son: ictericia (90%), pérdida de peso y dolor abdominal (35%), prurito (26%) y colangitis aguda (10%).17 Debido a estos síntomas el diagnóstico inicial se suele realizar mediante ecografía abdominal, siendo ésta una buena prueba de cribado. Otras pruebas diagnósticas para este tipo de tumores serían:
- –
Una ecografía Doppler abdominal: permite evaluar la permeabilidad arterial y portal (trombosis), lo que puede condicionar la resecabilidad del tumor y la estrategia terapéutica, aunque no es la prueba de elección para la evaluación de la afectación vascular.
- –
Tomografía axial computarizada abdominal: es útil para el diagnóstico del tumor primario y de la extensión de la enfermedad, con una sensibilidad del 80% en la evaluación de la extensión biliar. Es la técnica de elección para la evaluación preoperatoria de la anatomía vascular, con una sensibilidad del 93% y 87% para la evaluación de la afectación arterial y portal, respectivamente. Tiene una baja sensibilidad para la evaluación preoperatoria de la afectación ganglionar (50%).14,24 También es útil para realizar pruebas volumétricas y calcular el volumen hepático restante tras la resección quirúrgica. También es la prueba más económica para la estadificación preoperatoria.
- –
Resonancia magnética y colangiografía por resonancia magnética (RM-colangiografía): es la mejor prueba para el diagnóstico del tumor primario y para evaluar la extensión biliar. Tiene una sensibilidad del 86%-100%, y es mejor que la colangiografía directa, siendo además una prueba no invasiva.25 Por otro lado, tiene una baja sensibilidad para la evaluación de la afectación vascular (73%) y una sensibilidad del 80% para la invasión del parénquima hepático.
- –
Colangiografía directa: colangiopancreatografía retrógrada endoscópica (CPRE) y colangiografía hepática transparietal (CPT): nos informan del nivel de obstrucción biliar y permiten tomar muestras de la lesión para citología, con una sensibilidad del 20%. Actualmente han sido sustituidas en el diagnóstico por la colangiografía por RM. Son muy útiles para el drenaje biliar preoperatorio y en el tratamiento paliativo de la APS, con la inserción de stents preferentemente recubiertos de metal.26-28
- –
Ecografía endoscópica: es útil para la evaluación de la afectación ganglionar en la zona del tronco celíaco y la región peripancreática, estableciendo la estadificación preoperatoria y posibilitando la toma de biopsias por aspiración con aguja fina.
- –
Tomografía por emisión de positrones: es útil en el estudio de pacientes con sospecha de afectación metastásica así como de afectación de adenopatías en el tronco celíaco. Su sensibilidad es controvertida, pudiendo variar entre el 38% y el 90%, según las series publicadas.14,24,29
- –
Marcadores tumorales: tienen una utilidad limitada, siendo el CA 19,9 el más utilizado. La mayoría de los estudios los han evaluado en neoplasias de páncreas y en CC en menor medida, sin especificar su localización o características. Los niveles en suero de estos marcadores están fuertemente influenciados por la obstrucción biliar y la ictericia debido a su eliminación biliar. Se han propuesto diferentes valores normales, dependiendo de la presencia de hepatopatía (300U/ml) o ictericia (1000U/ml), mientras que en el cáncer de páncreas se obtienen sensibilidades superiores al 70%, con niveles de especificidad superiores al 95%. Su concentración en estos pacientes es muy variable y no se correlaciona con el tamaño del tumor, aunque sí con la afectación metastásica. La sensibilidad y especificidad de este marcador puede incrementarse combinándolo con el CEA, sobre todo en los casos de Lewis A negativo (no productores de CA 19.9).30
De los datos anteriores se deduce que solemos iniciar el estudio con una ecografía para el diagnóstico de la APS. Esto tiene lugar en el contexto de un paciente con ictericia, mientras que la tomografía computarizada y la colangiografía por RM son las mejores pruebas de estadificación y las más recomendables antes de la cirugía. La RM o la tomografía computarizada pueden utilizarse para las pruebas volumétricas, dependiendo del tipo de aparatos o programas informáticos disponibles en cada hospital. En caso de duda sobre la diseminación a los ganglios linfáticos, que puede contraindicar la cirugía, se recomienda la tomografía por emisión de positrones o la endoscopia por aspiración con aguja fina.
Criterios de no resecabilidad
La cirugía es el único tratamiento curativo para la APS, y ofrece la mejor supervivencia a largo plazo. Los criterios adoptados para la resección quirúrgica se han ampliado en los últimos años, desde los descritos inicialmente por el equipo del Memorial Sloan Kettering Cancer Center por Burke et al.31 en 1998, hasta la reciente introducción de enfoques que utilizan la resección vascular y las hepatectomías ampliadas.3,5,32-34 Los criterios de no resecabilidad varían de un hospital a otro, y los más extendidos son: afectación vascular de un lado con afectación biliar contralateral hasta la división de los radicales de segundo nivel, metástasis hepáticas a distancia, afectación vascular de ambos lóbulos hepáticos, afectación extrahepática o peritoneal y afectación adenopática del tronco celíaco, de la arteria mesentérica superior o de la región paraaórtica.3,5,8,31
En un estudio multicéntrico publicado por De Jong et al.34 en el que se analizaron 305 pacientes operados de APS en 7 centros diferentes de EE.UU. y Europa, y en el que se incluyeron pacientes con afectación portal, en el análisis multivariable los 2 únicos factores pronósticos estadísticamente significativos fueron la afectación del margen de resección y la afectación ganglionar (P=.02). En el estudio publicado por Ebata et al15 , en el que se analizaron 1352 pacientes operados en 8 hospitales japoneses de APS con intención curativa, el análisis multivariable de los factores pronósticos estadísticamente significativos mostró que eran: la invasión vascular, la invasión del páncreas, la afectación ganglionar, la presencia de metástasis y la afectación del margen de resección. La afectación de los ganglios linfáticos y la metástasis fueron los factores que condujeron a una peor supervivencia a los 5 años en comparación con los demás (10%, 20% y 63%, respectivamente). Estos resultados apoyan el uso de la cirugía para estos tumores, si a pesar de la extensión local es posible realizar una resección R0, dado que es posible aumentar la supervivencia a 5 años independientemente de la extensión local.
Debido a todas las consideraciones anteriores se recomienda evaluar cada caso individualmente, y utilizar la cirugía si se puede conseguir una resección R0 en ausencia de metástasis a distancia o afectación peritoneal. Por tanto, la afectación biliar y vascular local no deben ser criterios de no resecabilidad si es posible operar preservando más del 30% del volumen hepático y logrando una resección oncológica.
Estrategias terapéuticasDrenaje biliar
Dado que la mayoría de los pacientes con APS debutan con ictericia, uno de los dilemas más importantes se refiere a la utilidad del drenaje biliar preoperatorio. Sin embargo, éste no está exento de complicaciones, y las asociadas a la CPRE con inserción de un stent son: pancreatitis, perforación duodenal, migración duodenal, obstrucción del catéter y, sobre todo, colangitis. El drenaje por CTPH presenta una menor frecuencia de colangitis preoperatoria, pero se asocia a hemorragia, migración del catéter, hasta un 5% de diseminación tumoral dentro del trayecto del catéter y molestias y dolor en la zona de entrada. En general, según los estudios publicados, la CPRE tiene una morbilidad asociada del 60%, y la cifra correspondiente a la CTPH es del 31%.14,35
Debido a las razones anteriores, se ha cuestionado la utilidad del drenaje biliar preoperatorio en la cirugía hepatobiliopancreática.36,37 Estos estudios, que incluyen todos los tipos de cirugía hepatobiliar, han demostrado que el drenaje biliar preoperatorio en pacientes con ictericia aumenta la morbilidad asociada sin mejorar la supervivencia, aumentando principalmente las complicaciones relacionadas con las infecciones. El estudio multicéntrico europeo publicado en 2013 por Farges et al.38 analizó de forma retrospectiva a 366 pacientes que habían sido sometidos a hepatectomía o hepatectomía ampliada y resección biliar por APS. Se clasificaron en función de si se había realizado o no un drenaje biliar preoperatorio. El grupo sin drenaje preoperatorio (sin DBP) estaba compuesto por 186 pacientes, y el grupo con drenaje biliar (DBP) contenía 180 pacientes. Los grupos eran homogéneos en cuanto a edad, estadio tumoral y resección portal. El grupo con PBD presentó más hepatectomías derechas (56% frente a 44%). Cuando se compararon ambos grupos según el tipo de cirugía realizada, los pacientes sometidos a hepatectomía derecha mostraron un mayor número de fallos hepáticos postoperatorios si pertenecían al grupo de no PBD, con una incidencia del 16% frente al 4% en el grupo de PBD (P=.009). En el análisis multivariable de los factores asociados a una mayor mortalidad en el grupo de hepatectomía derecha, tener niveles de bilirrubina inferiores a 3mg/dL antes de la cirugía fue un factor estadísticamente significativo. Sin embargo, si se comparan ambos grupos de pacientes sometidos a hepatectomía izquierda, el grupo con DBP presentó un mayor número de sepsis postoperatorias, con una incidencia del 6%, frente al 0% del grupo sin DBP (p=0,014). Este estudio demuestra que si bien es cierto que el drenaje biliar aumenta la incidencia de sepsis postoperatoria, el drenaje biliar debe realizarse en aquellos pacientes que van a ser sometidos a hepatectomía derecha para reducir la morbimortalidad asociada a la insuficiencia hepática postoperatoria, y otros estudios apoyan esta teoría.39 Dado que en el tratamiento de la APS los únicos estudios que han demostrado una mayor supervivencia son los que apoyan las resecciones extensas para conseguir la resección R0, se recomienda el drenaje biliar cuando está indicada la cirugía, que eventualmente puede requerir una hepatectomía extensa de más del 50% del volumen hepático o una trisegmentectomía, o si hay colangitis. Existe controversia sobre el punto de corte en los niveles de bilirrubina para indicar el drenaje, siendo >10mg/dL uno de los más utilizados.5,37 Se recomienda realizar el drenaje biliar por CTPH, con colocación de drenaje externo, lo que evita la manipulación del tumor. Esto tiene una menor incidencia de infecciones que la CPRE y permite, en aquellos pacientes con drenaje unilateral que no normalizan sus niveles de bilirrubina, utilizar un drenaje biliar bilateral.35,40
Se ha descrito la diseminación del tumor en la zona de punción hasta en un 5%-10% de los casos en los que se utilizó la CTPH,14,24 aunque estos estudios no especifican cuándo se utilizó el drenaje externo o interno-externo, y no tienen en cuenta el tiempo transcurrido hasta la cirugía. Algunos autores recomiendan el uso de drenaje nasobiliar en posición endoscópica para evitar la diseminación en el punto de punción, con una menor incidencia de colangitis y obstrucción de la endoprótesis que en el caso de la CPRE41. Sin embargo, los mismos estudios admiten la dificultad del drenaje biliar bilateral preoperatorio con este sistema, lo que dificulta la normalización de los niveles de bilirrubina antes de la cirugía en los pacientes en los que ha fracasado el drenaje unilateral.42
Para reducir la morbilidad asociada a las infecciones tras el drenaje biliar preoperatorio, se sugiere el cultivo sistemático de la bilis tras el drenaje y durante la cirugía. Varios estudios han demostrado que entre el 78% y el 94% de estos cultivos son positivos en los pacientes drenados, frente al 20%-30% en los pacientes no drenados,43-45 y el enterococo es el organismo más comúnmente aislado. Estos grupos defienden el uso de antibióticos profilácticos, que aunque aumentan la resistencia antibiótica de las especies aisladas, en los estudios publicados se demuestra que se consigue una morbilidad de infección postoperatoria similar a la de los grupos no drenados. El antibiótico seleccionado dependerá de los cultivos y del antibiograma, aunque la mayoría de los grupos utilizaron al menos una cefalosporina de tercera generación o fluoroquinolonas+metronidazol, cuando no se disponía de cultivo o éste era negativo.43,44,46
El drenaje biliar paliativo se utiliza en pacientes que no pueden ser sometidos a resección. El drenaje puede ser por CPRE, dejando un stent metálico recubierto, o por CTPH en aquellos casos en los que es imposible conseguir un correcto drenaje de ambas vías biliares mediante CPRE.
Por lo tanto, definitivamente, el drenaje biliar preoperatorio debe utilizarse en todos los pacientes con bilirrubina superior o igual a 10mg/dL y en aquellos en los que las resecciones hepáticas serán superiores al 50% del volumen hepático. El tipo de abordaje depende del hospital, aunque es recomendable la CTPH con drenaje externo para evitar la manipulación del tumor y la menor incidencia de colangitis. Algunos autores recomiendan que los pacientes drenados reciban antibióticos profilácticos adecuados a sus cultivos biliares.
Embolización portal preoperatoria
La embolización portal preoperatoria fue descrita en los años 80, inicialmente por Makuuchi et al.47 y luego por Kinoshita et al.48 El objetivo de la embolización portal es aumentar el volumen hepático remanente en aquellos casos en los que se considera insuficiente en la volumetría preoperatoria, reduciendo la probabilidad de fallo hepático postoperatorio. En un metaanálisis publicado recientemente por Higuchi y Yamamoto49 que incluyó 836 pacientes con APS con embolización portal preoperatoria, la morbilidad fue del 1% y la mortalidad del 0,09%. La progresión del tumor durante el procedimiento que impidió la cirugía fue del 19,4%. Estos resultados apoyan la idea de que su uso en la APS está justificado en aquellos pacientes con un volumen hepático preoperatorio remanente inferior al 30%.
Laparoscopia de estadificación
Con los avances en la sensibilidad y especificidad de las pruebas de imagen no invasivas en los últimos años, la laparoscopia de estadificación está cayendo en desuso. Los criterios más importantes para la no resecabilidad son la afectación de los ganglios linfáticos, la extensión biliar y la invasión vascular. Estos son difíciles de evaluar durante la laparoscopia, cuya precisión y eficacia han disminuido durante años. Así lo demuestra la reciente revisión de Rotellar y Pardo,50 en la que la precisión y la eficacia se situaban en el 41% y el 72%, respectivamente, en 2002, y en el 14% y el 32% en los estudios publicados en 2011. Este descenso se debe principalmente a la mejora de las pruebas no invasivas como la colangiografía por RM. Su eficacia aumenta si se seleccionan pacientes con alto riesgo de presentar diseminación peritoneal o metástasis hepáticas, evitando así laparotomías innecesarias.50-52 Las técnicas de imagen no invasivas se recomiendan en estadios avanzados (T2/3/4) que presentan posible afectación peritoneal o ganglionar avanzada, y que no pueden ser puncionados mediante ecoendoscopia antes de realizar el drenaje biliar preoperatorio. Siempre realizamos la laparoscopia de estadificación mediante ecografía intraoperatoria para mejorar la sensibilidad a la afectación locorregional y ganglionar.53
Tratamiento quirúrgico
La cirugía sigue siendo el único tratamiento curativo de la APS,3,14 y consigue una supervivencia del 20%-40% a los 5 años (Tabla 2).10,11 La resección quirúrgica debe realizarse siempre que sea posible conseguir una resección R0. Los principales factores que afectan a la supervivencia tras la cirugía son la afectación de los márgenes de resección, ya sea microscópica (R1) o macroscópica (R2) junto con la afectación de los ganglios linfáticos (N1 y N2).14,17,44,54 Varios estudios han demostrado que la supervivencia aumenta si se amplía la resección para crear márgenes negativos.3,5,33,45 Las técnicas propuestas incluyen hepatectomías ampliadas con resección del segmento caudado, resección biliar, linfadectomía hiliar hasta el tronco celíaco y reconstrucción con hepatoyeyunostomía.
Supervivencia tras la resección de la APS según las series publicadas.
| Autor | Año | Casos | Supervivencia a 5 años (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20,2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Supervivencia tras resección hepática por colangiocarcinoma perihilar.
Sólo 2 años de seguimiento.
La «técnica sin contacto» descrita por primera vez por Neuhaus et al.32 consiste en la resección en bloque del hilio hepático sin manipulación del tumor, aumentando la supervivencia de los pacientes hasta los 5 años en más del 15% de los casos.3,33,34,55 Esta técnica consiste básicamente en la resección de la vena porta y la arteria hepática derecha cuando están próximas al tumor, evitando así su disección si ésta implica la manipulación del mismo, junto con la resección biliar completa con linfadenectomía amplia hasta la raíz del tronco celíaco y la reconstrucción con hepaticoyeyunostomía. Será preferible seleccionar el lóbulo hepático derecho (la imprescindible «técnica sin toque», según Neuhaus),33 a condición de que la extensión del tumor permita incluir la arteria hepática derecha, que es la más cercana al tumor. Este tipo de cirugía radical conlleva una tasa de morbilidad postoperatoria aceptable, del 50%-70% según las series en cuestión, con una mortalidad del 10%-20%.3,5 La supervivencia de los pacientes de APS a los 5 años se sitúa entre el 20% y el 40%, mientras que los estudios publicados que incluyen la resección portal y las series que utilizan la «técnica sin contacto» alcanzan el 58% a los 5 años (Figs. 2 y 3).3,5,33
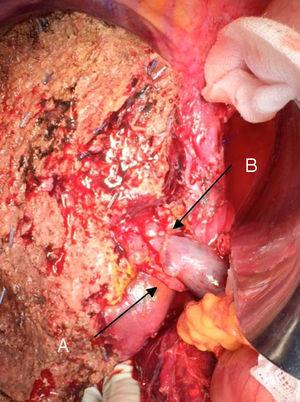
Hepatectomía izquierda por tumor de Klatskin, con resección de la vena porta: (A) arteria hepática derecha del mesenterio superior; (B) vena porta.
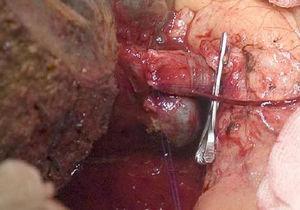
Hepatectomía derecha con reconstrucción de la vena porta.
También es importante destacar los recientes estudios que muestran un aumento de la supervivencia de los pacientes con afectación vascular preoperatoria tras la resección portal. Incluso alcanzan tasas de supervivencia iguales o superiores a las de los pacientes sin afectación vascular preoperatoria y que, por tanto, no fueron sometidos a resección portal.33,56,57 En estos estudios, la incidencia de complicaciones hepáticas y vasculares es similar a la del grupo sin resección portal, excepto en aquellos pacientes sometidos a resección arterial, ya que éstos presentan una mayor tasa de morbimortalidad que los demás. Por todas estas consideraciones, se recomienda la cirugía en aquellos pacientes con afectación portal unilateral o afectación de la confluencia en las pruebas preoperatorias, realizando una resección en bloque y reconstrucción vascular. No se recomienda la resección y reconstrucción arterial a menos que la arteria esté claramente afectada, ya que se asocia a peores resultados postoperatorios, por lo que en estos casos es preferible la hepatectomía derecha.
En resumen, los principios quirúrgicos a seguir serán: cirugía radical con resección biliar y caudales y linfadenectomía, con márgenes R0 y sin manipulación del tumor, aunque ello implique la resección y reconstrucción de la vena porta y la arteria hepática.
Conclusiones
Actualmente, el único tratamiento curativo consiste en la resección quirúrgica. La resección radical en bloque y la reconstrucción vascular es la técnica que ha conseguido la mayor tasa de supervivencia a largo plazo. Para reducir la morbimortalidad postoperatoria, es recomendable realizar un drenaje biliar para prevenir la insuficiencia hepática, con profilaxis antibiótica tras el drenaje y embolización portal cuando el volumen hepático remanente futuro sea inferior al 30%. La resección R0, la afectación ganglionar y las metástasis a distancia siguen siendo los factores pronósticos más importantes.
Conflicto de intereses
Esta revisión no ha sido presentada ni publicada parcial o totalmente en ninguna revista o congreso.