Los Flaviviradae son una gran familia de patógenos virales responsables de causar graves enfermedades y mortalidad en humanos y animales. La familia consta de tres géneros: Flavivirus, Pestivirus y Hepacivirus. El género Flavivirus, que es el mayor de los tres, contiene más de 70 virus, entre ellos el virus del dengue (VD), el virus de la encefalitis japonesa (VEJ), el virus del Nilo Occidental (VNO), el virus de la fiebre amarilla (VFA) y el virus del Zika (VZ). Los flavivirus presentan una uniformidad morfológica con una cápside icosaédrica y una envoltura cerrada en forma de pico. El tamaño de la cápside es de unos 30 nm y el virión completo mide 45 nm. El genoma de los flavivirus es un ARN monocatenario de unas 10 kb de tamaño. Codifica 3 proteínas estructurales: la cápside (proteína C), la membrana (M, que se expresa como prM, el precursor de M y la envoltura (proteína E) y 7 proteínas no estructurales: NS1, NS2A, NS2B, NS3, NS4A, NS4B y NS5 (Figura 1 a.b).
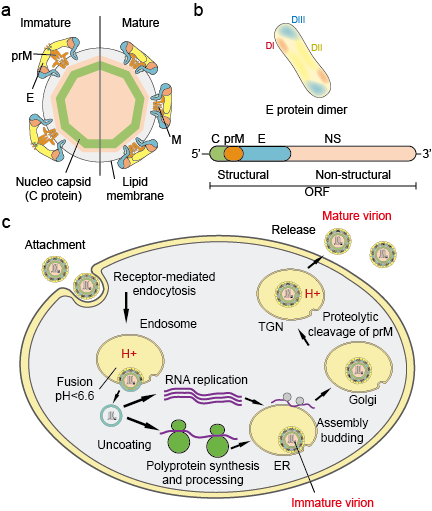
Figura 1. Partículas de flavivirus (a), proteínas (b) y ciclo vital (c).
Buscar todos los productos relacionados con los flavivirus
Ciclo vital de los flavivirus:
Los viriones se adhieren a la superficie de una célula huésped y posteriormente entran en la célula por endocitosis mediada por receptores (Figura 1c). Se han identificado varios receptores primarios y correceptores de baja afinidad para los flavivirus. La acidificación de la vesícula endosomal desencadena cambios de conformación en el virión, la fusión de las membranas viral y celular y el desmontaje de la partícula. Una vez que el genoma se libera en el citoplasma, el ARN de sentido positivo se traduce en una única poliproteína que es procesada co y postraduccionalmente por proteasas virales y del huésped. La replicación del genoma se produce en las membranas intracelulares. El ensamblaje del virus se produce en la superficie del retículo endoplásmico (RE) cuando las proteínas estructurales y el ARN recién sintetizado brotan en el lumen del RE. Las partículas virales y subvirales no infecciosas resultantes son transportadas a través de la red trans-Golgi (TGN). Las partículas virales inmaduras son escindidas por la proteasa del huésped, dando lugar a partículas maduras e infecciosas. Las partículas subvirales también son escindidas por la furina. Los viriones maduros y las partículas subvirales se liberan posteriormente por exocitosis.
Epidemiología de los flavivirus:
Los flavivirus transmitidos por mosquitos se transmiten en la naturaleza en uno o más ciclos distintos o superpuestos que incluyen un mosquito vector, generalmente los mosquitos Aedes para el YFV y el DENV y los mosquitos Culex para el JEV y el WNV, y un huésped mamífero o aviar. La transmisión entre los mosquitos y los huéspedes vertebrados se denomina transmisión horizontal y causa la enfermedad en los vertebrados. En contraste con la transmisión horizontal, los flavivirus transmitidos por mosquitos pueden mantenerse en el medio ambiente mediante transmisiones verticales, es decir, transgeneracionales, que permiten la propagación de los flavivirus únicamente en los mosquitos. La evidencia más directa que apoya la transmisión vertical de los flavivirus transmitidos por mosquitos se deriva del aislamiento del virus de larvas infectadas presumiblemente a través de la transmisión transovarial. Esta observación es coherente con la detección de antígenos virales en tejidos ováricos de mosquitos infectados. (Figura 2)
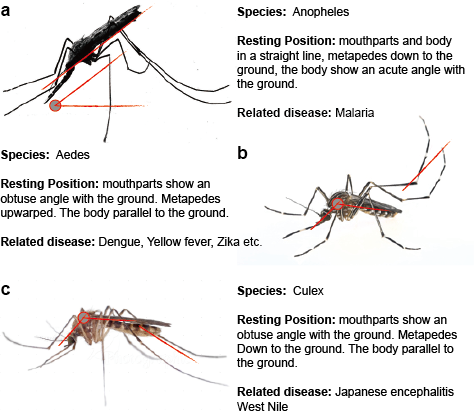
Figura 2. Tres mosquitos típicos que transmiten enfermedades.
Los flavivirus tienen una distribución mundial, y algunos miembros del género constituyen un importante problema de salud pública (por ejemplo, el virus de la fiebre amarilla , el virus del dengue , el virus del Nilo Occidental y el virus de la encefalitis japonesa ), con una elevada morbilidad y/o mortalidad. En la última década, los flavivirus han demostrado una mayor prevalencia, lo que supone un riesgo para más de 3.000 millones de personas en todo el mundo, lo que los convierte en un paradigma de las enfermedades emergentes.
En los últimos 50 años, muchos flavivirus, como los virus del dengue, del Nilo Occidental y de la fiebre amarilla, han mostrado un aumento drástico de la incidencia, la gravedad de la enfermedad y/o el alcance geográfico. Los patógenos virales derivados del medio ambiente presentan características epidemiológicas relativamente uniformes. Los mosquitos, las garrapatas y las moscas que pican son los vectores de la mayoría de las enfermedades víricas humanas. La enfermedad humana se produce cuando los vectores están activos, normalmente en primavera, verano y otoño en climas templados, y suele mostrar características epidemiológicas distintas que se corresponden con el hábitat del vector (Figura 3).
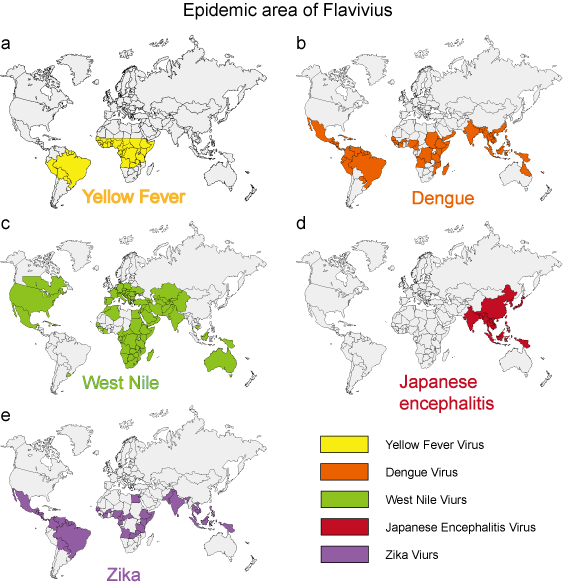
Figura 3. El área epidémica de 5 flavivirus típicos.
Manifestaciones:
Los flavivirus varían ampliamente en su potencial patógeno y en sus mecanismos para producir la enfermedad humana (Tabla 1). La infección humana con flavivirus transmitidos por mosquitos y garrapatas se inicia por la deposición del virus a través de la piel mediante la saliva de un artrópodo infectado. El virus se replica localmente y en los ganglios linfáticos regionales y da lugar a la viremia. Los principales síndromes y ejemplos de flavivirus causantes incluyen: encefalitis (encefalitis japonesa), enfermedad febril con sarpullido (virus del dengue), fiebre hemorrágica (virus de la enfermedad del bosque de Kyasanur y a veces virus del dengue) y fiebre hemorrágica con hepatitis (virus de la fiebre amarilla).
Tabla 1 Visión general de los flavivirus más importantes
| Especies virales | Vector transmisor | Propagación geográfica | Síndrome |
|---|---|---|---|
| Fiebre amarilla | Mosquito (Aedes) | Ver Figura 3a | Fiebre hemorrágica |
| Dengue | Mosquito (Aedes, Stegomyia) |
Ver Figura 3b | Síndrome del dengue, DHF, DSS |
| Fiebre del Nilo Occidental | Mosquito (Culex), garrapatas (Argasidae) |
Ver Figura 3c | Síndrome del dengue, encefalitis |
| Encefalitis japonesa | Mosquito (Culex) | Ver Figura 3d | Encefalitis |
| Zika | Mosquito (Aedes) | Ver Figura 3e | Microcefalia |
Diagnóstico:
El diagnóstico clínico de los diferentes flavivirus no es fiable debido a la inespecificidad de los síntomas, y el diagnóstico de laboratorio es obligatorio para confirmar la etiología de la enfermedad. En las infecciones por flavivirus, el virus puede encontrarse en suero o plasma, generalmente entre 2 y 7 días después del inicio de la enfermedad, y la duración de esta fase virémica y la carga viral detectada varían en función del virus infectante (Tabla 2). Por lo general, después de 5-7 días desde el inicio, surge una respuesta inmunitaria contra la infección, con anticuerpos IgM que alcanzan su punto máximo a los 15 días. Estos anticuerpos IgM pueden durar desde meses (como en el caso del DENV) hasta años (como en el caso de las infecciones por WNV). La aparición de IgG se produce a los 8-10 días del inicio y puede detectarse durante toda la vida. Las características particulares de cada flavivirus influyen notablemente en los algoritmos de diagnóstico que deben aplicarse en la identificación de las infecciones por flavivirus. En general, muchos laboratorios han elegido las pruebas serológicas para diagnosticar las infecciones causadas por flavivirus, debido a su precisión y a la disponibilidad de pruebas comerciales basadas en estándares de alta calidad. Sin embargo, la presencia de reacciones cruzadas serológicas entre los distintos virus y el tiempo necesario para detectar los anticuerpos en algunas infecciones, dificultan la utilidad de la serología como herramienta de diagnóstico de las infecciones agudas por flavivirus. El aislamiento viral constituye el método «de referencia» para lograr un diagnóstico confirmado de flavivirus.
Ver todos los productos del kit ELSIA y RDT para flavivirus
Tabla 2. Algoritmos de diagnóstico de flavivirus.
| Fase aguda | Fase de convalecencia | Muestra preferida† | Carga viral esperada | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, aislamiento del virus | IgM, IgG | Suero, plasma y tejido | Alto |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, aislamiento del virus | IgM, IgG | Suero, plasma, LCR y PBMC | Hasta 106 viriones/ml |
| VNP | RT-PCR, IgM, IgG | IgM, IgG | CSF y suero | Bajo |
| JEV | RT-PCR, IgM, IgG | IgM, IgG | CSF, suero, sangre y PBMCs | Bajo |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF y suero | Bajo |
| Gould E A, Solomon T. Flavivirus patógenos . The Lancet, 2008, 371(9611): 500-509. | |
| Gaunt M W, Sall A A, de Lamballerie X, et al. Phylogenetic relationships of flaviviruses correlate with their epidemiology, disease association and biogeography . Journal of General Virology, 2001, 82(8): 1867-1876. | |
| Kuno G, Chang G J J, Tsuchiya K R, et al. Phylogeny of the genus Flavivirus . Journal of virology, 1998, 72(1): 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle. Nature Reviews Microbiology, 2005, 3(1): 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Flavivirus-mosquito interacciones. Viruses, 2014, 6(11): 4703-4730. |