La sulfonación del metilbenceno
El metilbenceno es más reactivo que el benceno debido a la tendencia del grupo metilo a «empujar» electrones hacia el anillo.
El efecto de esta mayor reactividad es que el metilbenceno reaccionará con el ácido sulfúrico fumante a 0°C, y con el ácido sulfúrico concentrado si se calientan a reflujo durante unos 5 minutos.
Además del efecto sobre la velocidad de reacción, con el metilbenceno también hay que pensar en qué lugar del anillo termina el grupo ácido sulfónico en relación con el grupo metilo. Los grupos metilo tienden a «dirigir» nuevos grupos a las posiciones 2 y 4 del anillo (suponiendo que el grupo metilo esté en la posición 1). Se dice que los grupos metilos son 2,4-directivos.
Así que se obtiene una mezcla que consiste principalmente en dos isómeros. Sólo se forma un 5 – 10% del isómero 3. Las principales reacciones son:
![]()
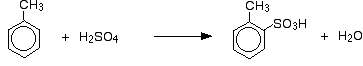
y:
![]()
En el caso de la sulfonación, la proporción exacta de los isómeros formados depende de la temperatura de la reacción. A medida que aumenta la temperatura, se obtienen proporciones crecientes del isómero 4 y menos del isómero 2. Esto se debe a que la sulfonación es reversible. El grupo de ácido sulfónico puede desprenderse del anillo de nuevo y volver a unirse a otro lugar. Esto tiende a favorecer la formación del isómero más estable termodinámicamente. Este intercambio ocurre más a temperaturas más altas.
El isómero 4 es más estable porque no hay desorden en la molécula como habría si el grupo metilo y el grupo ácido sulfónico estuvieran uno al lado del otro.