Hay muchas modalidades diferentes que pueden utilizarse para la imagen molecular no invasiva. Cada una de ellas tiene sus puntos fuertes y débiles, y algunas son más adecuadas para obtener imágenes de múltiples objetivos que otras.
Resonancia magnéticaEditar

La RMN tiene la ventaja de tener una resolución espacial muy alta y es muy adepta a la imagen morfológica y a la imagen funcional. Sin embargo, la RM tiene varias desventajas. En primer lugar, la RM tiene una sensibilidad de alrededor de 10-3 mol/L a 10-5 mol/L que, en comparación con otros tipos de imágenes, puede ser muy limitante. Este problema se debe a que la diferencia entre los átomos en estado de alta energía y los de baja energía es muy pequeña. Por ejemplo, a 1,5 Tesla, una intensidad de campo típica para la RMN clínica, la diferencia entre los estados de alta y baja energía es de aproximadamente 9 moléculas por cada 2 millones. Las mejoras para aumentar la sensibilidad de la RMN incluyen el aumento de la intensidad del campo magnético y la hiperpolarización mediante el bombeo óptico, la polarización nuclear dinámica o la polarización inducida por el parahidrógeno. También hay una variedad de esquemas de amplificación de la señal basados en el intercambio químico que aumentan la sensibilidad.
Para lograr la obtención de imágenes moleculares de biomarcadores de enfermedades utilizando la RM, se requieren agentes de contraste de RM dirigidos con alta especificidad y alta relaxividad (sensibilidad). Hasta la fecha, se han dedicado muchos estudios a desarrollar agentes de contraste de RM dirigidos para conseguir imágenes moleculares por RM. Por lo general, se han aplicado péptidos, anticuerpos o pequeños ligandos y pequeños dominios de proteínas, como los afibiodes de HER-2, para lograr la focalización. Para mejorar la sensibilidad de los agentes de contraste, estos elementos de focalización suelen estar vinculados a agentes de contraste de RM de alta carga útil o a agentes de contraste de RM con altas relajaciones. En particular, el reciente desarrollo de partículas de tamaño micrométrico de óxido de hierro (MPIO) permitió alcanzar niveles de sensibilidad sin precedentes para detectar las proteínas expresadas por las arterias y las venas.
Imágenes ópticasEditar
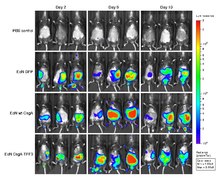
Hay una serie de enfoques utilizados para la imagen óptica. Los distintos métodos dependen de la fluorescencia, la bioluminiscencia, la absorción o la reflectancia como fuente de contraste.
El atributo más valioso de las imágenes ópticas es que, al igual que los ultrasonidos, no plantean grandes problemas de seguridad, como ocurre con las demás modalidades de imágenes médicas.
El inconveniente de las imágenes ópticas es la falta de profundidad de penetración, especialmente cuando se trabaja con longitudes de onda visibles. La profundidad de penetración está relacionada con la absorción y la dispersión de la luz, que es principalmente una función de la longitud de onda de la fuente de excitación. La luz es absorbida por los cromóforos endógenos que se encuentran en los tejidos vivos (por ejemplo, la hemoglobina, la melanina y los lípidos). En general, la absorción y la dispersión de la luz disminuyen al aumentar la longitud de onda. Por debajo de ~700 nm (por ejemplo, las longitudes de onda visibles), estos efectos dan lugar a profundidades de penetración de sólo unos milímetros. Por lo tanto, en la región visible del espectro, sólo es posible la evaluación superficial de las características del tejido. Por encima de los 900 nm, la absorción del agua puede interferir en la relación señal/fondo. Dado que el coeficiente de absorción del tejido es considerablemente menor en la región del infrarrojo cercano (NIR) (700-900 nm), la luz puede penetrar más profundamente, hasta profundidades de varios centímetros.
Imágenes en el infrarrojo cercanoEditar
Las sondas y etiquetas fluorescentes son una herramienta importante para la obtención de imágenes ópticas. Algunos investigadores han aplicado la imagen NIR en el modelo de rata de infarto agudo de miocardio (IAM), utilizando una sonda peptídica que puede unirse a las células apoptóticas y necróticas. Se han empleado varios fluoróforos del infrarrojo cercano (NIR) para la obtención de imágenes in vivo, como los colorantes y conjugados Kodak X-SIGHT, Pz 247, fluorescentes DyLight 750 y 800, fluorescentes Cy 5,5 y 7, fluorescentes Alexa Fluor 680 y 750, fluorescentes IRDye 680 y 800CW. Los puntos cuánticos, con su fotoestabilidad y sus emisiones brillantes, han suscitado un gran interés; sin embargo, su tamaño impide una eliminación eficaz de los sistemas circulatorio y renal, al tiempo que presentan una toxicidad a largo plazo.
Varios estudios han demostrado el uso de sondas marcadas con tintes infrarrojos en la obtención de imágenes ópticas.
- En una comparación de la gammagrafía y la obtención de imágenes NIR, se utilizó un ciclopentapéptido doblemente marcado con 111
In y un fluoróforo NIR para obtener imágenes de xenoinjertos de melanoma positivos para αvβ3-integrina. - El RGD marcado en el infrarrojo cercano dirigido a la αvβ3-integrina se ha utilizado en numerosos estudios para dirigirse a una variedad de cánceres.
- Se ha conjugado un fluoróforo NIR con el factor de crecimiento epidérmico (EGF) para obtener imágenes de la progresión del tumor.
- Se comparó un fluoróforo NIR con Cy5.5, lo que sugiere que los colorantes de mayor longitud de onda pueden producir agentes de focalización más eficaces para la obtención de imágenes ópticas.
- Se ha marcado el pamidronato con un fluoróforo NIR y se ha utilizado como agente de imagen ósea para detectar la actividad osteoblástica en un animal vivo.
- Un GPI marcado con un fluoróforo NIR, un potente inhibidor del PSMA (antígeno de membrana específico de la próstata).
- Uso de albúmina de suero humano marcada con un fluoróforo NIR como agente de seguimiento para el mapeo de los ganglios linfáticos centinela.
- 2-Deoxy-D-glucosa marcada con un fluoróforo NIR.
Es importante señalar que la adición de una sonda NIR a cualquier vector puede alterar la biocompatibilidad y la biodistribución del vector. Por lo tanto, no se puede asumir de forma inequívoca que el vector conjugado se comportará de forma similar a la forma nativa.
Tomografía computarizada por emisión de fotón únicoEditar
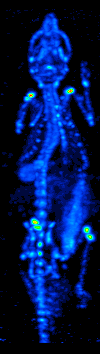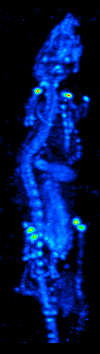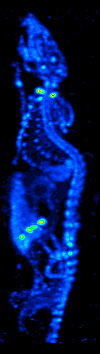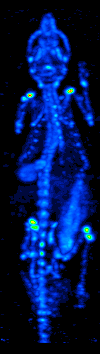
El desarrollo de la tomografía computarizada en la década de 1970 permitió el mapeo de la distribución de los radioisótopos en el órgano o tejido, y dio lugar a la técnica ahora llamada tomografía computarizada por emisión de fotón único (SPECT).
El agente de imagen utilizado en la SPECT emite rayos gamma, a diferencia de los emisores de positrones (como el 18
F) utilizados en la PET. Hay una serie de radiotrazadores (como 99m
Tc, 111
In, 123
I, 201
Tl) que pueden utilizarse, dependiendo de la aplicación específica.
El gas xenón (133
Xe) es uno de estos radiotrazadores. Se ha demostrado que es valioso para los estudios de diagnóstico por inhalación para la evaluación de la función pulmonar; para la obtención de imágenes de los pulmones; y también puede utilizarse para evaluar la FBCr. La detección de este gas se realiza a través de una gammacámara, que es un detector de centelleo compuesto por un colimador, un cristal de NaI y un conjunto de tubos fotomultiplicadores.
Al girar la gammacámara alrededor del paciente, se puede obtener una imagen tridimensional de la distribución del radiotrazador empleando la retroproyección filtrada u otras técnicas tomográficas.Los radioisótopos utilizados en la SPECT tienen vidas medias relativamente largas (de unas horas a unos días), lo que hace que sean fáciles de producir y relativamente baratos. Esto representa la mayor ventaja de la SPECT como técnica de imagen molecular, ya que es significativamente más barata que la PET o la fMRI. Sin embargo, carece de una buena resolución espacial (es decir, dónde se encuentra exactamente la partícula) o temporal (es decir, si la señal del agente de contraste se produjo en este milisegundo o en aquel milisegundo). Además, debido a la radiactividad del agente de contraste, existen aspectos de seguridad relativos a la administración de radioisótopos al sujeto, especialmente para los estudios seriados.
Tomografía por emisión de positronesEditar
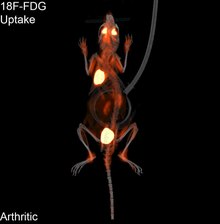
Play media
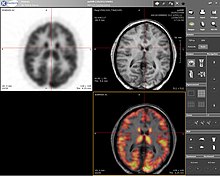
La tomografía por emisión de positrones (PET) es una técnica de imagen de medicina nuclear que produce una imagen o cuadro tridimensional de los procesos funcionales del cuerpo. La teoría en la que se basa la PET es bastante sencilla. Primero se marca una molécula con un isótopo emisor de positrones. Estos positrones se aniquilan con los electrones cercanos, emitiendo dos fotones de 511 keV, dirigidos a 180 grados en direcciones opuestas. Estos fotones son detectados por el escáner, que puede estimar la densidad de aniquilaciones de positrones en un área específica. Cuando se han producido suficientes interacciones y aniquilaciones, se puede medir la densidad de la molécula original en esa zona. Los isótopos típicos son el 11
C, el 13
N, el 15
O, el 18
F, el 64
Cu, el 62
Cu, el 124
I, el 76
Br, el 82
Rb, el 89
Zr y el 68
Ga, siendo el 18
F el más utilizado clínicamente. Uno de los principales inconvenientes de la PET es que la mayoría de las sondas deben fabricarse con un ciclotrón. Además, la mayoría de estas sondas tienen una vida media que se mide en horas, lo que obliga a tener el ciclotrón in situ. Estos factores pueden hacer que la PET sea prohibitivamente cara. Sin embargo, las imágenes de la PET tienen muchas ventajas. La primera y más importante es su sensibilidad: un escáner de PET típico puede detectar concentraciones de entre 10-11 mol/L y 10-12 mol/L.