Uno necesita conocer algunas propiedades básicas del compuesto dado y su estructura de Lewis para entender su geometría molecular, polaridad y otras propiedades similares. SF4 es la fórmula química del tetrafluoruro de azufre. Es un gas incoloro y corrosivo que se utiliza en la síntesis de varios compuestos organofluorados. El SF4 es un compuesto bastante peligroso, pero se utiliza ampliamente en las empresas químicas y farmacéuticas.
| Nombre de la molécula | Tetrafluoruro de azufre ( SF4) |
| Número de electrones de valencia en la molécula | 34 |
| Hibridación del SF4 | sp3 hibridación |
| Ángulos de enlace | 102 grados y 173 grados |
| Geometría molecular del SF4 | Bipiramidal trigonal |
Para entender las propiedades de esta molécula, como su reactividad, polaridad, y más, uno necesita conocer la estructura de Lewis del SF4 primero.
Contenido
Geometría molecular del SF4
Es fácil entender la geometría molecular de una molécula dada utilizando la fórmula molecular o el modelo VSEPR. Una fórmula molecular ayuda a conocer el número exacto y el tipo de átomos presentes en el compuesto dado. Aquí hay un átomo de azufre y cuatro de flúor en el compuesto, lo que lo hace similar a la fórmula molecular de AX4E.
Las moléculas que tienen una fórmula molecular de AX4E tienen una geometría molecular bipiramidal trigonal. Aquí dos átomos de flúor que forman enlaces con el átomo de azufre están en las posiciones ecuatoriales, y los otros dos están en las posiciones axiales. Como hay un par solitario en el átomo central, éste repele el par de electrones de enlace, lo que modifica un poco la forma y hace que parezca un balancín. Los electrones siguen este patrón de disposición siguiendo la regla VSEPR para minimizar las fuerzas de repulsión entre los pares de electrones solitarios para maximizar la estabilidad de la molécula.
Por lo tanto, el SF4 tiene una geometría molecular bipiramidal trigonal.
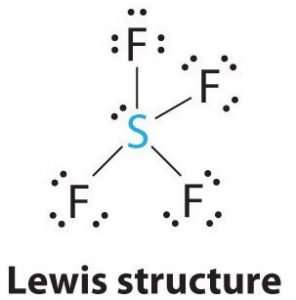
Estructura de Lewis del SF4
La estructura de Lewis es una representación pictórica de los enlaces y los electrones de valencia de la molécula. Los enlaces formados entre dos átomos se representan mediante líneas, mientras que los electrones de valencia que no forman ningún enlace se muestran mediante puntos. Los electrones de valencia que participan en la formación de enlaces se denominan pares de electrones enlazantes, mientras que los electrones que no participan ni forman ningún enlace se denominan pares de electrones no enlazantes o pares solitarios.
Y para dibujar la estructura de Lewis del SF4, primero necesitamos conocer el número total de electrones de valencia de esta molécula.
Como probablemente se puede ver, hay un átomo de azufre en este compuesto y cuatro átomos de flúor. Para conocer el total de electrones de valencia de este compuesto, necesitamos conocer los electrones de valencia de ambos átomos individualmente.
- Electrones de valencia del Azufre: 6
- Electrones de valencia del Flúor: 4* (7)
( como hay cuatro átomos de flúor, tenemos que considerar los electrones de valencia de todos los átomos)
Número total de electrones de valencia en el SF4 = número de electrones de valencia en el azufre + número de electrones de valencia en el flúor
= 6 + 28
= 34 electrones de valencia
Ahora que conocemos el número total de electrones de valencia, nos resultará fácil entender la formación de enlaces entre los átomos y la disposición completa de la molécula también.
El azufre será el átomo central de esta molécula por ser el menos electronegativo, con cuatro átomos de flúor formando enlaces a los lados de este átomo central. Cada átomo de flúor formará un enlace con el átomo central, lo que significa que habrá cuatro enlaces en la estructura de la molécula utilizando cuatro electrones de valencia de los átomos de flúor y 4 electrones del átomo de azufre. Así que ahora se utilizan ocho electrones de valencia, reduciendo el número de electrones de valencia de 34 a 24. Todos los átomos de flúor tienen seis electrones de valencia, y el átomo central tiene dos electrones de valencia.
Dibuja líneas entre S y F para mostrar los enlaces y para los pares solitarios de electrones, utiliza puntos. Cada átomo de flúor tendrá tres pares de 6 electrones de valencia (mostrados como puntos) en el átomo, junto con un enlace con el azufre. En cambio, el átomo central tendrá dos electrones de valencia y cuatro enlaces.
Por lo tanto, el átomo central, el azufre, tendrá un par de electrones solitario y cuatro pares de electrones de enlace en la estructura de Lewis del SF4. Al mismo tiempo, cada átomo de flúor tendrá tres pares solitarios.
¿Es el SF4 polar?
Una vez que conocemos la estructura de Lewis y la geometría molecular del compuesto dado, resulta más fácil representar la polaridad de la molécula. Aquí, un par solitario en el átomo central de azufre y cuatro pares de electrones de enlace conduce a la distribución asimétrica de electrones en el átomo central.
Además, como la forma de la molécula es como un balancín, dos átomos de flúor pueden anular el momento dipolar del otro, pero los otros dos no pueden debido a la disposición de los electrones. Y como los átomos de flúor son más electronegativos que los de azufre, se produce una distribución desigual de la carga. Por lo tanto, el momento dipolar no se cancela, lo que hace que la molécula sea polar. Así que sí, el SF4 es polar.
Hibridación del SF4
Para conocer la hibridación de la molécula de SF4, veamos primero las regiones de densidad electrónica del átomo central.
El azufre tiene cuatro pares de electrones de enlace y un par solitario, lo que hace que su número total de regiones de densidad electrónica sea 5. Por lo tanto, el átomo de azufre utiliza cinco orbitales hibridados, un orbital 3s, tres orbitales 3p y un orbital 3d. Esta disposición de los electrones alrededor del átomo y de los orbitales hibridados conduce a la hibridación sp3d. También se puede utilizar el número estérico para conocer la hibridación; aquí, el número estérico es 5 para el átomo de azufre.
Por lo tanto SF4 tiene hibridación sp3d.
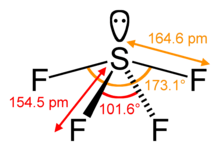
SF4 Ángulos de enlace y forma
El átomo de azufre central forma cuatro enlaces con los átomos de flúor vecinos y tiene un par solitario de electrones. Los átomos de flúor en las posiciones ecuatoriales tienen los ángulos de enlace de 102 grados, y los axiales tienen 173 grados, que son un poco diferentes de la geometría molecular bipiramidal trigonal que conduce a una forma de balancín.
El par solitario en el átomo central conduce al cambio en los ángulos de enlace de 120 grados a 102 grados para los átomos de flúor ecuatoriales y 173 grados en lugar de 180 grados para los átomos de flúor axiales.
Observaciones finales
Para concluir todas las propiedades podemos decir que,
- El tetrafluoruro de azufre tiene 34 electrones de valencia, de los cuales forma cuatro enlaces covalentes y un par solitario de electrones en el átomo central en su estructura de Lewis.
- Hay tres pares solitarios en cada átomo de flúor.
- Tiene una geometría molecular de la fórmula AX4E; forma un balancín y tiene una geometría molecular bipiramidal trigonal.
- SF4 tiene hibridación sp3d y es de naturaleza polar.