- Introducción
- Métodos
- Fibroblastos de ratón
- Diagnóstico y medicación de los pacientes
- Establecimiento del experimento
- Medición del período refractario efectivo
- Soluciones de stock y aplicación de fármacos
- Análisis de los parámetros del potencial de acción
- Análisis estadístico
- Resultados
- Efectos del MK-0448 sobre la corriente Kv1.5
- Efectos del MK-0448 sobre los potenciales de acción
- Discusión
- Limitaciones del estudio
- Conclusión
- Declaración de conflicto de intereses
- Agradecimientos
Introducción
En busca de fármacos antiarrítmicos más seguros para el tratamiento de la fibrilación auricular (FA), se han diseñado inhibidores selectivos de IKur como agentes antiarrítmicos de clase III selectivos con potencial terapéutico en la FA. Dado que se dirigen a los canales Kv1.5, que sólo son funcionales en las aurículas (Mays et al., 1995), se considera que estos agentes carecen de efectos proarrítmicos en los ventrículos y, por lo tanto, han recibido un gran interés en la comunidad científica (para una revisión, véase Ford y Milnes, 2008; Tamargo et al, 2009; Ravens, 2010; Ravens y Wettwer, 2011).
Hemos investigado previamente los efectos electrofisiológicos de varios inhibidores de IKur, incluyendo 4-aminopiridina, AVE0118, XEN-D0101, todos los cuales elevaron la fase de meseta de los potenciales de acción (PA) auriculares derechos humanos registrados en trabéculas del apéndice auricular obtenidas de pacientes en ritmo sinusal (RS) o FA (Wettwer et al., 2004; Christ et al., 2008; Ford et al., 2013). Curiosamente, la duración del potencial de acción (APD90) y el período refractario efectivo (ERP) se acortaron en la RS pero se prolongaron en las preparaciones de FA.
Recientemente, se publicaron resultados por primera vez en humanos con otro inhibidor selectivo de Kv1.5, MK-0448 (Pavri et al., 2012). El MK-0448 no afectó a la ERP auricular relativa en voluntarios sanos, y los autores concluyeron que no cabe esperar que el bloqueo de IKur ejerza efectos antiarrítmicos terapéuticamente útiles en la FA. Dado que no se sabe nada sobre los efectos del MK-0448 en el tejido auricular humano ex vivo, investigamos sus efectos sobre las formas de los PA auriculares y la PRE con técnicas estándar de microelectrodos en trabéculas aisladas de apéndices auriculares derechos de pacientes en RS y FA, que tuvieron que someterse a cirugía a corazón abierto. En las preparaciones de RS, el MK-0448 elevó el potencial de meseta y acortó la DPA y la PRE a 1 Hz, como se esperaba de los bloqueadores de IKur. También confirmamos que el MK-0448 bloquea eficazmente la corriente Kv1.5 en fibroblastos de ratón que expresan de forma estable el gen hKCNA5.
Métodos
Fibroblastos de ratón
Las células HK2BN9 que expresan canales Kv1.5 humanos fueron proporcionadas amablemente por el Dr. Tamkun (Snyders et al., 1993). Las células se cultivaron en medio de águila modificado de Dulbecco que contenía un 10% de suero de ternera fetal y un 1% de penicilina/estreptomicina en condiciones atmosféricas de 5% de CO2 a 37°C. Se añadieron 250 μg/ml de G418 al medio para la selección. La expresión de Kv1.5 se indujo tratando las células con 1 μM de dexametasona 24 h antes de un experimento. Las células se estudiaron con un montaje estándar de pinza de voltaje de célula completa de un solo electrodo, como se ha descrito anteriormente (Radicke et al., 2006). La solución del baño contenía (en mM) NaCl 150, KCl 5,4, MgCl2 2, CaCl2 2,0, HEPES 10, glucosa 10, pH 7,4, temperatura 25°C. La solución del electrodo contenía (en mM) KCl 40, aspartato de potasio 80, NaCl 8, CaCl2 2, MgATP 5, EGTA 5, GTP 0,1, HEPES 10, pH 7,4 ajustado con KOH. Las resistencias en serie estaban entre 5 y 10 MΩ y se compensaban hasta un 85%. La capacitancia celular se midió con pequeños pasos de pinza hiperpolarizadora de -40 mV a -42 mV, el valor medio fue de 20,8 ± 1,2 pA/pF (n = 33) y no difirió entre las células probadas a 0,5 y 3 Hz. La generación de pulsos de pinza de tensión, la recogida de datos y el análisis se realizaron con el software ISO2 (MFK, Niedernhausen, Alemania). Los datos no se corrigieron para el potencial de unión, que era de 11,7 mV, según se calculó con el software JPCalc (P.H. Barry, Sydney, Australia).
Diagnóstico y medicación de los pacientes
El tejido auricular se obtuvo de pacientes sometidos a cirugía cardíaca a causa de una enfermedad arterial o valvular coronaria. Todos los pacientes dieron su consentimiento informado por escrito. El estudio fue aprobado por el comité ético de la Facultad de Medicina de la Universidad Tecnológica de Dresde (nº EK790799). Los pacientes se enumeran en la tabla 1. El estudio incluyó 13 preparaciones expuestas a fármacos y 9 preparaciones de TMC de pacientes en ritmo sinusal (grupo SR), 9 preparaciones expuestas a fármacos y 9 preparaciones de TMC de pacientes con fibrilación auricular permanente (grupo AF, definido como fibrilación auricular permanente durante ≥6 meses en el momento de la recogida del tejido), y 3 preparaciones expuestas a fármacos de pacientes con FA intermitente (episodios de FA de terminación espontánea que duran desde unos segundos hasta varias horas). La medicación de los pacientes incluía normalmente inhibidores de la ECA, β-bloqueantes, nitratos, fármacos hipolipemiantes y diuréticos.
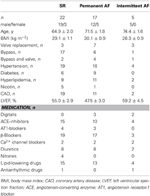
Tabla 1. Características de los pacientes cuyas trabéculas se utilizaron para la exposición a los fármacos.
Establecimiento del experimento
Pequeñas piezas (50-100 mg de peso) de apéndices auriculares derechos humanos se transportaron al laboratorio en una solución especial de transporte libre de Ca2+ a 20-25°C, composición en mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgSO4, 50 taurina, 5 MOPS, 30 monóxido de 2,3-butano-diona (BDM), pH 7,0. Se diseccionaron trabéculas libres (<1 mm de diámetro y 2-5 mm de longitud) o trabéculas junto con la pared auricular adherida y se montaron en el fondo de un baño de órganos de 5 ml perfundido con 50 ml de solución de Tyrode oxigenada en recirculación a un flujo de 7 ml/min a 36 ± 1°C (composición en mM: 126.7 NaCl, 0,42 NaH2PO4, 22 NaHCO3, 5,4 KCl, 1,8 CaCl2, 1,5 MgCl2, pH 7,4 en equilibrio con 5% de CO2 en O2). Las preparaciones se estimularon eléctricamente a un ritmo basal de 1 Hz con estímulos aislados de onda cuadrada de 1 ms de duración, 2 veces la intensidad del umbral. Los potenciales transmembrana se registraron con microelectrodos de vidrio llenos de 2,5 M de KCl. Las resistencias de punta de los electrodos estaban entre 20 y 80 MΩ. Tanto la sincronización de los estímulos de conducción como el preprocesamiento de las respuestas de potencial transmembrana se llevaron a cabo con un sistema de registro de potencial de acción asistido por ordenador (Wettwer et al., 2004). Se utilizó el programa de registro Chart for Windows, versión 7.3.5 (ADInstruments Pty Ltd., Castle Hill, Australia) para el análisis de los parámetros del potencial de acción.
Cada experimento fue precedido por un período de equilibrio de 60 minutos durante el cual se permitió que las preparaciones se estabilizaran y se lavó completamente el BDM residual. Los valores numéricos de los principales parámetros del potencial de acción debían permanecer constantes, es decir, dentro de un rango de ±5% durante al menos 10 min. Cuando el microelectrodo se movía fuera de la célula, se realizaba un nuevo empalamiento en el mismo lugar y se continuaba el experimento si el nuevo registro no difería del anterior por juicio visual y mostraba menos de un 3% de diferencia en el análisis numérico final.
Medición del período refractario efectivo
El período refractario efectivo (ERP) se midió mediante un único estímulo extra interpolado tras trenes de 10 pulsos de estimulación regular a la frecuencia basal de 1 Hz con intervalos decrecientes en pasos de 5 ms desde el último pulso regular hasta que el estímulo extra no conseguía provocar un potencial de acción. Tras un breve período de recuperación, la preparación se expuso a MK-0448 (3 μM) a 1 Hz durante otros 60 minutos y la ERP se probó una vez más en presencia del fármaco.
Soluciones de stock y aplicación de fármacos
MK-0448 fue sintetizado por Xention Ltd. Cambridge UK. En algunos experimentos, el MK-0448 se aplicó en concentraciones acumulativamente crecientes añadiendo directamente alícuotas de una solución madre de 10 mM con DMSO como disolvente a 50 ml del medio del baño circulante. La concentración de DMSO nunca superó el 0,2%, una concentración que no indujo ningún cambio significativo cuando se aplicó sola. Las preparaciones se expusieron a cada concentración de MK-0448 durante 20 minutos.
Análisis de los parámetros del potencial de acción
Se analizaron los siguientes parámetros estándar de los PA auriculares: potencial de membrana en reposo, RMP (mV), amplitud del potencial de acción, APA (mV), duración del potencial de acción al 20, 50 y 90% de la repolarización, APD20, APD50 y APD90 (ms), tasa máxima de despolarización, dV/dtmax (V/s) y el «potencial de meseta» definido como el potencial de membrana absoluto medio (mV) en la ventana de tiempo entre el 20 y el 30% de APD90 (PLT20). Se descartaron las preparaciones con potenciales de reposo menos negativos que -65 mV y amplitudes inferiores a 80 mV.
Análisis estadístico
Se utilizó GraphPad Prism (versión 4.03) para el análisis estadístico. En las curvas de concentración-respuesta (véase la Tabla 2), los valores obtenidos a concentraciones crecientes se compararon con los controles previos al fármaco mediante un ANOVA de una vía seguido de la prueba de comparación múltiple de Bonferroni. Los parámetros individuales del potencial de acción de las preparaciones de SR y AF permanente en presencia de 3 μM de MK-0448 se compararon con los controles previos al fármaco mediante la prueba t de Student emparejada (véase la Tabla 3). Las diferencias se consideran estadísticamente significativas para P < 0,05.

Tabla 2. Efectos dependientes de la concentración de MK-0448 a 1, 3 y 10μM (1 Hz).
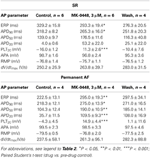
Tabla 3. Efectos del MK-0448 (3μM) sobre los parámetros del potencial de acción y el periodo refractario efectivo (ERP) de trabéculas auriculares derechas humanas de pacientes en RS y FA (frecuencia de estimulación 1 Hz).
Resultados
Efectos del MK-0448 sobre la corriente Kv1.5
Kv1.5, que se midió durante cambios de potencial de paso desde un potencial de mantenimiento de -60 mV a varios potenciales de prueba entre -40 y +80 mV tenía un potencial umbral de -30 mV, se activaba rápidamente y apenas se inactivaba en 500 ms (datos no mostrados). Para el ensayo de fármacos elegimos pasos de pinza de voltaje de 50 ms de duración a +50 mV que provocaron amplitudes de corriente medias de 85,0 ± 10,5 pA/pF a 0,5 Hz (n = 16) y 110,6 ± 16,9 pA/pF a 3 Hz n = 17, P = 0,2133). El MK-0448 (100 nM) bloqueó la amplitud de la corriente Kv1.5 de forma dependiente de la frecuencia (Figura 1A). A 0,5 Hz, el bloqueo alcanzó un estado estacionario a los 5-10 minutos de la aplicación del fármaco y se recuperó parcialmente durante un periodo de 5 minutos durante el cual la célula se sujetó continuamente a -60 mV (Figura 1B). Cuando las células fueron expuestas al MK-0448 durante un periodo de 5 min mantenido a -60 mV, para mantener los canales en estado cerrado, la IKv1.5 del primer pulso post-descanso no fue diferente de la del pre-descanso. Los pulsos subsiguientes en presencia del fármaco revelaron un rápido inicio de la inhibición, aumentando con cada pulso hasta alcanzar el estado estacionario (Figura 1C). El MK-0448 (100 nM) redujo la IKv1.5 de 82,3 ± 31,5 pA/pF a 22,4 ± 6,0 pA/pF (n = 5) en 3 minutos de pasos continuos de pinza de voltaje a 0,5 Hz, y de 113,8 ± 52,7 pA/pF a 12,9 ± 2,5 pA/pF a 3 Hz (n = 4). Estos resultados son consistentes con que la inhibición de MK-0448 de Kv1.5 es contingente a la activación del canal.

Figura 1. Efectos del MK-0448 sobre las corrientes Kv1.5 medidas en células HK2BN9 a 25°C. (A) Pinza de tensión y trazados de corriente obtenidos antes (negro) y después de la superfusión de las células con 100 nM de MK-0448 (verde) durante 10 min. La frecuencia de los pulsos de la pinza es la indicada. (B) Inicio del efecto de bloqueo del MK-0448 (100 nM) sobre el pico de corriente Kv1.5 y recuperación del bloqueo durante 5 minutos a un potencial de mantenimiento de -60 mV. Los trazos de corriente individuales en la parte superior se obtuvieron en los puntos de tiempo indicados por las letras pequeñas en el gráfico de la agenda en la parte inferior. (C) Inicio del efecto del fármaco tras la exposición durante 5 min de pinzamiento continuo a -60 mV. Frecuencia de paso: 3 Hz.
Efectos del MK-0448 sobre los potenciales de acción
Los potenciales de acción registrados en las trabéculas de la aurícula derecha de los pacientes en RS tenían la típica configuración de pico y cúpula (Figura 2), en el tejido de la FA permanente la forma era triangular y es el resultado de la remodelación eléctrica . El efecto más llamativo dependiente de la concentración del MK-0448 (1-10 μM) sobre los potenciales de acción del RS a la frecuencia de estimulación basal de 1 Hz fue una elevación robusta del potencial de meseta (PLT20) (Figura 2; Tabla 2). En este conjunto de experimentos, el APD90 tendió a acortarse (no significativo) mientras que el APD20 y el APD50 se prolongaron, alcanzando el nivel de significación estadística sólo en la concentración más alta (véase la Tabla 2). El potencial de membrana en reposo (PMR), la amplitud del potencial de acción (APA) y la velocidad máxima de despolarización (dV/dtmax) no se vieron afectados significativamente por el MK-0448 (ver Tabla 2). Antes y después del tratamiento con el fármaco, todas las preparaciones siguieron la estimulación, incluso a la concentración más alta.
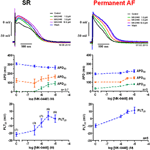
Figura 2. Efectos dependientes de la concentración del MK-0448 sobre los potenciales de acción registrados en las trabéculas de la aurícula derecha de pacientes en ritmo sinusal (RS) y en fibrilación auricular permanente (FA). Arriba: Trazados individuales de experimentos típicos, registrados en presencia de concentraciones crecientes del compuesto (véase el código de colores). Tiempo de exposición a cada concentración: 20 minutos; control: control previo al fármaco. Centro y fondo: Valores medios ± s.e.m. de 7 experimentos en SR y 5 en AF, de la duración del potencial de acción al 90, 50 y 20% de la repolarización (APD90, APD50 y APD20) y del potencial de meseta (PLT20). Frecuencia de estimulación: 1 Hz. Tenga en cuenta que no todas las preparaciones se expusieron a toda la gama de concentraciones (el número de preparaciones se indica entre paréntesis).
Los efectos del MK-0448 sobre la ERP se estudiaron sólo a 3 μM. Esta concentración produjo cambios máximos a los 40-50 min de la aplicación del fármaco, y éstos fueron parcialmente reversibles tras 60 min de lavado. En 6 preparaciones de pacientes en SR, APD90 y ERP se acortaron significativamente (Figura 3; Tabla 3). Se observaron efectos similares en 2 preparaciones de pacientes en FA intermitente (Figura 3).
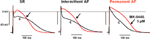
Figura 3. Efectos del MK-0448 (3 μM, trazo rojo, flecha) sobre los potenciales de acción registrados en trabéculas auriculares derechas de pacientes en ritmo sinusal (RS), fibrilación auricular intermitente (FAi) y fibrilación auricular crónica (FA). Se muestran las grabaciones originales de una preparación de cada grupo. c, control previo al fármaco (trazo negro). Frecuencia de estimulación 1 Hz.
En las trabéculas de FA permanente, el MK-0448 también elevó significativamente el potencial de meseta en un grado similar al de la RS, pero en contraste con la RS, prolongó la DPA en los tres niveles de repolarización analizados (Figuras 2, 3; Tabla 3). En las preparaciones de FA permanente, el APP, la RMP y el dV/dtmáx tampoco se vieron afectados de forma significativa, a excepción de la RMP con 10 μM de MK-0448.
Debido a la escasa disponibilidad sólo pudimos estudiar los efectos de MK-0448 en 2 trabéculas de pacientes en FA intermitente, un registro típico se muestra en la Figura 3; otras 3 se utilizaron como TMC. De forma similar a los resultados obtenidos en las preparaciones de RS, el MK-0448 acortó la DPA90 y la PRE en las 2 preparaciones de FA intermitente.
En los experimentos de control con tiempo igualado con tejido de pacientes en RS, FA intermitente y FA, los parámetros del potencial de acción no cambiaron significativamente (datos no mostrados).
Discusión
Los cambios característicos en los parámetros del potencial de acción observados con MK-0448 en las trabéculas de la aurícula derecha humana son coherentes con el bloqueo de los canales Kv1.5, tal y como se ha comunicado anteriormente para varios fármacos.
Se ha descrito que MK-0448 es altamente selectivo para los canales Kv1.5 expresados sobre una amplia variedad de canales iónicos cardíacos estándar. Los canales hERG son aproximadamente 10.000 veces, la corriente rectificadora interna Kir2.1 y Kir3.1/3.4 aproximadamente 1000 veces, y Kv7.1 (IKs) unas 10 a 100 veces menos sensible que Kv1.5 (Pavri et al., 2012). Los datos de las pinzas de voltaje en un sistema de expresión heteróloga confirman que el MK-0448 (100 nM) produjo un robusto bloqueo del Kv1.5 humano con un inicio de acción bastante lento y una recuperación parcial del bloqueo a -60 mV. Aunque nuestros resultados no permiten una caracterización precisa de la interacción fármaco-canal, indican claramente que los canales en reposo se recuperan del bloqueo y que la activación es necesaria para el desarrollo del bloqueo, lo que sugiere una unión preferente a los canales abiertos y/o inactivados.
En experimentos anteriores, demostramos que concentraciones bajas de 4-aminopiridina inhiben selectivamente el Iso (IKur) en miocitos auriculares humanos (Wettwer et al., 2004). Este bloqueador elevó el potencial de meseta en preparaciones de RS (EC50~15 μM). Además, el 4-AP a concentraciones que se consideran selectivas para el bloqueo de IKur acortó significativamente la DPA90 en el RS pero prolongó la DPA90 en las trabéculas de FA permanente (Wettwer et al., 2004). Los efectos más destacados del MK-0448 sobre los PA auriculares humanos, es decir la elevación del potencial de meseta, el acortamiento de la DPA90 en el RS y la prolongación de la DPA20, la DPA50 y la DPA90 en la FA permanente, están en consonancia con nuestros hallazgos anteriores con otros inhibidores de IKur, por lo que confiamos en concluir que MK-0448 bloquea efectivamente IKur en las trabéculas auriculares humanas.
A diferencia de la inhibición de los canales hERG, la inhibición de IKs no se asoció con un efecto ventricular proarrítmico en modelos animales (Lynch et al., 1999). Sin embargo, la modulación de IKs por MK-0448 también podría reducir la reserva de repolarización en el ventrículo y llegar a ser arritmogénica en los ventrículos bajo condiciones apropiadas (Lynch et al., 1999). Es importante señalar que es difícil evaluar el riesgo proarrítmico ventricular de un fármaco que modula las IKs en voluntarios sanos con una reserva de repolarización ventricular normal. Por lo tanto, la selectividad auricular del MK-0448 tendría que evaluarse cuidadosamente en los pacientes.
Se propone que el acortamiento de la DPA90 y de la PRE por los bloqueadores de Kv1.5 en el RS está causado por la marcada elevación del potencial de meseta en un rango de voltaje en el que se activan más canales hERG y, aunque se inactivan rápidamente, pueden recuperarse de la inactivación a potenciales más negativos y, por lo tanto, acelerar la repolarización final (Gintant, 2000).
Además de las distintas alteraciones en las formas de los potenciales de acción, se ha reconocido que la pérdida de la adaptación de la frecuencia de la PRE y la DPA90 a la frecuencia es un sello distintivo de la remodelación auricular tanto en pacientes (p. ej, Attuel et al., 1982; Daoud et al., 1996) y en estudios ex vivo (Franz et al., 1997; Dobrev y Ravens, 2003). En nuestro presente estudio y en el reciente estudio «por primera vez en humanos» con MK-0448 todas las pruebas electrofisiológicas se realizaron en un rango de frecuencias muy por debajo del de la FA y se podría argumentar que, basándose en nuestros datos de RS, no es sorprendente que MK-0448 no prolongara el PREA en voluntarios sanos (Pavri et al, 2012).
La evidencia experimental y clínica sugiere que la fibrilación auricular se debe a la micro-reentrada desencadenada por focos ectópicos localizados en la proximidad de las venas pulmonares (Haissaguerre et al., 1998). Las intervenciones farmacológicas para interrumpir la microrreentrada tienen que prolongar el periodo refractario efectivo, mientras que la supresión de los focos ectópicos requiere la reducción de la excitabilidad. Siempre que el MK-0448 bloquee selectivamente la IKur, es más probable que aumente la refractariedad auricular (en la FA) que que reduzca la excitabilidad, aunque no está claro cómo se relaciona la marcada elevación de la amplitud de la meseta con la prolongación de la ERP en la FA. Sin embargo, hay que destacar que la forma general del potencial de acción cardíaco está determinada por múltiples conductancias iónicas, por lo que la interpretación de los datos del potencial de acción no puede ser concluyente con respecto a qué canales iónicos contribuyen a un cambio concreto.
En la RS, incluso observamos un acortamiento de la PRE con MK-0448 y no podemos juzgar si se trata de un efecto anti o proarrítmico en las aurículas. De hecho, esto sólo puede responderse en un ensayo prospectivo de fase 2 en pacientes con FA. Sin embargo, vale la pena señalar que no se informó de ninguna proarritmia para el MK-0448 (Pavri et al., 2012) ni del acortamiento del AERP en voluntarios sanos. Otros inhibidores de Kv1.5, por ejemplo, XEN-D0101, que han sido evaluados en la clínica, tampoco han informado de proarritmia (auricular o ventricular) en voluntarios sanos (Ford et al., 2013). Los estudios genéticos revelaron una asociación de mutaciones de «pérdida de función» en el gen KCNA5 que codifica para Kv1.5 con la FA familiar «solitaria» (Olson et al., 2006). Sin embargo, en este estudio hubo un genotipado/fenotipado incompleto de los miembros de la familia y no hubo pruebas de vinculación primaria. De hecho, la probabilidad de observar estos datos sólo por casualidad es de entre el 10 y el 15%. Un estudio reciente de más de 300 pacientes con FA solitaria de inicio temprano reveló 3 mutaciones de «ganancia de función» en KCNA5 además de varias mutaciones de pérdida de función, lo que apoya la hipótesis de que la susceptibilidad a la FA puede aumentar por cualquiera de los cambios en la función de KCNA5 (Christophersen et al, 2013).
Limitaciones del estudio
En algunas preparaciones auriculares humanas, la DPA no permanece estable durante la superfusión prolongada con soluciones salinas (normalmente, ~2 h).-La clasificación de los pacientes en RS y FA puede no ser siempre fiable, es decir, La clasificación de los pacientes en RS y FA puede no ser siempre fiable, es decir, el grupo de RS puede incluir tejido auricular de pacientes que han tenido episodios no reconocidos de FA paroxística o de inicio reciente.
Conclusión
En resumen, el bloqueador de IKur MK-0448 eleva sistemáticamente la meseta del potencial de acción en trabéculas auriculares humanas, independientemente de las formas iniciales de los potenciales de acción de control y de si las preparaciones se obtuvieron de pacientes en RS o en FA permanente. En las preparaciones de RS, el MK-0448 produjo un acortamiento de la DPA90 y la PRE, pero en el tejido de la FA permanente se observaron efectos prominentes de prolongación de la DPA90 y la PRE con el fármaco. Para la prevención de la recurrencia de la FA persistente, la prolongación de la PRE por el MK-0448 en las preparaciones de FA es ciertamente un modo de acción muy deseable que puede proteger el miocardio auricular durante la fase de remodelación inversa después de la cardioversión, aunque si se debe a la modulación de las IKs, esto puede conllevar el riesgo de inducir una proarritmia ventricular. Queda por determinar si los fármacos selectivos de IKur (i) son más eficaces para prolongar la ERP a ritmos auriculares más altos, (ii) convierten farmacológicamente la FA de inicio reciente, (iii) reducen la carga de FA en la FA paroxística y (iv) previenen la recurrencia de la FA persistente.
Declaración de conflicto de intereses
James Milnes y John Ford son empleados de Xention Ltd., John Ford es cofundador y posee acciones de Xention Ltd., Ursula Ravens ha actuado como consultora de Xention. Simone Loose, Judith Mueller, Michael Knaut, Erich Wettwer no tienen nada que revelar.
Agradecimientos
Los autores agradecen el apoyo financiero de la Unión Europea (FP7-Health T2-2010-261057 «EUTRAF») y de Xention Limited. Deseamos dar las gracias a todos los pacientes y a los cirujanos cardíacos Klaus Matschke y Michael Knaut por su inestimable apoyo, y a Konstanze Fischer por su experta asistencia técnica.
Amos, G. J., Wettwer, E., Metzger, F., Li, Q., Himmel, H. M., y Ravens, U. (1996). Differences between outward currents of human atrial and subepicardial ventricular myocytes. J. Physiol. 491(Pt 1), 31-50.
Pubmed Abstract | Pubmed Full Text
Attuel, P., Childers, R., Cauchemez, B., Poveda, J., Mugica, J., y Coumel, P. (1982). Fallo en la adaptación de la frecuencia del período refractario auricular: su relación con la vulnerabilidad. Int. J. Cardiol. 2, 179-197. doi: 10.1016/0167-5273(82)90032-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christ, T., Wettwer, E., Voigt, N., Hala, O., Radicke, S., Matschke, K., et al. (2008). Pathology-specific effects of the I(Kur)/I(to)/I(K,ACh) blocker AVE0118 on ion channels in human chronic atrial fibrillation. Br. J. Pharmacol. 154, 1619-1630. doi: 10.1038/bjp.2008.209
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christophersen, I. E., Olesen, M. S., Liang, B., Andersen, M. N., Larsen, A. P., Nielsen, J. B., et al. (2013). Genetic variation in KCNA5: impact on the atrial-specific potassium current IKur in patients with lone atrial fibrillation. Eur. Heart J. 34, 1517-1525. doi: 10.1093/eurheartj/ehs442
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Daoud, E. G., Bogun, F., Goyal, R., Harvey, M., Man, K. C., Strickberger, S. A., et al. (1996). Effect of atrial fibrillation on atrial refractoriness in humans. Circulation 94, 1600-1606. doi: 10.1161/01.CIR.94.7.1600
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dobrev, D., and Ravens, U. (2003). Remodelación de los canales iónicos de los cardiomiocitos en la fibrilación auricular humana. Basic Res. Cardiol. 98, 137-148. doi: 10.1007/s00395-003-0409-8
Abstracto de Pubmed | Texto completo de Pubmed | Texto completo de CrossRef
Ford, J., Milnes, J., Wettwer, E., Christ, T., Rogers, M., Sutton, K., et al. (2013). Human electrophysiological and pharmacological properties of XEN-D0101: a novel atrial selective Kv1.5/IKur inhibitor. J. Cardiovasc. Pharmacol. 61, 408-415. doi: 10.1097/FJC.0b013e31828780eb
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J. W., and Milnes, J. T. (2008). New drugs targeting the cardiac ultra-rapid delayed-rectifier current (I Kur): rationale, pharmacology and evidence for potential therapeutic value. J. Cardiovasc. Pharmacol. 52, 105-120. doi: 10.1097/FJC.0b013e3181719b0c
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franz, M. R., Karasik, P. L., Li, C., Moubarak, J., and Chavez, M. (1997). Electrical remodeling of the human atrium: similar effects in patients with chronic atrial fibrillation and atrial flutter. J. Am. Coll. Cardiol. 30, 1785-1792. doi: 10.1016/S0735-1097(97)00385-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gintant, G. A. (2000). Caracterización y consecuencias funcionales de la corriente rectificadora retardada transitoria en la repolarización ventricular. Am. J. Physiol. Heart Circ. Physiol. 278, H806-H817.
Pubmed Abstract | Pubmed Full Text
Haissaguerre, M., Jais, P., Shah, D. C., Takahashi, A., Hocini, M., Quiniou, G., et al. (1998). Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N. Engl. J. Med. 339, 659-666. doi: 10.1056/NEJM199809033391003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lynch, J. J. Jr., Houle, M. S., Stump, G. L., Wallace, A. A., Gilberto, D. B., Jahansouz, H., et al. (1999). Antiarrhythmic efficacy of selective blockade of the cardiac slowly activating delayed rectifier current, I(Ks), in canine models of malignant ischemic ventricular arrhythmia. Circulation 100, 1917-1922. doi: 10.1161/01.CIR.100.18.1917
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mays, D. J., Foose, J. M., Philipson, L. H., and Tamkun, M. M. (1995). Localización de la proteína del canal Kv1.5 K+ en tejido cardíaco explantado. J. Clin. Invest. 96, 282-292. doi: 10.1172/JCI118032
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Olson, T. M., Alekseev, A. E., Liu, X. K., Park, S., Zingman, L. V., Bienengraeber, M., et al. (2006). Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Hum. Mol. Genet. 15, 2185-2191. doi: 10.1093/hmg/ddl143
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pavri, B. B., Greenberg, H. E., Kraft, W. K., Lazarus, N., Lynch, J. J., Salata, J. J., et al. (2012). MK-0448, a specific Kv1.5 inhibitor: safety, pharmacokinetics and pharmacodynamic electrophysiology in experimental animal models and in humans. Circ. Arrhythm. Electrophysiol. 5, 1193-1201. doi: 10.1161/CIRCEP.111.969782
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Radicke, S., Cotella, D., Graf, E. M., Banse, U., Jost, N., Varro, A., et al. (2006). Functional modulation of the transient outward current Ito by KCNE beta-subunits and regional distribution in human non-failing and failing hearts. Cardiovasc. Res, 71, 695-703. doi: 10.1016/j.cardiores.2006.06.017
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U. (2010). Terapia antiarrítmica en la fibrilación auricular. Pharmacol. Ther. 128, 129-145. doi: 10.1016/j.pharmthera.2010.06.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U., and Wettwer, E. (2011). Canales rectificadores retardados ultrarrápidos: bases moleculares e implicaciones terapéuticas. Cardiovasc. Res. 89, 776-785. doi: 10.1093/cvr/cvq398
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Regan, C. P., Wallace, A. A., Cresswell, H. K., Atkins, C. L., y Lynch, J. J. Jr. (2006). In vivo cardiac electrophysiologic effects of a novel diphenylphosphine oxide IKur blocker, (2-Isopropyl-5-methylcyclohexyl) diphenylphosphine oxide, in rat and nonhuman primate. J. Pharmacol. Exp. Ther. 316, 727-732. doi: 10.1124/jpet.105.094839
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Snyders, D. J., Tamkun, M. M., y Bennett, P. B. (1993). Un canal de potasio de activación rápida e inactivación lenta clonado a partir del corazón humano. Functional analysis after stable mammalian cell culture expression. J. Gen. Physiol. 101, 513-543. doi: 10.1085/jgp.101.4.513
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tamargo, J., Caballero, R., Gomez, R., and Delpon, E. (2009). Bloqueadores de los canales I(Kur)/Kv1.5 para el tratamiento de la fibrilación auricular. Expert Opin. Investig. Drugs 18, 399-416. doi: 10.1517/13543780902762850
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, Z., Fermini, B., and Nattel, S. (1993). Sustained depolarization-induced outward current in human atrial myocytes. Evidencia de una nueva corriente K+ rectificadora retardada similar a las corrientes del canal clonado Kv1.5. Circ. Res. 73, 1061-1076. doi: 10.1161/01.RES.73.6.1061
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wettwer, E., Hala, O., Christ, T., Heubach, J. F., Dobrev, D., Knaut, M., et al. (2004). Role of IKur in controlling action potential shape and contractility in the human atrium: influence of chronic atrial fibrillation. Circulation 110, 2299-2306. doi: 10.1161/01.CIR.0000145155.60288.71
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text