Los átomos y el oro
En 1911, Rutherford y sus colaboradores Hans Geiger y Ernest Marsden iniciaron una serie de experimentos innovadores que cambiarían por completo el modelo aceptado del átomo. Bombardearon láminas de oro muy finas con partículas alfa de movimiento rápido.

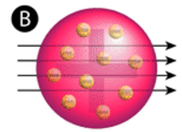

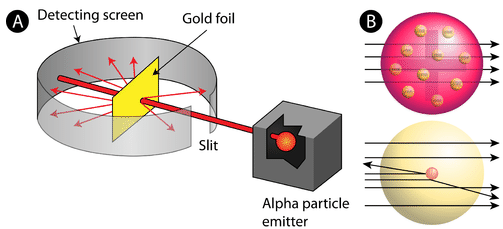
Figura \(\PageIndex{2}\) (A) El montaje experimental para el experimento de la lámina de oro de Rutherford: Un elemento radiactivo que emitía partículas alfa se dirigía hacia una fina lámina de oro que estaba rodeada por una pantalla que permitía detectar las partículas desviadas. (B) Según el modelo del pudín de ciruela (arriba), todas las partículas alfa deberían haber atravesado la lámina de oro con poca o ninguna desviación. Rutherford descubrió que un pequeño porcentaje de las partículas alfa se desviaban en grandes ángulos, lo que podría explicarse por un átomo con un núcleo muy pequeño, denso y con carga positiva en su centro (abajo).
De acuerdo con el modelo atómico aceptado, en el que la masa y la carga de un átomo se distribuyen uniformemente por todo el átomo, los científicos esperaban que todas las partículas alfa pasaran a través de la lámina de oro con una ligera desviación o sin ninguna. Sorprendentemente, como se muestra en la figura (\PageIndex{2}), aunque la mayoría de las partículas alfa no se desviaron, un porcentaje muy pequeño (aproximadamente 1 de cada 8.000 partículas) rebotó en la lámina de oro con ángulos muy grandes. Algunas incluso fueron redirigidas hacia la fuente. Ningún conocimiento previo les había preparado para este descubrimiento. En una famosa cita, Rutherford exclamó que era «como si hubieras disparado un proyectil de 15 pulgadas a un trozo de tejido y éste volviera y te golpeara»
Rutherford tuvo que idear un modelo completamente nuevo del átomo para poder explicar sus resultados. Como la gran mayoría de las partículas alfa habían atravesado el oro, razonó que la mayor parte del átomo era espacio vacío. Por el contrario, las partículas que fueron altamente desviadas debieron experimentar una fuerza tremendamente poderosa dentro del átomo. Llegó a la conclusión de que toda la carga positiva y la mayor parte de la masa del átomo debían estar concentradas en un espacio muy pequeño del interior del átomo, al que llamó núcleo. El núcleo es el diminuto y denso núcleo central del átomo y está compuesto por protones y neutrones.
El modelo atómico de Rutherford se conoció como modelo nuclear. En el átomo nuclear, los protones y los neutrones, que comprenden casi toda la masa del átomo, se encuentran en el núcleo, en el centro del átomo. Los electrones se distribuyen alrededor del núcleo y ocupan la mayor parte del volumen del átomo. Merece la pena destacar lo pequeño que es el núcleo en comparación con el resto del átomo. Si pudiéramos inflar un átomo para que tuviera el tamaño de un gran estadio de fútbol profesional, el núcleo tendría el tamaño de una canica.
El modelo de Rutherford resultó ser un paso importante hacia la comprensión completa del átomo. Sin embargo, no abordaba completamente la naturaleza de los electrones y la forma en que ocupaban el vasto espacio que rodea al núcleo. Por este y otros conocimientos, Rutherford recibió el Premio Nobel de Química en 1908. Lamentablemente, Rutherford habría preferido recibir el Premio Nobel de Física porque consideraba que la física era superior a la química. En su opinión, «toda la ciencia es física o coleccionismo de sellos»
.