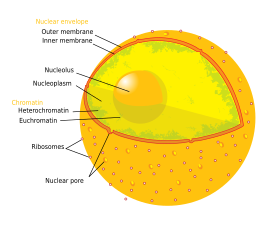
Der Zellkern enthält fast die gesamte DNA der Zelle, umgeben von einem Netzwerk faseriger Zwischenfilamente und umhüllt von einer Doppelmembran, die „Kernhülle“ genannt wird. Die Kernhülle trennt die Flüssigkeit im Inneren des Zellkerns, das so genannte Nukleoplasma, vom Rest der Zelle. Die Größe des Zellkerns hängt von der Größe der Zelle ab, in der er sich befindet, wobei ein Zellkern in der Regel etwa 8 % des gesamten Zellvolumens einnimmt. Der Zellkern ist das größte Organell in tierischen Zellen:12 In Säugetierzellen beträgt der durchschnittliche Durchmesser des Zellkerns etwa 6 Mikrometer (µm).
Kernhülle und Kernporen

Die Kernhülle besteht aus zwei Membranen, einer inneren und einer äußeren Kernmembran:649 Zusammen dienen diese Membranen dazu, das genetische Material der Zelle vom Rest des Zellinhalts zu trennen, und ermöglichen es dem Kern, eine vom Rest der Zelle getrennte Umgebung zu bewahren. Obwohl die beiden Membranen einen Großteil des Zellkerns eng umschließen, unterscheiden sie sich erheblich in Form und Inhalt. Die innere Membran umgibt den Kerninhalt und bildet seinen definierenden Rand.:14 Eingebettet in die innere Membran binden verschiedene Proteine die Intermediärfilamente, die dem Kern seine Struktur verleihen.:649 Die äußere Membran umschließt die innere Membran und ist mit der angrenzenden Membran des endoplasmatischen Retikulums verbunden.:649 Als Teil der Membran des endoplasmatischen Retikulums ist die äußere Kernmembran mit Ribosomen besetzt, die aktiv Proteine über die Membran hinweg übersetzen.:649 Der Raum zwischen den beiden Membranen, der so genannte „perinukleäre Raum“, ist mit dem Lumen des endoplasmatischen Retikulums verbunden.:649
Die Kernporen, die wässrige Kanäle durch die Hülle bilden, bestehen aus mehreren Proteinen, die zusammen als Nukleoporine bezeichnet werden. Die Poren haben ein Molekulargewicht von etwa 60-80 Millionen Dalton und bestehen aus etwa 50 (in Hefe) bis zu mehreren hundert Proteinen (in Wirbeltieren).:622-4 Die Poren haben einen Gesamtdurchmesser von 100 nm; der Spalt, durch den Moleküle frei diffundieren können, ist jedoch nur etwa 9 nm breit, was auf das Vorhandensein von Regulierungssystemen im Zentrum der Pore zurückzuführen ist. Diese Größe ermöglicht selektiv den Durchgang kleiner wasserlöslicher Moleküle, während größere Moleküle wie Nukleinsäuren und größere Proteine daran gehindert werden, in unangemessener Weise in den Kern ein- oder auszutreten. Diese großen Moleküle müssen stattdessen aktiv in den Zellkern transportiert werden. Der Kern einer typischen Säugetierzelle hat etwa 3000 bis 4000 Poren in seiner gesamten Hülle, von denen jede eine achtfach symmetrische ringförmige Struktur an der Stelle enthält, an der die innere und die äußere Membran verschmelzen. An diesem Ring ist eine Struktur befestigt, die als Kernkorb bezeichnet wird und in das Nukleoplasma hineinreicht, sowie eine Reihe von fadenförmigen Fortsätzen, die in das Zytoplasma hineinreichen. Beide Strukturen dienen dazu, die Bindung an nukleäre Transportproteine zu vermitteln.:509-10
Die meisten Proteine, ribosomalen Untereinheiten und einige RNAs werden durch die Porenkomplexe in einem Prozess transportiert, der durch eine Familie von Transportfaktoren vermittelt wird, die als Karyopherine bekannt sind. Die Karyopherine, die die Bewegung in den Zellkern vermitteln, werden auch als Importine bezeichnet, während die Karyopherine, die die Bewegung aus dem Zellkern heraus vermitteln, Exportine genannt werden. Die meisten Karyopherine interagieren direkt mit ihrer Ladung, obwohl einige Adaptorproteine verwenden. Steroidhormone wie Cortisol und Aldosteron sowie andere kleine lipidlösliche Moleküle, die an der interzellulären Signalübertragung beteiligt sind, können durch die Zellmembran in das Zytoplasma diffundieren, wo sie Kernrezeptorproteine binden, die in den Zellkern transportiert werden. Dort dienen sie als Transkriptionsfaktoren, wenn sie an ihren Liganden gebunden sind; in Abwesenheit eines Liganden fungieren viele dieser Rezeptoren als Histon-Deacetylasen, die die Genexpression unterdrücken.:488
Kernlamina
In tierischen Zellen sorgen zwei Netzwerke von Intermediärfilamenten für die mechanische Unterstützung des Zellkerns: Die Kernlamina bildet ein organisiertes Geflecht auf der Innenseite der Hülle, während auf der zytosolischen Seite der Hülle eine weniger organisierte Unterstützung vorhanden ist. Beide Systeme bieten strukturelle Unterstützung für die Kernhülle und Verankerungsstellen für Chromosomen und Kernporen.
Die Kernlamina besteht hauptsächlich aus Lamin-Proteinen. Wie alle Proteine werden auch die Lamine im Zytoplasma synthetisiert und später in das Innere des Zellkerns transportiert, wo sie zusammengebaut werden, bevor sie in das bestehende Netzwerk der Kernlamina eingebaut werden. Lamine, die sich auf der zytosolischen Seite der Membran befinden, wie z. B. Emerin und Nesprin, binden an das Zytoskelett und sorgen so für strukturelle Unterstützung. Lamine finden sich auch im Inneren des Nukleoplasmas, wo sie eine weitere regelmäßige Struktur bilden, den so genannten Nukleoplasmaschleier, der mit Hilfe der Fluoreszenzmikroskopie sichtbar wird. Die eigentliche Funktion des Schleiers ist nicht klar, obwohl er vom Nukleolus ausgeschlossen ist und während der Interphase vorhanden ist. Laminstrukturen, die den Schleier bilden, wie z. B. LEM3, binden Chromatin, und eine Störung ihrer Struktur hemmt die Transkription von proteinkodierenden Genen.
Wie die Komponenten anderer Intermediärfilamente enthält das Laminmonomer eine alpha-helicale Domäne, die von zwei Monomeren dazu verwendet wird, sich umeinander zu wickeln und eine Dimerstruktur zu bilden, die als Coiled Coil bezeichnet wird. Zwei dieser Dimere schließen sich dann antiparallel nebeneinander an, um ein Tetramer zu bilden, das als Protofilament bezeichnet wird. Acht dieser Protofilamente bilden eine seitliche Anordnung, die zu einem seilartigen Filament verdreht ist. Diese Filamente können dynamisch auf- und abgebaut werden, d. h. die Längenänderung des Filaments hängt von den konkurrierenden Raten der Filamentzugabe und -entfernung ab.
Mutationen in Lamin-Genen, die zu Defekten im Filamentaufbau führen, verursachen eine Gruppe seltener genetischer Störungen, die als Laminopathien bekannt sind. Die bekannteste Laminopathie ist die als Progerie bekannte Krankheitsfamilie, die bei den Betroffenen vorzeitige Alterungserscheinungen hervorruft. Der genaue Mechanismus, durch den die damit verbundenen biochemischen Veränderungen zu dem gealterten Phänotyp führen, ist nicht gut verstanden.
Chromosomen

Der Zellkern enthält den größten Teil des genetischen Materials der Zelle in Form mehrerer linearer DNA-Moleküle, die in Strukturen organisiert sind, die Chromosomen genannt werden. Jede menschliche Zelle enthält etwa zwei Meter DNA:405 Während des größten Teils des Zellzyklus sind diese in einem DNA-Protein-Komplex organisiert, der als Chromatin bezeichnet wird, und während der Zellteilung bildet das Chromatin die wohldefinierten Chromosomen, die man von einem Karyotyp kennt. Ein kleiner Teil der Gene der Zelle befindet sich stattdessen in den Mitochondrien.:438
Es gibt zwei Arten von Chromatin. Euchromatin ist die weniger kompakte DNA-Form und enthält Gene, die von der Zelle häufig exprimiert werden. Der andere Typ, das Heterochromatin, ist die kompaktere Form und enthält DNA, die nur selten umgeschrieben wird. Diese Struktur wird weiter unterteilt in fakultatives Heterochromatin, das aus Genen besteht, die nur in bestimmten Zelltypen oder in bestimmten Entwicklungsstadien als Heterochromatin organisiert sind, und konstitutives Heterochromatin, das aus strukturellen Chromosomenbestandteilen wie Telomeren und Zentromeren besteht. Während der Interphase organisiert sich das Chromatin in einzelnen diskreten Flecken, den so genannten Chromosomenterritorien. Aktive Gene, die in der Regel in der euchromatischen Region des Chromosoms zu finden sind, befinden sich in der Regel an der Grenze des Chromosomen-Territoriums.
Antikörper gegen bestimmte Arten der Chromatinorganisation, insbesondere gegen Nukleosomen, wurden mit einer Reihe von Autoimmunkrankheiten wie dem systemischen Lupus erythematodes in Verbindung gebracht. Diese sind als antinukleäre Antikörper (ANA) bekannt und wurden auch in Verbindung mit Multipler Sklerose als Teil einer allgemeinen Störung des Immunsystems beobachtet.
Nukleolus

Der Nukleolus ist die größte der diskreten, dicht gefärbten, membranlosen Strukturen, die als Kernkörper bekannt sind und im Zellkern gefunden werden. Er bildet sich um Tandemwiederholungen der rDNA, der DNA, die für die ribosomale RNA (rRNA) kodiert. Diese Regionen werden als nukleolare Organisierungsregionen (NOR) bezeichnet. Die Hauptaufgaben des Nukleolus sind die Synthese von rRNA und der Zusammenbau von Ribosomen. Der strukturelle Zusammenhalt des Nukleolus hängt von seiner Aktivität ab, da die ribosomale Assemblierung im Nukleolus zu einer vorübergehenden Assoziation der nukleolären Komponenten führt, was eine weitere ribosomale Assemblierung und damit eine weitere Assoziation erleichtert. Dieses Modell wird durch die Beobachtung gestützt, dass die Inaktivierung der rDNA zu einer Vermischung der nukleolaren Strukturen führt.
Im ersten Schritt des Ribosomenaufbaus transkribiert ein Protein namens RNA-Polymerase I die rDNA, die einen großen prä-rRNA-Vorläufer bildet. Diese wird in zwei große rRNA-Untereinheiten – 5,8S und 28S – und eine kleine rRNA-Untereinheit 18S gespalten.:328 Die Transkription, die posttranskriptionelle Verarbeitung und der Zusammenbau der rRNA finden im Nukleolus statt, unterstützt durch kleine nukleolare RNA-Moleküle (snoRNA), von denen einige aus gespleißten Introns von Boten-RNAs stammen, die Gene kodieren, die mit der ribosomalen Funktion zusammenhängen. Die zusammengebauten ribosomalen Untereinheiten sind die größten Strukturen, die die Kernporen passieren.:526
Bei der Betrachtung unter dem Elektronenmikroskop kann man erkennen, dass der Nukleolus aus drei unterscheidbaren Regionen besteht: den innersten fibrillären Zentren (FCs), umgeben von der dichten fibrillären Komponente (DFC) (die Fibrillarin und Nucleolin enthält), die wiederum von der granulären Komponente (GC) (die das Protein Nucleophosmin enthält) begrenzt wird. Die Transkription der rDNA findet entweder in der FC oder an der FC-DFC-Grenze statt, so dass bei erhöhter rDNA-Transkription in der Zelle mehr FCs nachgewiesen werden. Der größte Teil der Spaltung und Modifikation der rRNAs findet im DFC statt, während die letzten Schritte, die die Proteinmontage an den ribosomalen Untereinheiten beinhalten, im GC stattfinden.
Andere Kernkörper
| Strukturname | Strukturdurchmesser | Ref. |
|---|---|---|
| Cajalkörper | 0,2-2,0 µm | |
| Klastosomen | 0,2-0.5 µm | |
| PIKA | 5 µm | |
| PML-Körper | 0,2-1,0 µm | |
| Paraspeckles | 0.5-1,0 µm | |
| Speckles | 20-25 nm |
Neben dem Nukleolus enthält der Zellkern eine Reihe weiterer Kernkörper. Dazu gehören die Cajal-Körperchen, die Gemini von Cajal-Körperchen, die polymorphe karyosomale Interphasenassoziation (PIKA), die Promyelozytenleukämie-Körperchen (PML), die Paraspeckles und die Spleißflecken. Obwohl über eine Reihe dieser Domänen nur wenig bekannt ist, sind sie insofern von Bedeutung, als sie zeigen, dass das Nukleoplasma kein einheitliches Gemisch ist, sondern organisierte funktionelle Subdomänen enthält.
Andere subnukleare Strukturen treten im Rahmen abnormaler Krankheitsprozesse auf. So wurde beispielsweise in einigen Fällen von nemaliner Myopathie über das Vorhandensein kleiner intranukleärer Stäbchen berichtet. Die Stäbchen selbst bestehen aus mutiertem Aktin sowie anderen Zytoskelettproteinen.
Cajal-Körperchen und Edelsteine
Ein Zellkern enthält typischerweise zwischen einem und zehn kompakte Strukturen, die als Cajal-Körperchen oder Coiled Bodies (CB) bezeichnet werden und deren Durchmesser je nach Zelltyp und -art zwischen 0,2 µm und 2,0 µm beträgt. Unter dem Elektronenmikroskop betrachtet, ähneln sie Knäueln aus verknoteten Fäden und sind dichte Verteilungszentren für das Protein Coilin. CBs sind an einer Reihe verschiedener Aufgaben im Zusammenhang mit der RNA-Verarbeitung beteiligt, insbesondere an der Reifung kleiner nuklearer RNA (snoRNA) und kleiner nuklearer RNA (snRNA) sowie an der Modifikation von Histon-mRNA.
Ähnlich wie Cajal-Körperchen sind Gemini von Cajal-Körperchen oder Edelsteine, deren Name vom Sternbild der Zwillinge abgeleitet ist, was auf ihre enge „Zwillings“-Verwandtschaft mit CBs hinweist. Edelsteine haben eine ähnliche Größe und Form wie Cajal-Körperchen und sind unter dem Mikroskop praktisch nicht von diesen zu unterscheiden. Im Gegensatz zu den CBs enthalten Edelsteine keine kleinen nuklearen Ribonukleoproteine (snRNPs), wohl aber ein Protein namens survival of motor neuron (SMN), dessen Funktion mit der snRNP-Biogenese zusammenhängt. Es wird angenommen, dass die Edelsteine die CBs bei der snRNP-Biogenese unterstützen, obwohl mikroskopische Beweise darauf hindeuten, dass CBs und Edelsteine unterschiedliche Erscheinungsformen derselben Struktur sind. Spätere ultrastrukturelle Studien haben gezeigt, dass Edelsteine Zwillinge von Cajal-Körpern sind, wobei der Unterschied in der Coilin-Komponente besteht; Cajal-Körper sind SMN-positiv und Coilin-positiv, und Edelsteine sind SMN-positiv und Coilin-negativ.
PIKA- und PTF-Domänen
PIKA-Domänen oder polymorphe interphasische karyosomale Assoziationen wurden erstmals 1991 in mikroskopischen Studien beschrieben. Ihre Funktion ist nach wie vor unklar, obwohl man davon ausging, dass sie nicht mit aktiver DNA-Replikation, Transkription oder RNA-Verarbeitung verbunden sind. Es wurde festgestellt, dass sie häufig mit diskreten Domänen assoziiert sind, die durch eine dichte Lokalisierung des Transkriptionsfaktors PTF definiert sind, der die Transkription kleiner nukleärer RNA (snRNA) fördert.
PML-Körperchen
Promyelozytäre Leukämiekörperchen (PML-Körperchen) sind kugelförmige Körperchen, die im gesamten Nukleoplasma verstreut zu finden sind und etwa 0,1-1,0 µm groß sind. Sie sind auch unter einer Reihe anderer Namen bekannt, darunter Nukleardomäne 10 (ND10), Kremer-Körper und PML-Onkodomänen. PML-Körperchen sind nach einem ihrer Hauptbestandteile, dem promyelozytären Leukämieprotein (PML), benannt. Sie werden häufig im Zellkern in Verbindung mit Cajal-Körpern und Spaltungskörpern beobachtet. Pml-/–Mäuse, die nicht in der Lage sind, PML-Körper zu bilden, entwickeln sich normal und ohne offensichtliche negative Auswirkungen, was zeigt, dass PML-Körper für die meisten wesentlichen biologischen Prozesse nicht erforderlich sind.
Spleißflecken
Speckles sind subnukleare Strukturen, die mit Prä-Messenger-RNA-Spleißfaktoren angereichert sind und sich in den Interchromatin-Regionen des Nukleoplasmas von Säugetierzellen befinden. Unter dem Fluoreszenzmikroskop erscheinen sie als unregelmäßige, punktförmige Strukturen, die in Größe und Form variieren, und bei elektronenmikroskopischer Untersuchung sind sie als Cluster von Interchromatin-Granula zu erkennen. Speckles sind dynamische Strukturen, und sowohl ihre Protein- als auch ihre RNA-Protein-Komponenten können kontinuierlich zwischen Speckles und anderen Orten im Kern, einschließlich aktiver Transkriptionsstellen, wechseln. Studien über die Zusammensetzung, die Struktur und das Verhalten von Speckles haben ein Modell für das Verständnis der funktionellen Kompartimentierung des Zellkerns und der Organisation der Genexpressionsmaschinerie geliefert, die snRNPs und andere Spleißproteine spaltet, die für die Verarbeitung der prä-mRNA notwendig sind. Aufgrund der sich ändernden Anforderungen einer Zelle ändert sich die Zusammensetzung und Lage dieser Körper in Abhängigkeit von der mRNA-Transkription und der Regulierung durch Phosphorylierung bestimmter Proteine. Die Spleißkörperchen sind auch als Kernflecken (nuclear speckles), Spleißfaktor-Kompartimente (SF-Kompartimente), Interchromatin-Granulat-Cluster (IGCs) und B-Snurposome bekannt.B-Snurposome finden sich in den Eizellenkernen von Amphibien und in Embryonen von Drosophila melanogaster. In den elektronenmikroskopischen Aufnahmen der Amphibienkerne erscheinen die B-Snurposomen allein oder in Verbindung mit den Cajal-Körpern. IGCs fungieren als Speicherstellen für die Spleißfaktoren.
Paraspeckles
Die 2002 von Fox et al. entdeckten Paraspeckles sind unregelmäßig geformte Kompartimente im Interchromatinraum des Zellkerns. Sie wurden erstmals in HeLa-Zellen nachgewiesen, wo es im Allgemeinen 10-30 pro Kern gibt. Inzwischen ist bekannt, dass Paraspeckles auch in allen menschlichen Primärzellen, transformierten Zelllinien und Gewebeschnitten vorkommen. Ihr Name leitet sich von ihrer Verteilung im Zellkern ab; das „para“ steht für „parallel“ und die „Speckles“ beziehen sich auf die Spleißspeckles, zu denen sie immer in unmittelbarer Nähe sind.
Paraspeckles sequestrieren Kernproteine und RNA und scheinen somit als molekularer Schwamm zu fungieren, der an der Regulierung der Genexpression beteiligt ist. Außerdem sind Paraspeckles dynamische Strukturen, die sich als Reaktion auf Veränderungen der zellulären Stoffwechselaktivität verändern. Sie sind transkriptionsabhängig, und in Abwesenheit der RNA Pol II-Transkription verschwindet der Paraspeckle und alle mit ihm verbundenen Proteinkomponenten (PSP1, p54nrb, PSP2, CFI(m)68 und PSF) bilden eine halbmondförmige perinukleolare Kappe im Nukleolus. Dieses Phänomen lässt sich während des Zellzyklus nachweisen. Im Zellzyklus sind Paraspeckles während der Interphase und während der gesamten Mitose mit Ausnahme der Telophase vorhanden. Während der Telophase, wenn die beiden Tochterkerne gebildet werden, findet keine RNA Pol II-Transkription statt, so dass die Proteinkomponenten stattdessen eine perinukleolare Kappe bilden.
Perichromatinfibrillen
Perichromatinfibrillen sind nur unter dem Elektronenmikroskop sichtbar. Sie befinden sich in der Nähe des transkriptionsaktiven Chromatins und sind vermutlich die Orte aktiver prä-mRNA-Verarbeitung.
Klastosomen
Klastosomen sind kleine Kernkörperchen (0,2-0,5 µm), die aufgrund der peripheren Kapsel um diese Körperchen als dick ringförmig beschrieben werden. Der Name leitet sich vom griechischen klastos, zerbrochen und soma, Körper, ab. Klastosomen sind in normalen Zellen normalerweise nicht vorhanden und daher schwer zu erkennen. Sie bilden sich unter hohen proteolytischen Bedingungen innerhalb des Zellkerns und werden abgebaut, sobald die Aktivität nachlässt oder wenn die Zellen mit Proteasom-Inhibitoren behandelt werden. Das geringe Vorkommen von Klastosomen in Zellen deutet darauf hin, dass sie für die Funktion des Proteasoms nicht erforderlich sind. Es hat sich gezeigt, dass auch osmotischer Stress die Bildung von Klastosomen bewirkt. Diese Kernkörper enthalten katalytische und regulatorische Untereinheiten des Proteasoms und seiner Substrate, was darauf hindeutet, dass Klastosomen Orte für den Abbau von Proteinen sind.