Die Sulfonierung von Methylbenzol
Methylbenzol ist reaktionsfreudiger als Benzol, da die Methylgruppe dazu neigt, Elektronen in Richtung Ring zu „schieben“.
Diese höhere Reaktivität hat zur Folge, dass Methylbenzol mit rauchender Schwefelsäure bei 0°C und mit konzentrierter Schwefelsäure reagiert, wenn sie etwa 5 Minuten lang unter Rückfluss erhitzt wird.
Neben der Auswirkung auf die Reaktionsgeschwindigkeit muss man bei Methylbenzol auch berücksichtigen, wo die Sulfonsäuregruppe im Verhältnis zur Methylgruppe am Ring endet. Methylgruppen haben die Tendenz, neue Gruppen in die 2- und 4-Positionen des Rings zu „lenken“ (vorausgesetzt, die Methylgruppe befindet sich in der 1-Position). Man sagt, dass Methylgruppen 2,4-dirigierend sind.
So erhält man ein Gemisch, das hauptsächlich aus zwei Isomeren besteht. Nur etwa 5 – 10 % des 3-Isomers werden gebildet. Die wichtigsten Reaktionen sind:
![]()
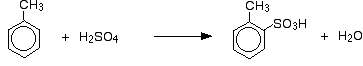
und:
![]()
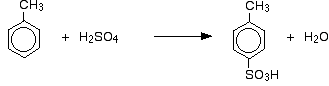
Bei der Sulfonierung hängt der genaue Anteil der gebildeten Isomere von der Temperatur der Reaktion ab. Mit steigender Temperatur nimmt der Anteil des 4-Isomers zu und der Anteil des 2-Isomers ab. Der Grund dafür ist, dass die Sulfonierung reversibel ist. Die Sulfonsäuregruppe kann wieder vom Ring abfallen und sich an anderer Stelle wieder anlagern. Dies begünstigt tendenziell die Bildung des thermodynamisch stabilsten Isomers. Dieser Austausch findet eher bei höheren Temperaturen statt.
Das 4-Isomer ist stabiler, weil es im Molekül kein Durcheinander gibt, wie es der Fall wäre, wenn die Methylgruppe und die Sulfonsäuregruppe nebeneinander stünden.