Man muss einige grundlegende Eigenschaften der gegebenen Verbindung und ihrer Lewis-Struktur kennen, um ihre molekulare Geometrie, Polarität und andere solche Eigenschaften zu verstehen. SF4 ist eine chemische Formel für Schwefeltetrafluorid. Es handelt sich um ein farbloses, korrosives Gas, das bei der Synthese verschiedener fluororganischer Verbindungen verwendet wird. SF4 ist eine ziemlich gefährliche Verbindung, wird aber in der chemischen und pharmazeutischen Industrie häufig verwendet.
| Name des Moleküls | Schwefeltetraflourid ( SF4) |
| Anzahl der Valenzelektronen im Molekül | 34 |
| Hybridisierung von SF4 | sp3 Hybridisierung |
| Bindungswinkel | 102 Grad und 173 Grad |
| Molekulare Geometrie von SF4 | Trigonal bipyramidal |
Zum Verständnis der Eigenschaften dieses Moleküls, wie seine Reaktivität, Polarität und mehr, muss man zunächst die SF4-Lewis-Struktur kennen.
Inhalt
SF4 Molekulargeometrie
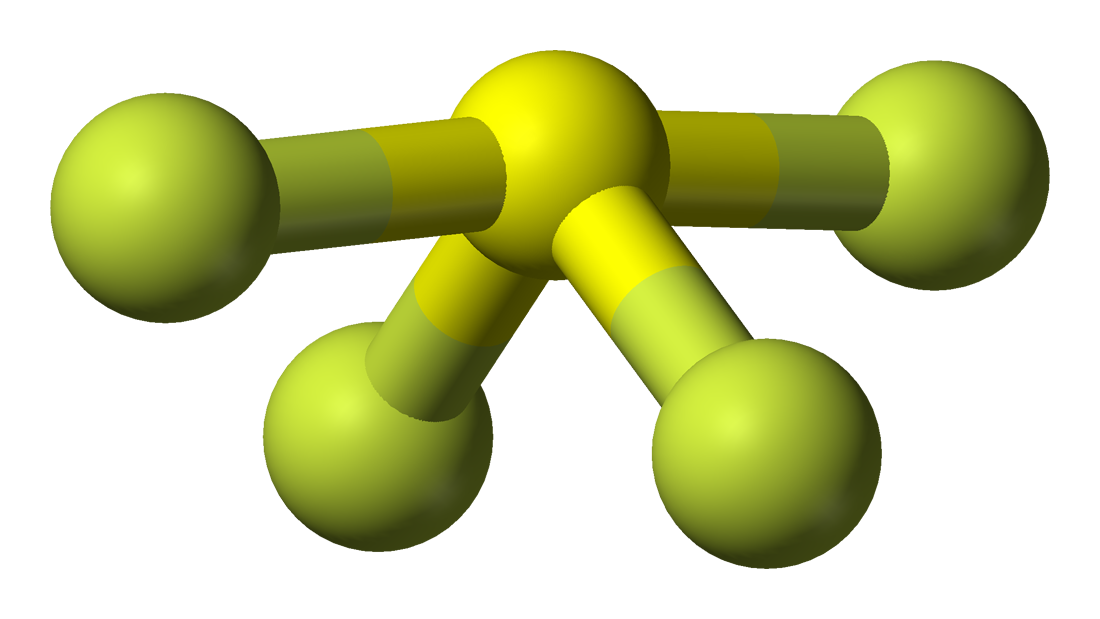
Die Molekulargeometrie eines bestimmten Moleküls lässt sich leicht mit Hilfe der Molekularformel oder des VSEPR-Modells verstehen. Eine Molekülformel hilft dabei, die genaue Anzahl und Art der in einer bestimmten Verbindung vorhandenen Atome zu ermitteln. In diesem Fall enthält die Verbindung ein Schwefelatom und vier Fluoratome, was sie der Molekularformel von AX4E ähnlich macht.
Moleküle mit der Summenformel AX4E haben eine trigonale bipyramidale Molekülgeometrie. Hier befinden sich zwei Fluoratome, die mit dem Schwefelatom eine Bindung eingehen, an den äquatorialen Positionen und die beiden anderen an den axialen Positionen. Da sich am Zentralatom ein einsames Elektronenpaar befindet, stößt es das bindende Elektronenpaar ab, wodurch die Form ein wenig verändert wird und wie eine Wippe wirkt. Die Elektronen folgen diesem Anordnungsmuster nach der VSEPR-Regel, um die Abstoßungskräfte zwischen den einsamen Elektronenpaaren zu minimieren und die Stabilität des Moleküls zu maximieren.
Daher hat SF4 eine trigonale bipyramidale Molekülgeometrie.
SF4 Lewis-Struktur
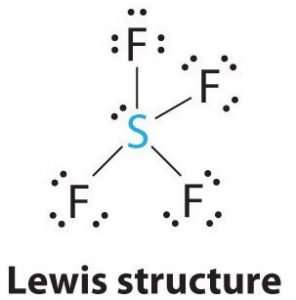
Die Lewis-Struktur ist eine bildliche Darstellung der Bindungen und Valenzelektronen im Molekül. Die zwischen zwei Atomen gebildeten Bindungen werden durch Linien dargestellt, während die Valenzelektronen, die keine Bindungen bilden, durch Punkte dargestellt werden. Die Valenzelektronen, die an der Bildung von Bindungen beteiligt sind, werden als bindende Elektronenpaare bezeichnet, während die Elektronen, die nicht beteiligt sind oder keine Bindungen bilden, als nichtbindende Elektronenpaare oder einsame Paare bezeichnet werden.
Um die Lewis-Struktur von SF4 zu zeichnen, müssen wir zunächst die Gesamtzahl der Valenzelektronen in diesem Molekül kennen.
Wie man wahrscheinlich sehen kann, gibt es in dieser Verbindung ein Schwefelatom und vier Fluoratome. Um die gesamten Valenzelektronen dieser Verbindung zu kennen, müssen wir die Valenzelektronen der beiden Atome einzeln kennen.
- Valenz-Elektronen von Schwefel: 6
- Valenz-Elektronen von Fluor: 4* (7)
( da es vier Fluoratome gibt, müssen wir die Valenzelektronen aller Atome berücksichtigen)
Gesamtzahl der Valenzelektronen in SF4 = Anzahl der Valenzelektronen in Schwefel + Anzahl der Valenzelektronen in Fluor
= 6 + 28
= 34 Valenzelektronen
Nun, da wir die Gesamtzahl der Valenzelektronen kennen, wird es für uns einfach, die Bindungsbildung zwischen den Atomen und auch die vollständige Anordnung des Moleküls zu verstehen.
Schwefel wird das zentrale Atom in diesem Molekül sein, da es das am wenigsten elektronegative ist, wobei vier Fluoratome an den Seiten dieses zentralen Atoms Bindungen bilden. Jedes Fluoratom geht eine Bindung mit dem Zentralatom ein, d. h. es gibt vier Bindungen in der Molekülstruktur, die vier Valenzelektronen der Fluoratome und vier Elektronen des Schwefelatoms verbrauchen. Es werden also acht Valenzelektronen verwendet, wodurch sich die Anzahl der Valenzelektronen von 34 auf 24 verringert. Alle Fluoratome haben sechs Valenzelektronen und das Zentralatom hat zwei Valenzelektronen.
Ziehe Linien zwischen S und F, um die Bindungen darzustellen, und verwende Punkte für einsame Elektronenpaare. Jedes Fluoratom hat drei Paare von 6 Valenzelektronen (als Punkte dargestellt) und eine Bindung mit Schwefel. Im Gegensatz dazu hat das Zentralatom zwei Valenzelektronen und vier Bindungen.
Das Zentralatom, der Schwefel, hat also ein einsames Elektronenpaar und vier Bindungselektronenpaare in der Lewis-Struktur von SF4. Gleichzeitig hat jedes Fluoratom drei einsame Elektronenpaare.
Ist SF4 polar?
Wenn wir die Lewis-Struktur und die Molekülgeometrie der gegebenen Verbindung kennen, wird es einfacher, die Polarität des Moleküls darzustellen. Hier führen ein einsames Paar am zentralen Schwefelatom und vier Bindungselektronenpaare zu einer asymmetrischen Verteilung der Elektronen am Zentralatom.
Da die Form des Moleküls einer Wippe gleicht, können zwei Fluoratome das Dipolmoment des jeweils anderen aufheben, die beiden anderen jedoch nicht, da die Elektronen anders angeordnet sind. Und da die Fluoratome elektronegativer sind als die Schwefelatome, führt dies zu einer ungleichmäßigen Verteilung der Ladung. Daher wird das Dipolmoment nicht aufgehoben, was das Molekül polar macht. Also ja, SF4 ist polar.
SF4-Hybridisierung
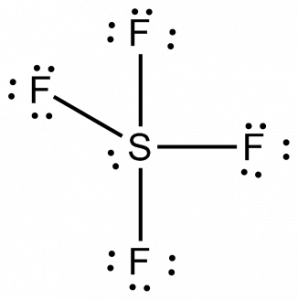
Um die Hybridisierung des SF4-Moleküls zu erkennen, schauen wir uns zunächst die Bereiche der Elektronendichte für das Zentralatom an.
Schwefel hat vier bindende Elektronenpaare und ein einsames Paar, so dass die Gesamtzahl der Regionen der Elektronendichte 5 beträgt. Das Schwefelatom besitzt also fünf hybridisierte Orbitale, ein 3s-Orbital, drei 3p-Orbitale und ein 3d-Orbital. Diese Anordnung der Elektronen um das Atom und der hybridisierten Orbitale führt zur sp3d-Hybridisierung. Man kann auch die sterische Zahl verwenden, um die Hybridisierung zu erkennen; hier ist die sterische Zahl 5 für das Schwefelatom.
Damit hat SF4 eine sp3d-Hybridisierung.
SF4 Bindungswinkel und Form
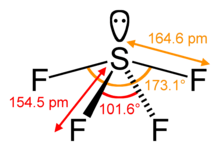
Das zentrale Schwefelatom bildet vier Bindungen mit den benachbarten Fluoratomen und hat ein einsames Elektronenpaar. Die Fluoratome an den äquatorialen Positionen haben Bindungswinkel von 102 Grad und die axialen von 173 Grad, was etwas von der trigonalen bipyramidalen Molekülgeometrie abweicht und zu einer Wippenform führt.
Das einsame Paar am Zentralatom führt zu einer Änderung der Bindungswinkel von 120 Grad auf 102 Grad für äquatoriale Fluoratome und 173 Grad statt 180 Grad für axiale Fluoratome.
Abschließende Bemerkungen
Zum Abschluss aller Eigenschaften können wir sagen, dass,
- Schwefeltetrafluorid 34 Valenzelektronen hat, von denen es vier kovalente Bindungen und ein einsames Elektronenpaar am Zentralatom in seiner Lewis-Struktur bildet.
- Es gibt drei einsame Elektronenpaare an jedem Fluoratom.
- Es hat eine Molekülgeometrie der Formel AX4E; es bildet eine Wippenform und hat eine trigonale bipyramidale Molekülgeometrie.
- SF4 hat eine sp3d-Hybridisierung und ist von Natur aus polar.