Die Flaviviradae sind eine große Familie von viralen Krankheitserregern, die schwere Krankheiten und Todesfälle bei Mensch und Tier verursachen können. Die Familie besteht aus drei Gattungen: Flavivirus, Pestivirus und Hepacivirus. Die Gattung Flavivirus, die größte der drei Gattungen, enthält mehr als 70 Viren, darunter das Dengue-Virus (DV), das Japanische Enzephalitis-Virus (JEV), das West-Nil-Virus (WNV), das Gelbfieber-Virus (YFV) und das Zika-Virus (ZIKV). Flaviviren weisen eine einheitliche Morphologie mit einem ikosaedrischen Kapsid und einer eng anliegenden, stacheligen Hülle auf. Die Größe des Kapsids beträgt etwa 30 nm und das gesamte Virion misst 45 nm. Das Genom der Flaviviren ist eine einsträngige Sense-RNA mit einer Größe von etwa 10 kb. Es kodiert für drei Strukturproteine: Kapsid (C-Protein), Membran (M, das als prM, der Vorläufer von M, exprimiert wird) und Hülle (E-Protein) sowie für sieben Nichtstrukturproteine: NS1, NS2A, NS2B, NS3, NS4A, NS4B und NS5 (Abbildung 1 a.b).
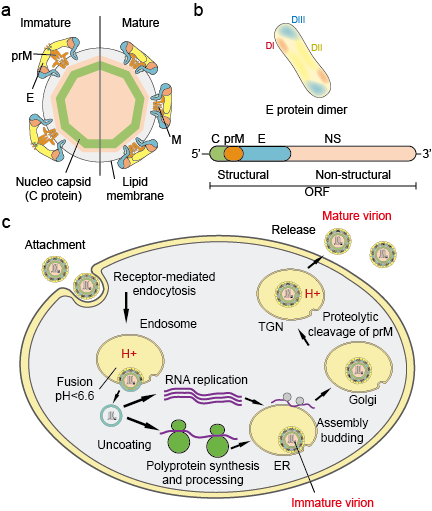
Abbildung 1. Flaviviruspartikel (a), Proteine (b) und Lebenszyklus (c).
Alle Flavivirus-verwandten Produkte durchsuchen
Lebenszyklus von Flaviviren:
Viren heften sich an die Oberfläche einer Wirtszelle und dringen anschließend durch rezeptorvermittelte Endozytose in die Zelle ein (Abbildung 1c). Es wurden mehrere Primärrezeptoren und Co-Rezeptoren mit geringer Affinität für Flaviviren identifiziert. Die Ansäuerung des endosomalen Vesikels löst Konformationsänderungen im Virion, die Fusion der Virus- und der Zellmembran und den Abbau der Partikel aus. Nach der Freisetzung des Genoms in das Zytoplasma wird die Positiv-Sense-RNA in ein einzelnes Polyprotein übersetzt, das ko- und posttranslational durch virale und Wirtsproteasen verarbeitet wird. Die Genomreplikation erfolgt an intrazellulären Membranen. Die Virusassemblierung erfolgt an der Oberfläche des endoplasmatischen Retikulums (ER), wenn die Strukturproteine und die neu synthetisierte RNA in das Lumen des ER eindringen. Die entstehenden nicht-infektiösen, unreifen viralen und subviralen Partikel werden durch das trans-Golgi-Netzwerk (TGN) transportiert. Die unreifen Virionpartikel werden von der Wirtsprotease Furin gespalten, wodurch reife, infektiöse Partikel entstehen. Subvirale Partikel werden ebenfalls durch Furin gespalten. Reife Virionen und subvirale Partikel werden anschließend durch Exozytose freigesetzt.
Flavivirus-Epidemiologie:
Die von Moskitos übertragenen Flaviviren werden in der Natur in einem oder mehreren getrennten oder sich überschneidenden Zyklen übertragen, die einen Moskito-Vektor, im Allgemeinen Aedes-Mücken für YFV und DENV und Culex-Mücken für JEV und WNV, und einen Säugetier- oder Vogelwirt umfassen. Die Übertragung zwischen Stechmücken und Wirbeltierwirten wird als horizontale Übertragung bezeichnet und verursacht Krankheiten bei Wirbeltieren. Im Gegensatz zur horizontalen Übertragung können durch Stechmücken übertragene Flaviviren in der Umwelt durch vertikale, d. h. transgenerationale Übertragungen aufrechterhalten werden, die die Ausbreitung der Flaviviren ausschließlich in Stechmücken ermöglichen. Der direkteste Beweis für die vertikale Übertragung von durch Stechmücken übertragenen Flaviviren ergibt sich aus der Isolierung von Viren aus infizierten Larven, die vermutlich durch transovarielle Übertragung entstanden sind. Diese Beobachtung steht im Einklang mit dem Nachweis viraler Antigene im Ovarialgewebe infizierter Stechmücken. (Abbildung 2)
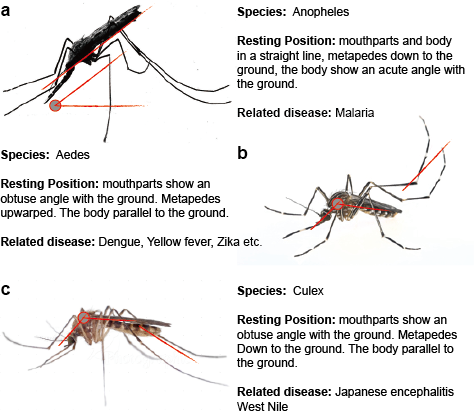
Abbildung 2. Drei typische krankheitsübertragende Stechmücken.
Flaviviren sind weltweit verbreitet, und einige Mitglieder der Gattung stellen ein großes Problem für die öffentliche Gesundheit dar (z. B. Gelbfiebervirus, Dengue-Virus, West-Nil-Virus und Japanisches Enzephalitis-Virus), das mit hoher Morbidität und/oder Mortalität verbunden ist. In den letzten zehn Jahren haben Flaviviren eine zunehmende Prävalenz gezeigt und stellen ein Risiko für mehr als 3 Milliarden Menschen weltweit dar, was sie zu einem Paradigma für neu auftretende Krankheiten macht.
In den letzten 50 Jahren haben viele Flaviviren, wie z. B. Dengue-, West-Nil- und Gelbfieberviren, eine dramatische Zunahme der Inzidenz, des Schweregrads der Erkrankung und/oder der geografischen Verbreitung erfahren. Aus der Umwelt stammende virale Krankheitserreger weisen relativ einheitliche epidemiologische Merkmale auf. Stechmücken, Zecken und Stechfliegen dienen als Vektoren für die meisten menschlichen Viruserkrankungen. Menschliche Erkrankungen treten auf, wenn die Vektoren aktiv sind, typischerweise im Frühling, Sommer und Herbst in gemäßigten Klimazonen, und weisen oft ausgeprägte epidemiologische Merkmale auf, die dem Lebensraum des Vektors entsprechen (Abbildung 3).
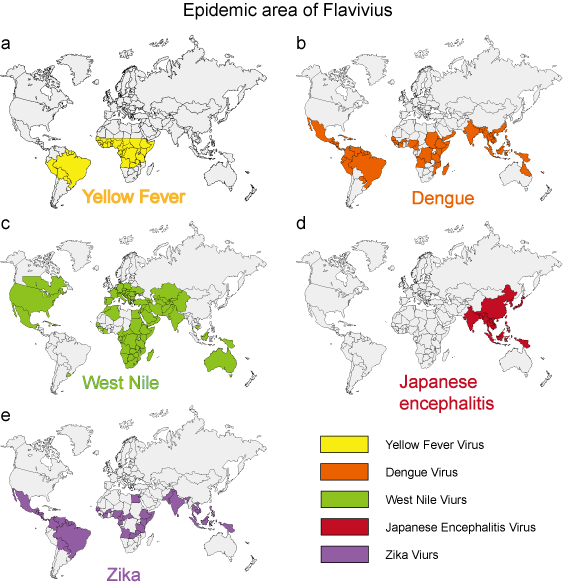
Abbildung 3. Das epidemische Gebiet von 5 typischen Flaviviren.
Manifestationen:
Flaviviren unterscheiden sich stark in ihrem pathogenen Potenzial und den Mechanismen zur Erzeugung menschlicher Krankheiten (Tabelle 1). Die Infektion des Menschen mit Flaviviren, die sowohl durch Mücken als auch durch Zecken übertragen werden, wird durch die Ablagerung des Virus durch die Haut über den Speichel eines infizierten Arthropoden ausgelöst. Das Virus vermehrt sich lokal und in regionalen Lymphknoten und führt zu einer Virämie. Zu den wichtigsten Syndromen und Beispielen für verursachende Flaviviren gehören: Enzephalitis (Japanische Enzephalitis), fieberhafte Erkrankung mit Ausschlag (Dengue-Virus), hämorrhagisches Fieber (Kyasanur-Waldkrankheit-Virus und manchmal Dengue-Virus) und hämorrhagisches Fieber mit Hepatitis (Gelbfieber-Virus).
Tabelle 1 Überblick über die wichtigsten Flaviviren
| Virusarten | Übertragungsvektor | Geographische Verbreitung | Syndrom |
|---|---|---|---|
| Gelbfieber | Moskito (Aedes) | Siehe Abbildung 3a | Hämorrhagisches Fieber |
| Dengue | Moskito (Aedes, Stegomyia) |
Siehe Abbildung 3b | Dengue-Syndrom, DHF, DSS |
| West-Nil-Fieber | Moskito (Culex), Zecken (Argasidae) |
Siehe Abbildung 3c | Dengue-Syndrom, Enzephalitis |
| Japanische Enzephalitis | Moskito (Culex) | Siehe Abbildung 3d | Enzephalitis |
| Zika | Moskito (Aedes) | Siehe Abbildung 3e | Mikrozephalie |
Diagnostik:
Die klinische Diagnose der verschiedenen Flaviviren ist aufgrund der unspezifischen Symptome nicht zuverlässig, und eine Labordiagnose ist zwingend erforderlich, um die Ätiologie der Krankheit zu bestätigen. Bei Flavivirus-Infektionen kann das Virus in der Regel 2-7 Tage nach Ausbruch der Krankheit im Serum oder Plasma nachgewiesen werden, wobei die Dauer dieser virämischen Phase und die nachgewiesene Viruslast je nach infizierendem Virus variieren (Tabelle 2). In der Regel setzt 5-7 Tage nach Ausbruch der Krankheit eine Immunreaktion gegen die Infektion ein, wobei die IgM-Antikörper nach 15 Tagen ihren Höhepunkt erreichen. Diese IgM-Antikörper können Monate (wie bei DENV) bis Jahre (wie bei WNV-Infektionen) überdauern. IgG-Antikörper treten 8-10 Tage nach dem Ausbruch der Infektion auf und können lebenslang nachgewiesen werden. Die besonderen Merkmale der einzelnen Flaviviren beeinflussen deutlich die diagnostischen Algorithmen, die bei der Identifizierung von Flavivirusinfektionen anzuwenden sind. Im Allgemeinen haben sich viele Laboratorien für serologische Tests entschieden, um durch Flaviviren verursachte Infektionen zu diagnostizieren, da diese genau sind und kommerzielle Tests auf der Grundlage hoher Qualitätsstandards zur Verfügung stehen. Das Vorhandensein serologischer Kreuzreaktionen zwischen den verschiedenen Viren und die für den Nachweis der Antikörper bei einigen Infektionen erforderliche Zeit beeinträchtigen jedoch den Nutzen der Serologie als Diagnoseinstrument für akute Flavivirusinfektionen. Die Virusisolierung stellt die „Goldstandard“-Methode für eine gesicherte Flavivirus-Diagnose dar.
Alle Flavivirus-ELSIA-Kit- und Flavivirus-RDT-Produkte anzeigen
Tabelle 2. Algorithmen zur Flavivirus-Diagnose.
| Akute Phase | Rekonvaleszente Phase | Bevorzugte Probe† | Erwartete Viruslast | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, Virusisolierung | IgM, IgG | Serum, Plasma und Gewebe | Hoch |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, Virusisolierung | IgM, IgG | Serum, Plasma, CSF und PBMCs | bis zu 106 Virionen/ml |
| WNV | RT-PCR, IgM, IgG | IgM, IgG | CSF und Serum | Low |
| JEV | RT-PCR, IgM, IgG | IgM, IgG | CSF, Serum, Blut und PBMCs | Low |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF und Serum | Low |
| Gould E A, Solomon T. Pathogenic flaviviruses . The Lancet, 2008, 371(9611): 500-509. | |
| Gaunt M W, Sall A A, de Lamballerie X, et al. Phylogenetische Beziehungen von Flaviviren korrelieren mit ihrer Epidemiologie, Krankheitsassoziation und Biogeographie . Journal of General Virology, 2001, 82(8): 1867-1876. | |
| Kuno G, Chang G J J, Tsuchiya K R, et al. Phylogeny of the genus Flavivirus . Journal of virology, 1998, 72(1): 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle. Nature Reviews Microbiology, 2005, 3(1): 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Flavivirus-mosquito interactions. Viruses, 2014, 6(11): 4703-4730. |