Introduction
Diese vom Epithel der Gallengänge ausgehende Neoplasie, das Cholangiokarzinom (CC), macht 10 % der hepatobiliären Tumoren und 2 % der malignen Tumoren aus.1,2 CC lassen sich je nach ihrem anatomischen Ursprung innerhalb des Gallengangs in 3 Subtypen unterteilen: intrahepatisches oder peripheres CC (ICC), perihilares CC oder Klatskin-Tumor (PHC) und distales CC.
PHC, das Gegenstand dieser Überarbeitung ist, ist der häufigste und macht etwa 40-60% aller CC aus.2,3 Dieser Tumor ist aggressiv und still, mit unspezifischen Symptomen bis zu fortgeschrittenen Stadien, was zu einer späten Diagnose und einer kurzen Überlebenszeit ohne Operation von 6 bis 12 Monaten führt.4 Eine Operation, die einzige verfügbare kurative Option, ist zum Zeitpunkt der Diagnose nur bei etwa 47 % der Patienten möglich.5-8 Die wichtigsten prognostischen Faktoren für diesen Tumor sind in der Regel mit den chirurgischen Optionen verbunden, wobei Tumorstadium, Größe, Ganglien- und Gefäßbeteiligung, intrahepatische Metastasierung und histologischer Typ die wichtigsten Faktoren sind.9-11
Anatomischer Raum
Der anatomische Raum, der von PHC eingenommen wird, wird durch den Eingang zum zystischen Gang auf distaler Ebene und die Verzweigung des rechten und linken Lebergangs auf proximaler Ebene abgegrenzt.1,12 Die am weitesten verbreiteten Klassifizierungen umfassen alle CC, die ihren Ursprung in der biliären Konfluenz oder deren Umgebung haben. Einige Gruppen haben die Ansicht vertreten, dass CC, die ihren Ursprung im Leberparenchym haben, manchmal in die Gallenkonfluenz eindringen können, mit einem Ursprung in dem anatomischen Raum, der durch die Quelle des hinteren rechten Pfortaderastes und das Ligamentum falciforme begrenzt wird.13-15 Diese ICC, die die Gallenkonfluenz betreffen, würden genauso behandelt werden wie Tumore mit extrahepatischem Ursprung, und die Überlebensrate ist ähnlich wie bei PHC im gleichen Stadium. Es handelt sich in der Regel um hoch entwickelte Tumoren mit lokoregionaler Gefäß- und Lymphknoteninvasion. Zweifel am biologischen Verhalten dieser Tumoren haben viele Gruppen dazu veranlasst, sie von perihilären Tumoren auszuschließen. In einer von Ebata et al.13,15 veröffentlichten Studie mit 250 Patienten, die wegen CC mit Beteiligung der Konfluenz reseziert wurden, wurden Stadium und Überleben danach analysiert, ob der Tumor intrahepatisch mit Beteiligung der Konfluenz (ICC) oder im extrahepatischen Gallengang (PHC) entstanden war. Insgesamt 83 Patienten hatten einen ICC und 167 einen PHC. Beim Vergleich der Stadien zeigte sich, dass Patienten mit ICC häufiger Gefäß- und Lymphknotenbefall aufwiesen und ein höheres TNM als die PHC-Gruppe hatten. 59 % der Patienten wiesen die Stadien iii und iv auf, gegenüber 38 % in der PHC-Gruppe. Wenn die Überlebensrate in beiden Gruppen nach Stadien aufgeteilt wird, gibt es jedoch nach 5 Jahren keine statistisch signifikanten Unterschiede, mit einer leicht höheren Gesamtüberlebensrate in der PHC-Gruppe (20 % gegenüber 29 %; P=.057), so dass die Schlussfolgerung gezogen wurde, dass sie in Bezug auf Behandlung und Überleben vergleichbar sind. Mit den verbesserten diagnostischen Tests und histopathologischen Erkenntnissen werden wir in Zukunft vielleicht besser definieren können, ob es sich um zwei verschiedene Entitäten handelt oder ob sie klinisch und biologisch dasselbe sind.
Histopatologische Merkmale
90% der PHC sind Adenokarzinome. Bei 10 % handelt es sich um adenosquamöse oder squamöse Karzinome, die in einigen Fällen mit einer Vorgeschichte von Lithiasis, Zysten oder Anomalien der Gallengänge in Verbindung gebracht wurden. Nach dem Erscheinungsbild des Tumors, dem Wachstumstyp und dem biologischen und klinischen Verhalten der PHC werden sie wie folgt eingeteilt16,17:
- –
Tumor- oder „massenbildende“ CC: Dies ist die häufigste Präsentationsform bei ICC, obwohl sie auch bei einer großen Anzahl von PHC zu finden ist. Er ist durch die Bildung einer Tumormasse mit klar definierten Rändern gekennzeichnet. Er weist eine starke fibrotische Reaktion auf, und häufig kommt es auch zu einer zentralen Nekrose. Dieser Tumor hat seinen Ursprung in der Öffnung des Gallengangs, dringt in die Wand ein und breitet sich durch dreidimensionales Wachstum aus, wobei er eine knotige Masse bildet, die obstruktive Symptome hervorruft.16-19
- –
Infiltrierende periduktale CC: Tumore dieses Typs wachsen entlang eines Gallengangs in Form einer konzentrischen Längsverdickung durch das Bindegewebe um den Gang herum und verursachen eine Stenose oder vollständige Obstruktion des betroffenen Gallengangs.19 Die meisten PHC gehören zu diesem Typ und sind mit bildgebenden Verfahren nur schwer zu erkennen.17
- –
Intraduktale oder intraduktale papilläre CC: Diese Variante ist durch das Vorhandensein von oberflächlichen und intraluminalen Tumoren im Gallengang gekennzeichnet. Sie produzieren Muzin und führen zu einer teilweisen Obstruktion und Dilatation der Gänge.16 Dieser Tumor hat einen geringen Malignitätsgrad und ist in der Regel klein, obwohl er sich durch den Gallenschleim ausbreiten und mehrere Tumore bilden kann (Papilomatose oder papilläre Karzinomatose).20
Die Bedeutung dieser Unterscheidung liegt in den unterschiedlichen Überlebensraten je nach Subtyp. Mehrere Studien haben gezeigt, dass Patienten mit dem intraduktalen papillären Typ eine bessere Prognose haben als Patienten mit der skleral-nodulären Variante,21 mit einer durchschnittlichen Überlebenszeit von 55 bzw. 33 Monaten,22 während Gefäß- und Ganglienbefall beim intraduktalen papillären Subtyp seltener sind.
Zusammenfassend lässt sich sagen, dass es sich bei der Mehrzahl der PHC um Adenokarzinome mit periduktalem Wachstumsmuster handelt, die eine schlechtere Prognose haben, während die Variante mit intraduktalem Wachstum am seltensten vorkommt, obwohl sie eine bessere Prognose hat.
Staging-Systeme
Staging-Systeme für PHC lassen sich in prä- und postoperative Klassifikationen unterscheiden. Von den ersten, die bei der Planung der Operation verwendet werden, ist das wichtigste System die Bismuth-Corlette-Klassifikation. Sie gibt an, welcher Lappen bevorzugt betroffen ist, und zeigt daher die Art der Hepatektomie an, die durchgeführt werden sollte (Abb. 1).23 Diese Klassifikation wurde in den 1970er Jahren entwickelt und berücksichtigt weder den Lymphknotenbefall noch die Metastasierung, so dass sie heute weniger prognostischen Wert hat.
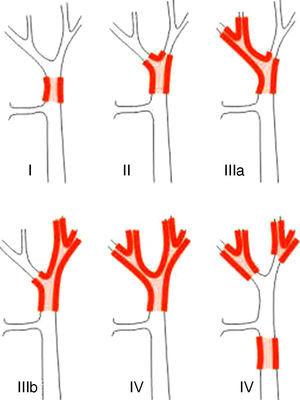
Die Bismuth-Corlette23-Klassifikation.
Eine weitere präoperative Klassifikation, die in den USA verwendet wird, ist die von Jarnagin et al.10 vom Memorial Sloan Kettering Cancer Centre, New York, veröffentlichte. Diese Klassifikation zielt darauf ab, die Resektabilität von Tumoren vorherzusagen, wobei 3 Faktoren der lokalen Ausdehnung berücksichtigt werden. Dabei handelt es sich um die Ausdehnung der Gallenwege, die Gefäßbeteiligung und die Atrophie der Lappen. Diese Klassifikation berücksichtigt weder den Lymphknotenbefall noch die Metastasierung, so dass sie weniger prognostischen Wert hat. Da die Resektabilität von Gruppe zu Gruppe unterschiedlich ist und die Tendenz zu immer aggressiveren Behandlungen geht, hängt ihr Wert von den Kriterien für die Nicht-Resektabilität der einzelnen Zentren ab. Eine lokale Beteiligung sollte heute kein Kriterium für die Nicht-Resektabilität sein, vorausgesetzt, wir können mit einer chirurgischen Resektion ein R0 erreichen.
Die am weitesten verbreitete postoperative Klassifikation ist die TNM-Klassifikation der Union for International Cancer Control (UICC), siebte Auflage.12 Diese Klassifikation berücksichtigt pathologische Daten wie lokale Ausdehnung, Gefäßbefall, Lymphknotenbefall und Metastasierung, um eine Klassifikation zu erstellen, die die Ausdehnung des Tumors einbezieht und prognostischer Natur ist.
Kürzlich veröffentlichte die „Japanese Study Group on Perihilar Cholangiocarcinoma“ (JSGPH) eine Studie, die eine Modifizierung der Klassifikation der „Union for International Cancer Control“ vorschlug. Die grundlegenden Unterschiede sind in Tabelle 1 aufgeführt und bestehen vor allem darin, dass13:
-
Bismut IV nicht als T4 angesehen wird. Die Klassifikation des JSGPH berücksichtigt daher nicht die bilaterale bilaterale Ausdehnung als schlechte Prognose, wenn eine R0-Resektion erreicht wird.
-
In Bezug auf die Stadien priorisiert sie den Lymphknotenbefall als schlechteste Prognose. Sie betrachten daher Lymphknotenbefall als Stadium iva und nicht iiib (TNM7).
Vergleich der grundlegenden Unterschiede zwischen der TNM-7-Klassifikation der UICC und dem Vorschlag der JSGPH.
| Tumorklassifikation | UICC | JSGPH Vorschlag |
|---|---|---|
| Tis | Karzinom in situ | |
| T1 | Tumor, der auf den Gallengang beschränkt ist | |
| T2a | Überwindet die Gangwand und dringt in perihilares Fettgewebe ein | |
| T2b | dringt in das Leberparenchym ein | |
| T3 | Einseitiges Eindringen in die Leberarterie/-vene | |
| T4 | Eindringen in den Hauptast der HA/PV, Wismut IV, oder Bismuth III mit kontralateraler Invasion des A/V | Gefäßinvasion des Hauptastes der HA/PV, mit bilateraler vaskulärer oder kontralateraler Invasion |
| TNM Stadium | ||
| 0 | Tis N0 M0 | |
| I | T1 N0 M0 | |
| II | T2 N0 M0 | |
| IIIa | T3 N0 M0 | |
| IIIb | T1-3 N1 M0 | T4 N0 M0 |
| Iva | T4 N× M0 | T× N1 M0 |
| Ivb | T× N× M1 | |
HA, hepatische Arterie; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, Tumorlymphknotenmetastasierung; UICC, Union for International Cancer Control; PV, Pfortader.
Auf europäischer Ebene wurde unter der Leitung der „International Cholangiocarcinoma Group for the Staging of PHC“ ein internationales Register für chirurgisch behandelte perihilare Tumore eingerichtet. Diese Gruppe hat eine neue Klassifikation1 veröffentlicht, die sowohl prä- als auch postoperativ die Tumorgröße sowie die biliäre, venöse, arterielle, ganglionäre und metastatische Beteiligung berücksichtigt. Die Einschränkungen dieser Klassifikation bestehen jedoch darin, dass sie lediglich die Tumoreigenschaften und die durchzuführende Operation beschreibt, ohne die Patienten anhand dieser Variablen in Gruppen oder Stadien einzuteilen. Infolgedessen ist es nicht möglich, prognostische Schlussfolgerungen zu ziehen, und es ist auch nicht möglich, die Ergebnisse verschiedener Gruppen zu vergleichen.
Vorangegangene Veröffentlichungen zeigen, dass die präoperative Klassifikation, die jetzt am häufigsten verwendet wird, um über die Art der Resektion zu entscheiden, die Bismuth-Corlette-Klassifikation ist, während die TNM-7-Klassifikation verwendet wird, um die Langzeitprognose zu definieren.
Diagnosestrategien
Die häufigsten mit PHC assoziierten Symptome sind: Gelbsucht (90 %), Gewichtsverlust und Bauchschmerzen (35 %), Juckreiz (26 %) und akute Cholangitis (10 %).17 Aufgrund dieser Symptome wird die Erstdiagnose in der Regel mit Hilfe eines abdominalen Ultraschalls gestellt, der ein guter Screening-Test ist. Andere diagnostische Tests für diese Art von Tumor wären:
- –
Abdominaler Doppler-Ultraschall: Er ermöglicht die Bewertung der arteriellen und portalen Permeabilität (Thrombose), was die Resektabilität des Tumors und die therapeutische Strategie beeinflussen kann, obwohl er nicht der Test der Wahl für die Bewertung der Gefäßbeteiligung ist.
- –
Abdominale axiale Computertomographie: Sie ist nützlich für die Diagnose des Primärtumors und der Ausbreitung der Krankheit, mit einer Sensitivität von 80 % bei der Beurteilung der Ausbreitung der Gallenwege. Sie ist die Technik der Wahl für die präoperative Beurteilung der Gefäßanatomie, mit einer Sensitivität von 93 % bzw. 87 % für die Beurteilung der arteriellen und portalen Beteiligung. Die Sensitivität für die präoperative Beurteilung des Lymphknotenbefalls ist gering (50 %).14,24 Sie ist auch für die Durchführung volumetrischer Tests und die Berechnung des nach der chirurgischen Resektion verbleibenden Lebervolumens nützlich. Sie ist auch der kostengünstigste Test für das präoperative Staging.
- –
Magnetresonanz- und Magnetresonanz-Cholangiographie (RM-Cholangiographie): der beste Test für die Diagnose des Primärtumors und die Beurteilung der Ausdehnung der Gallenwege. Sie hat eine Sensitivität von 86 % bis 100 % und ist besser als die direkte Cholangiographie, wobei es sich auch um einen nicht-invasiven Test handelt.25 Andererseits hat sie eine geringe Sensitivität für die Bewertung der Gefäßbeteiligung (73 %) und eine Sensitivität von 80 % für die Invasion des Leberparenchyms.
- –
Direkte Cholangiographie: endoskopische retrograde Cholangiopankreatographie (ERCP) und transparietale hepatische Cholangiographie (TPHC): Sie geben Aufschluss über den Grad der Gallengangsobstruktion und ermöglichen die Entnahme von Proben aus der Läsion für die Zytologie mit einer Empfindlichkeit von 20 %. Sie wurde in der Diagnose durch die MR-Cholangiographie ersetzt. Sie sind sehr nützlich für die präoperative Drainage der Gallenwege und für die palliative Behandlung von PHC, wobei vorzugsweise metallbeschichtete Stents eingesetzt werden.26-28
- –
Endoskopischer Ultraschall: Er ist nützlich für die Beurteilung der Ganglienbeteiligung im Bereich des Truncus celiacus und der peripankreatischen Region, für das präoperative Staging und für die Entnahme von Feinnadelaspirationsbiopsien.
- –
Positronenemissionstomographie: Sie ist nützlich bei der Untersuchung von Patienten mit Verdacht auf Metastasenbefall sowie bei Adenopathien im Bereich des Truncus zeliacus. Ihre Sensitivität ist umstritten und schwankt je nach veröffentlichter Serie zwischen 38 % und 90 %.14,24,29
- –
Tumormarker: Diese sind von begrenztem Nutzen, und CA 19.9 ist der am häufigsten verwendete. Die meisten Studien haben diese Marker bei Pankreasneoplasien und in geringerem Maße bei CC untersucht, ohne deren Lokalisation oder Merkmale zu spezifizieren. Die Serumspiegel dieser Marker werden aufgrund ihrer biliären Eliminierung durch eine Gallenobstruktion und Gelbsucht stark beeinflusst. Je nach Vorliegen einer Hepatopathie (300U/ml) oder einer Gelbsucht (1000U/ml) wurden unterschiedliche Normalwerte vorgeschlagen, während bei Bauchspeicheldrüsenkrebs eine Sensitivität von mehr als 70 % und eine Spezifität von mehr als 95 % erreicht wird. Die Konzentration bei diesen Patienten schwankt stark und korreliert nicht mit der Tumorgröße, wohl aber mit der Metastasierung. Die Sensitivität und Spezifität dieses Markers kann durch die Kombination mit CEA erhöht werden, vor allem bei Lewis-A-negativen Fällen (Nichtproduzenten von CA 19.9).30
Aus den obigen Angaben lässt sich ableiten, dass wir bei der Diagnose von PHC in der Regel mit einer Ultraschalluntersuchung beginnen. Dies geschieht im Zusammenhang mit einem Patienten mit Gelbsucht, während die Computertomographie und die MR-Cholangiographie die besten Staging-Tests sind und vor einer Operation am meisten empfohlen werden. Für die volumetrische Untersuchung kann die MR- oder Computertomographie verwendet werden, je nachdem, welche Geräte oder Computerprogramme in den einzelnen Krankenhäusern zur Verfügung stehen. Bestehen Zweifel an einer Ausbreitung in die Lymphknoten, die einer Operation entgegenstehen könnte, wird eine Positronenemissionstomographie oder eine Feinnadelaspirationsendoskopie empfohlen.
Nicht-Resezierbarkeitskriterien
Die Operation ist die einzige kurative Behandlung für PHC und bietet das beste Langzeitüberleben. Die Kriterien für die chirurgische Resektion haben sich in den letzten Jahren ausgeweitet, angefangen bei den Kriterien, die ursprünglich von dem Team des Memorial Sloan Kettering Cancer Center von Burke et al.31 im Jahr 1998 beschrieben wurden, bis hin zur jüngsten Einführung von Ansätzen mit vaskulärer Resektion und erweiterten Hepatektomien.3,5,32-34 Die Kriterien für die Nicht-Resezierbarkeit variieren von Krankenhaus zu Krankenhaus, und die am weitesten verbreiteten sind: vaskuläre Beteiligung auf einer Seite mit kontralateraler biliärer Beteiligung bis zur Teilung von Radikalen zweiten Grades, hepatische Fernmetastasen, vaskuläre Beteiligung beider Leberlappen, extrahepatische oder peritoneale Beteiligung und adenopathische Beteiligung des Truncus celiacus, der oberen Mesenterialarterie oder der paraaortalen Region.3,5,8,31
In einer von De Jong et al.34 veröffentlichten multizentrischen Studie, in der 305 Patienten untersucht wurden, die in 7 verschiedenen Zentren in den USA und Europa wegen PHC operiert wurden, und die auch Patienten mit Pfortaderbeteiligung einschloss, waren in der multivariablen Analyse die einzigen beiden statistisch signifikanten prognostischen Faktoren die Beteiligung des Resektionsrandes und die Lymphknotenbeteiligung (P=.02). In der von Ebata et al.15 veröffentlichten Studie, in der 1352 Patienten untersucht wurden, die in 8 japanischen Krankenhäusern wegen PHC mit kurativer Absicht operiert wurden, ergab die multivariable Analyse der statistisch signifikanten prognostischen Faktoren: Gefäßinvasion, Invasion der Bauchspeicheldrüse, Lymphknotenbefall, Vorhandensein von Metastasen und Befall des Resektionsrandes. Der Lymphknotenbefall und die Metastasierung waren die Faktoren, die im Vergleich zu den anderen zu einem schlechteren Überleben nach 5 Jahren führten (10 %, 20 % bzw. 63 %). Diese Ergebnisse sprechen für eine chirurgische Behandlung dieser Tumoren, wenn trotz lokaler Ausdehnung eine R0-Resektion möglich ist, da die Überlebenszeit unabhängig von der lokalen Ausdehnung auf 5 Jahre erhöht werden kann.
Aufgrund all dieser Erwägungen wird empfohlen, jeden Fall individuell zu beurteilen und eine chirurgische Behandlung durchzuführen, wenn eine R0-Resektion bei fehlender Fernmetastasierung oder Peritonealbeteiligung erreicht werden kann. Eine bilaterale biliäre und lokale vaskuläre Beteiligung sollte daher kein Kriterium für die Nichtresektabilität sein, wenn es möglich ist, zu operieren und dabei mehr als 30 % des Lebervolumens zu erhalten und eine onkologische Resektion zu erzielen.
Therapeutische StrategienDrainage der Gallenwege
Da die meisten PHC-Patienten mit Gelbsucht beginnen, ist eines der wichtigsten Dilemmata die Frage nach dem Nutzen einer präoperativen Drainage der Gallenwege. Diese ist jedoch nicht frei von Komplikationen, die bei der ERCP mit Einsetzen eines Stents auftreten können: Pankreatitis, Perforation des Zwölffingerdarms, Migration des Zwölffingerdarms, Obstruktion des Katheters und, was am wichtigsten ist, Cholangitis. Bei der Drainage mittels CTPH kommt es seltener zu einer präoperativen Cholangitis, aber sie ist mit Blutungen, Kathetermigration, bis zu 5 % Tumorausbreitung in der Trajektorie des Katheters sowie Unbehagen und Schmerzen in der Eintrittszone verbunden. Insgesamt ist den veröffentlichten Studien zufolge die ERCP mit einer Morbidität von 60 % und die CTPH mit einer Morbidität von 31 % verbunden.14,35
Aus diesen Gründen wurde der Nutzen der präoperativen biliären Drainage in der hepatobiliopankreatischen Chirurgie in Frage gestellt.36,37 Diese Studien, die alle Arten der hepatobiliären Chirurgie umfassen, haben gezeigt, dass die präoperative biliäre Drainage bei Patienten mit Gelbsucht die assoziierte Morbidität erhöht, ohne die Überlebensrate zu verbessern, und vor allem die Komplikationen durch Infektionen erhöht. In der 2013 von Farges et al.38 veröffentlichten europäischen Multicenterstudie wurden 366 Patienten retrospektiv analysiert, die sich aufgrund einer PHC einer Hepatektomie oder einer erweiterten Hepatektomie und Gallengangsresektion unterzogen hatten. Sie wurden danach eingeteilt, ob eine präoperative biliäre Drainage durchgeführt worden war oder nicht. Die Gruppe ohne präoperative Drainage (non-PBD) bestand aus 186 Patienten, die Gruppe mit biliärer Drainage (PBD) aus 180 Patienten. Die Gruppen waren in Bezug auf Alter, Tumorstadium und Portalresektion homogen. In der PBD-Gruppe wurden mehr rechtsseitige Hepatektomien durchgeführt (56 % gegenüber 44 %). Beim Vergleich der beiden Gruppen nach der Art der durchgeführten Operation zeigte sich, dass die Patienten, bei denen eine Rechtshepatektomie durchgeführt wurde, häufiger ein postoperatives Leberversagen aufwiesen, wenn sie der Nicht-PBD-Gruppe angehörten, mit einer Inzidenz von 16 % gegenüber 4 % in der PBD-Gruppe (P=.009). In der multivariablen Analyse der Faktoren, die mit einer höheren Sterblichkeit in der Gruppe der Rechtshepatektomie assoziiert waren, war ein Bilirubinspiegel von unter 3 mg/dL vor der Operation ein statistisch signifikanter Faktor. Vergleicht man jedoch die beiden Gruppen von Patienten mit linker Hepatektomie, so zeigt sich, dass in der PBD-Gruppe eine höhere Zahl postoperativer Sepsis auftrat, nämlich 6 % gegenüber 0 % in der Nicht-PBD-Gruppe (P=.014). Diese Studie zeigt, dass eine biliäre Drainage zwar die Inzidenz einer postoperativen Sepsis erhöht, dass aber bei Patienten, die sich einer Rechtshepatektomie unterziehen müssen, eine biliäre Drainage durchgeführt werden sollte, um die mit einem postoperativen Leberversagen verbundene Morbidität zu verringern, und andere Studien unterstützen diese Theorie.39 In Anbetracht der Tatsache, dass bei der Behandlung von PHC die einzigen Studien, die eine höhere Überlebensrate gezeigt haben, diejenigen sind, die umfangreiche Resektionen unterstützen, um eine R0-Resektion zu erreichen, wird eine biliäre Drainage empfohlen, wenn ein chirurgischer Eingriff indiziert ist, der eventuell eine umfangreiche Hepatektomie von mehr als 50 % des Lebervolumens oder eine Trisegmentektomie erfordert, oder wenn eine Cholangitis vorliegt. Der Grenzwert für die Bilirubinwerte, ab dem eine Drainage angezeigt ist, wird kontrovers diskutiert, wobei >10mg/dL einer der am häufigsten verwendeten Werte ist.5,37 Es wird empfohlen, eine Gallendrainage mittels CTPH durchzuführen, wobei eine externe Drainage gelegt wird, die eine Manipulation des Tumors vermeidet. Diese Methode hat eine geringere Inzidenz von Infektionen als die CPRE und ermöglicht bei Patienten mit einseitiger Drainage, bei denen sich der Bilirubinspiegel nicht normalisiert, eine bilaterale bilaterale Drainage.35,40
Eine Tumordissemination an der Punktionsstelle wurde in bis zu 5-10 % der Fälle beschrieben, in denen die CTPH eingesetzt wurde,14,24 obwohl in diesen Studien nicht angegeben wird, wann eine externe oder intern-externe Drainage eingesetzt wurde, und die Zeit bis zur Operation nicht berücksichtigt wird. Einige Autoren empfehlen die Verwendung einer endoskopisch positionierten nasobiliären Drainage, um eine Dissemination an der Punktionsstelle zu verhindern, wobei die Inzidenz von Cholangitis und Obstruktion des Stents geringer ist als bei der CPRE.41 In denselben Studien wird jedoch eingeräumt, dass die präoperative bilaterale bilaterale Drainage mit diesem System schwierig ist, was die Normalisierung des Bilirubinspiegels vor der Operation bei Patienten, bei denen die unilaterale Drainage fehlgeschlagen ist, erschwert.42
Um die Morbidität im Zusammenhang mit Infektionen nach der präoperativen bilateralen Drainage zu verringern, wird vorgeschlagen, die Galle nach der Drainage und während der Operation systematisch zu kultivieren. Mehrere Studien haben gezeigt, dass 78 %-94 % dieser Kulturen bei drainierten Patienten positiv sind, im Gegensatz zu 20 %-30 % bei nicht drainierten Patienten,43-45 und Enterokokken der am häufigsten isolierte Organismus sind. Diese Gruppen verteidigen den Einsatz prophylaktischer Antibiotika, die zwar die Antibiotikaresistenz der isolierten Spezies erhöhen, aber in veröffentlichten Studien zeigen, dass dadurch eine ähnliche postoperative Infektionsmorbidität wie bei nicht drainierten Gruppen erreicht wird. Die Wahl des Antibiotikums hängt von den Kulturen und dem Antibiogramm ab, obwohl die Mehrheit der Gruppen mindestens ein Cephalosporin der dritten Generation oder Fluorchinolone+Metronidazol verwendete, wenn keine Kultur zur Verfügung stand oder diese negativ war.43,44,46
Palliative Gallendrainage wird bei Patienten eingesetzt, die nicht reseziert werden können. Die Drainage kann mittels ERCP erfolgen, wobei ein beschichteter Metallstent belassen wird, oder mittels CTPH in den Fällen, in denen eine korrekte Drainage beider Gallengänge mittels ERCP nicht möglich ist.
Die präoperative biliäre Drainage sollte also definitiv bei allen Patienten mit einem Bilirubinwert von über oder gleich 10 mg/dL und bei Patienten, bei denen mehr als 50 % des Lebervolumens reseziert werden müssen, eingesetzt werden. Die Art des Vorgehens hängt vom Krankenhaus ab, wobei eine CTPH mit externer Drainage zu empfehlen ist, um eine Manipulation des Tumors und eine geringere Inzidenz von Cholangitis zu vermeiden. Einige Autoren empfehlen, dass Patienten mit Drainagen prophylaktisch Antibiotika erhalten, die für ihre Gallenkulturen geeignet sind.
Präoperative Pfortaderembolisation
Die präoperative Pfortaderembolisation wurde in den 1980er Jahren zunächst von Makuuchi et al.47 und dann von Kinoshita et al.48 beschrieben. Ziel der Pfortaderembolisation ist es, das verbleibende Lebervolumen in den Fällen zu vergrößern, in denen es in der präoperativen Volumetrie als unzureichend angesehen wird, und so die Wahrscheinlichkeit eines postoperativen Leberversagens zu verringern. In einer kürzlich von Higuchi und Yamamoto49 veröffentlichten Metaanalyse, die 836 Patienten mit PHC mit präoperativer portaler Embolisation einschloss, betrug die Morbidität 1 % und die Mortalität 0,09 %. Das Fortschreiten des Tumors während des Verfahrens, das eine Operation verhinderte, lag bei 19,4 %. Diese Ergebnisse sprechen dafür, dass der Einsatz der Laparoskopie bei PHC bei Patienten mit einem verbleibenden präoperativen Lebervolumen von weniger als 30 % gerechtfertigt ist.
Staging Laparoskopie
Mit den Fortschritten bei der Sensitivität und Spezifität nicht-invasiver bildgebender Verfahren in den letzten Jahren wird die Staging Laparoskopie immer weniger genutzt. Die wichtigsten Kriterien für die Nicht-Resezierbarkeit sind Lymphknotenbefall, Ausdehnung der Gallenwege und Gefäßinvasion. Diese sind bei der Laparoskopie, deren Präzision und Wirksamkeit seit Jahren abnimmt, schwer zu beurteilen. Dies zeigt die jüngste Revision von Rotellar und Pardo,50 bei der die Präzision und die Wirksamkeit 2002 bei 41 % bzw. 72 % lagen, während sie in den 2011 veröffentlichten Studien bei 14 % und 32 % lagen. Dieser Rückgang ist vor allem auf Verbesserungen bei nicht-invasiven Tests wie der MR-Cholangiografie zurückzuführen. Ihre Wirksamkeit erhöht sich, wenn Patienten ausgewählt werden, bei denen ein hohes Risiko für eine peritoneale Streuung oder hepatische Metastasierung besteht, wodurch unnötige Laparotomien vermieden werden.50-52 Nicht-invasive bildgebende Verfahren werden in fortgeschrittenen Stadien (T2/3/4) empfohlen, die möglicherweise eine fortgeschrittene Peritoneal- oder Lymphknotenbeteiligung aufweisen und die vor der Anlage der präoperativen Gallengangsdrainage nicht mit der Echoendoskopie punktiert werden können. Wir führen immer eine Staging-Laparoskopie mit intraoperativer Ultraschalluntersuchung durch, um die Sensitivität für die Lokalisation und den Lymphknotenbefall zu verbessern.53
Chirurgische Behandlung
Die chirurgische Behandlung ist nach wie vor die einzige kurative Behandlung für PHC,3,14 und erreicht eine Überlebensrate von 20-40% nach 5 Jahren (Tabelle 2).10,11 Die chirurgische Resektion muss immer durchgeführt werden, wenn es möglich ist, eine R0-Resektion zu erreichen. Die wichtigsten Faktoren, die sich auf das Überleben nach der Operation auswirken, sind der Befall der Resektionsränder, entweder mikroskopisch (R1) oder makroskopisch (R2), sowie der Lymphknotenbefall (N1 und N2).14,17,44,54 Mehrere Studien haben gezeigt, dass das Überleben steigt, wenn die Resektion erweitert wird, um negative Ränder zu schaffen.3,5,33,45 Die vorgeschlagenen Techniken umfassen erweiterte Hepatektomien mit Resektion des kaudalen Segments, biliäre Resektion, hiläre Lymphadenektomie bis zum Truncus celiacus und Rekonstruktion mit Hepatojejunostomie.
Überleben nach Resektion des PHC entsprechend der veröffentlichten Serien.
| Autoren | Jahr | Fälle | Überleben nach 5 Jahren (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20.2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Überleben nach Leberresektion aufgrund eines perihilären Cholangiokarzinoms.
Nur 2 Jahre Nachbeobachtung.
Die erstmals von Neuhaus et al.32 beschriebene „no-touch technique“ beinhaltet die Blockresektion des Leberhilums ohne Manipulation des Tumors, wodurch sich die Überlebenszeit der Patienten in mehr als 15 % der Fälle auf 5 Jahre erhöht.3,33,34,55 Diese Technik besteht im Wesentlichen aus der Resektion der Pfortader und der rechten Leberarterie, wenn sie sich in der Nähe des Tumors befinden, wodurch ihre Dissektion verhindert wird, wenn dies eine Manipulation des Tumors bedeutet, zusammen mit einer vollständigen Gallengangsresektion mit breiter Lymphadenektomie bis zur Wurzel des Truncus celiacus und einer Rekonstruktion mit Hepaticojejunostomie. Es wird bevorzugt, den rechten Leberlappen zu wählen (die wesentliche „Non-Touch-Technik“ nach Neuhaus),33 unter der Voraussetzung, dass die Tumorausdehnung es ermöglicht, die rechte Leberarterie, die dem Tumor am nächsten liegt, einzubeziehen. Diese Art der radikalen Operation führt zu einer akzeptablen postoperativen Morbidität, die je nach Serie zwischen 50 % und 70 % liegt, und zu einer Mortalität von 10 % bis 20 %.3,5 Die Überlebensrate von PHC-Patienten nach 5 Jahren liegt bei 20% bis 40%, während veröffentlichte Studien, die eine Pfortaderresektion einschließen, und Serien, die die „No-Touch-Technik“ anwenden, 58% nach 5 Jahren erreichen (Abb. 2 und 3).3,5,33
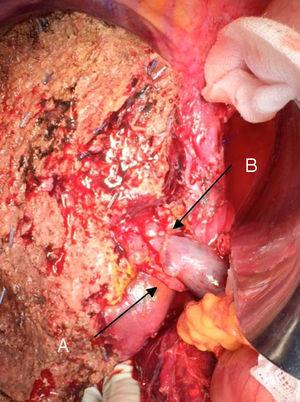
Linke Hepatektomie bei Klatskin-Tumor, mit Resektion der Pfortader: (A) rechte Leberarterie des oberen Mesenteriums; (B) Pfortader.
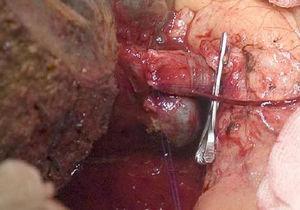
Rechte Hepatektomie mit Rekonstruktion der Pfortader.
Es ist auch wichtig, auf neuere Studien hinzuweisen, die eine Erhöhung des Überlebens von Patienten mit präoperativer Gefäßbeteiligung nach Pfortaderresektion zeigen. Sie erreichen sogar Überlebensraten, die denen von Patienten ohne präoperative Gefäßbeteiligung entsprechen oder höher sind als die von Patienten, bei denen keine Pfortaderresektion durchgeführt wurde.33,56,57 In diesen Studien ist die Inzidenz von hepatischen und vaskulären Komplikationen ähnlich wie in der Gruppe ohne Pfortaderresektion, mit Ausnahme der Patienten, bei denen eine Arterienresektion durchgeführt wurde, da diese eine höhere Morbimortalität aufweisen als die anderen. Aufgrund all dieser Erwägungen wird bei Patienten mit einseitiger Pfortaderbeteiligung oder Beteiligung der Einmündung in den präoperativen Tests eine Operation empfohlen, bei der eine En-bloc-Resektion und eine Gefäßrekonstruktion durchgeführt werden. Eine arterielle Resektion und Rekonstruktion wird nicht empfohlen, es sei denn, die Arterie ist eindeutig betroffen, da dies mit schlechteren postoperativen Ergebnissen verbunden ist, so dass in solchen Fällen die rechte Hepatektomie vorzuziehen ist.
Zusammenfassend sind die zu befolgenden chirurgischen Prinzipien: radikale Chirurgie mit Gallen- und Schwanzresektion und Lymphadenektomie, mit R0-Rändern und ohne Manipulation des Tumors, auch wenn dies die Resektion und Rekonstruktion der Pfortader und Leberarterie einschließt.
Schlussfolgerungen
Zurzeit besteht die einzige kurative Behandlung in der chirurgischen Resektion. Die radikale En-bloc-Resektion und Gefäßrekonstruktion ist die Technik, mit der die höchste Langzeitüberlebensrate erzielt wurde. Um die postoperative Morbidität zu verringern, empfiehlt sich eine biliäre Drainage zur Verhinderung eines Leberversagens mit Antibiotikaprophylaxe nach der Drainage und eine Pfortaderembolisation, wenn das künftige Restlebervolumen weniger als 30 % beträgt. R0-Resektion, Lymphknotenbefall und Fernmetastasierung sind nach wie vor die wichtigsten prognostischen Faktoren.
Interessenkonflikt
Diese Überarbeitung wurde in keiner Zeitschrift oder auf keinem Kongress ganz oder teilweise vorgestellt oder veröffentlicht.