- Introduction
- Methoden
- Mausfibroblasten
- Diagnosen und Medikamente der Patienten
- Experimenteller Aufbau
- Messung der effektiven Refraktärzeit
- Stock Solutions and Drug Application
- Analyse der Aktionspotential-Parameter
- Statistische Analyse
- Ergebnisse
- Auswirkungen von MK-0448 auf Kv1.5-Strom
- Wirkungen von MK-0448 auf Aktionspotentiale
- Diskussion
- Studieneinschränkungen
- Schlussfolgerung
- Erklärung zu Interessenkonflikten
- Danksagung
Introduction
In search of safer antiarrhythmic drugs for the treatment of atrial fibrillation (AF), wurden selektive Inhibitoren von IKur als vorhofselektive Klasse-III-Antiarrhythmika mit therapeutischem Potenzial bei Vorhofflimmern entwickelt. Da sie auf die Kv1.5-Kanäle abzielen, die nur in den Vorhöfen funktionsfähig sind (Mays et al., 1995), wird davon ausgegangen, dass diese Wirkstoffe in den Herzkammern keine proarrhythmischen Wirkungen haben und daher in der wissenschaftlichen Gemeinschaft auf großes Interesse stoßen (für eine Übersicht siehe Ford und Milnes, 2008; Tamargo et al, 2009; Ravens, 2010; Ravens und Wettwer, 2011).
Wir haben zuvor die elektrophysiologischen Wirkungen verschiedener IKur-Inhibitoren untersucht, darunter 4-Aminopyridin, AVE0118, XEN-D0101, die alle die Plateauphase menschlicher rechtsatrialer Aktionspotenziale (APs) erhöhten, die in Trabekeln der Vorhofanhängsel von Patienten im Sinusrhythmus (SR) oder Vorhofflimmern aufgezeichnet wurden (Wettwer et al., 2004; Christ et al., 2008; Ford et al., 2013). Interessanterweise waren die Aktionspotenzialdauer (APD90) und die effektive Refraktärzeit (ERP) in SR-Präparaten verkürzt, in AF-Präparaten jedoch verlängert.
Kürzlich wurden erstmalig Ergebnisse mit einem anderen selektiven Kv1.5-Inhibitor, MK-0448, veröffentlicht (Pavri et al., 2012). MK-0448 hatte keinen Einfluss auf die relative atriale ERP bei gesunden Probanden, und die Autoren kamen zu dem Schluss, dass von einer IKur-Blockade keine therapeutisch nützliche antiarrhythmische Wirkung bei Vorhofflimmern zu erwarten ist. Da nichts über die Wirkungen von MK-0448 in menschlichem Vorhofgewebe ex vivo bekannt ist, untersuchten wir seine Wirkungen auf die Formen der Vorhof-APs und ERP mit Standard-Mikroelektroden-Techniken in Trabekeln, die aus rechten Vorhofanhängseln von Patienten mit SR und Vorhofflimmern isoliert wurden, die sich einer Operation am offenen Herzen unterziehen mussten. In SR-Präparaten erhöhte MK-0448 das Plateaupotenzial und verkürzte APD und ERP bei 1 Hz, wie von IKur-Blockern erwartet. Wir bestätigen auch, dass MK-0448 den Kv1.5-Strom in Mausfibroblasten, die das hKCNA5-Gen stabil exprimieren, wirksam blockiert.
Methoden
Mausfibroblasten
HK2BN9-Zellen, die menschliche Kv1.5-Kanäle exprimieren, wurden freundlicherweise von Dr. Tamkun (Snyders et al., 1993) zur Verfügung gestellt. Die Zellen wurden in modifiziertem Dulbecco-Adler-Medium mit 10 % fetalem Kälberserum und 1 % Penicillin/Streptomycin unter atmosphärischen Bedingungen von 5 % CO2 bei 37 °C kultiviert. 250 μg/ml G418 wurden dem Medium zur Selektion zugesetzt. Die Expression von Kv1.5 wurde durch Behandlung der Zellen mit 1 μM Dexamethason 24 Stunden vor einem Experiment induziert. Die Zellen wurden mit einem Standard-Einzelelektroden-Ganzzell-Voltage-Clamp-Setup untersucht, wie zuvor beschrieben (Radicke et al., 2006). Die Badelösung enthielt (in mM): NaCl 150, KCl 5.4, MgCl2 2, CaCl2 2.0, HEPES 10, Glucose 10, pH 7.4, Temperatur 25°C. Die Elektrodenlösung enthielt (in mM): KCl 40, Kaliumaspartat 80, NaCl 8, CaCl2 2, MgATP 5, EGTA 5, GTP 0,1, HEPES 10, pH 7,4 eingestellt mit KOH. Die Serienwiderstände lagen zwischen 5 und 10 MΩ und wurden um bis zu 85 % kompensiert. Die Zellkapazität wurde mit kleinen hyperpolarisierenden Clamp-Schritten von -40 mV bis -42 mV gemessen; der Durchschnittswert betrug 20,8 ± 1,2 pA/pF (n = 33) und unterschied sich nicht zwischen den mit 0,5 und 3 Hz getesteten Zellen. Die Erzeugung der Spannungsklammerimpulse, die Datenerfassung und die Analyse wurden mit der ISO2-Software (MFK, Niedernhausen, Deutschland) durchgeführt. Die Daten wurden nicht für das Übergangspotential korrigiert, das 11,7 mV betrug, wie mit der JPCalc-Software (P.H. Barry, Sydney, Australien) berechnet.
Diagnosen und Medikamente der Patienten
Atriales Gewebe wurde von Patienten gewonnen, die sich aufgrund einer Koronararterien- oder Klappenerkrankung einer Herzoperation unterzogen. Alle Patienten gaben eine schriftliche Einverständniserklärung ab. Die Studie wurde von der Ethikkommission der Medizinischen Fakultät der Technischen Universität Dresden genehmigt (Nr. EK790799). Die Patienten sind in Tabelle 1 aufgeführt. Die Studie umfasste 13 arzneimittelexponierte und 9 TMC-Präparate von Patienten im Sinusrhythmus (SR-Gruppe), 9 arzneimittelexponierte und 9 TMC-Präparate von Patienten mit permanentem Vorhofflimmern (AF-Gruppe, definiert als permanentes Vorhofflimmern seit ≥6 Monaten zum Zeitpunkt der Gewebeentnahme) und 3 arzneimittelexponierte Präparate von Patienten mit intermittierendem Vorhofflimmern (Episoden spontan beendeten Vorhofflimmerns von wenigen Sekunden bis zu mehreren Stunden Dauer). Die Medikation der Patienten umfasste in der Regel ACE-Hemmer, β-Blocker, Nitrate, Lipidsenker und Diuretika.
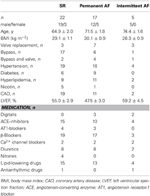
Tabelle 1. Merkmale der Patienten, deren Trabekel für die Arzneimittelexposition verwendet wurden.
Experimenteller Aufbau
Kleine Stücke (50-100 mg Gewicht) menschlicher rechter Vorhofanhängsel wurden in einer speziellen Ca2+-freien Transportlösung bei 20-25°C ins Labor gebracht, Zusammensetzung in mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgSO4, 50 Taurin, 5 MOPS, 30 2,3-Butan-Dion-Monoxim (BDM), pH 7,0. Entweder wurden freilaufende Trabekel (<1 mm im Durchmesser und 2-5 mm in der Länge) oder Trabekel zusammen mit der anhängenden Vorhofwand präpariert und auf dem Boden eines 5 ml Organbades montiert, das mit 50 ml rezirkulierender, sauerstoffangereicherter Tyrode-Lösung mit einer Flussrate von 7 ml/min bei 36 ± 1°C perfundiert wurde (Zusammensetzung in mM: 126.7 NaCl, 0,42 NaH2PO4, 22 NaHCO3, 5,4 KCl, 1,8 CaCl2, 1,5 MgCl2, pH 7,4 bei Äquilibrierung mit 5% CO2 in O2). Die Präparate wurden mit einer Basalrate von 1 Hz mit isolierten Rechteckstimuli von 1 ms Dauer und der zweifachen Schwellenintensität elektrisch stimuliert. Die Transmembranpotenziale wurden mit Glasmikroelektroden aufgezeichnet, die mit 2,5 M KCl gefüllt waren. Die Spitzenwiderstände der Elektroden lagen zwischen 20 und 80 MΩ. Sowohl die zeitliche Steuerung der Antriebsreize als auch die Vorverarbeitung der Transmembranpotenzialantworten erfolgten mit einem computergestützten Aktionspotenzial-Aufzeichnungssystem (Wettwer et al., 2004). Für die Analyse der Aktionspotenzialparameter wurde das Aufzeichnungsprogramm Chart for Windows, Version 7.3.5 (ADInstruments Pty Ltd., Castle Hill, Australien) verwendet.
Jedem Experiment ging eine 60-minütige Äquilibrierungsphase voraus, in der sich die Präparate stabilisieren konnten und restliches BDM vollständig ausgewaschen wurde. Die numerischen Werte der wichtigsten Aktionspotential-Parameter mussten konstant bleiben, d.h. innerhalb eines Bereichs von ±5% für mindestens 10 min. Wenn sich die Mikroelektrode aus der Zelle herausbewegte, wurde an der gleichen Stelle ein neuer Einstich vorgenommen, und der Versuch wurde fortgesetzt, wenn die neue Aufzeichnung nach visueller Beurteilung nicht von der alten abwich und bei der abschließenden numerischen Analyse weniger als 3 % Unterschied ergab.
Messung der effektiven Refraktärzeit
Die effektive Refraktärzeit (ERP) wurde durch einen einzelnen zusätzlichen Stimulus gemessen, der nach Zügen von 10 regulären Stimulationsimpulsen mit einer Grundfrequenz von 1 Hz interpoliert wurde, wobei die Intervalle vom letzten regulären Impuls an in 5 ms-Schritten abnahmen, bis der zusätzliche Stimulus kein Aktionspotential auslöste. Nach einer kurzen Erholungsphase wurde das Präparat für weitere 60 Minuten mit MK-0448 (3 μM) bei 1 Hz exponiert und die ERP wurde erneut in Gegenwart des Medikaments getestet.
Stock Solutions and Drug Application
MK-0448 wurde von Xention Ltd. Cambridge UK. In einigen Experimenten wurde MK-0448 in kumulativ ansteigenden Konzentrationen appliziert, indem Aliquots aus einer 10 mM Stammlösung mit DMSO als Lösungsmittel direkt zu 50 ml des zirkulierenden Bademediums gegeben wurden. Die DMSO-Konzentration überstieg nie 0,2 %, eine Konzentration, die bei alleiniger Anwendung keine signifikante Veränderung bewirkte. Die Präparate wurden jeder Konzentration von MK-0448 für 20 min ausgesetzt.
Analyse der Aktionspotential-Parameter
Die folgenden Standard-Parameter der atrialen APs wurden analysiert: Ruhemembranpotential, RMP (mV), Aktionspotentialamplitude, APA (mV), Aktionspotentialdauer bei 20, 50 und 90% der Repolarisation, APD20, APD50 und APD90 (ms), maximale Depolarisationsrate, dV/dtmax (V/s) und das „Plateaupotential“, definiert als das mittlere absolute Membranpotential (mV) im Zeitfenster zwischen 20 und 30% der APD90 (PLT20). Präparate mit Ruhepotentialen von weniger als -65 mV und Amplituden unter 80 mV wurden verworfen.
Statistische Analyse
GraphPad Prism (Version 4.03) wurde für die statistische Analyse verwendet. In den Konzentrations-Wirkungs-Kurven (siehe Tabelle 2) wurden die bei steigenden Konzentrationen erhaltenen Werte mit den Kontrollen vor der Verabreichung des Medikaments mittels einfaktorieller ANOVA und anschließendem Bonferroni-Mehrfachvergleichstest verglichen. Die einzelnen Aktionspotenzial-Parameter von SR- und permanenten AF-Präparaten in Gegenwart von 3 μM MK-0448 wurden mit gepaarten Student’s t-Tests mit den Kontrollen vor der Behandlung verglichen (siehe Tabelle 3). Unterschiede gelten als statistisch signifikant bei P < 0,05.

Tabelle 2. Konzentrationsabhängige Wirkungen von MK-0448 bei 1, 3 und 10μM (1 Hz).
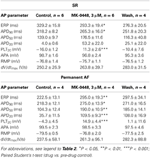
Tabelle 3. Auswirkungen von MK-0448 (3μM) auf Aktionspotenzialparameter und effektive Refraktärzeit (ERP) von menschlichen rechtsatrialen Trabekeln von Patienten mit SR und AF (Stimulationsfrequenz 1 Hz).
Ergebnisse
Auswirkungen von MK-0448 auf Kv1.5-Strom
Kv1.5-Ströme, die während schrittweiser Potentialänderungen von einem Haltepotential von -60 mV zu verschiedenen Testpotentialen zwischen -40 und +80 mV gemessen wurden, hatten ein Schwellenpotential von -30 mV, wurden schnell aktiviert und innerhalb von 500 ms kaum inaktiviert (Daten nicht gezeigt). Für die Medikamententests wählten wir 50 ms lange Voltage-Clamp-Schritte auf +50 mV, die mittlere Stromamplituden von 85,0 ± 10,5 pA/pF bei 0,5 Hz (n = 16) und 110,6 ± 16,9 pA/pF bei 3 Hz (n = 17, P = 0,2133) auslösten. MK-0448 (100 nM) blockierte die Kv1.5-Stromamplitude in einer frequenzabhängigen Weise (Abbildung 1A). Bei 0,5 Hz erreichte die Blockade innerhalb von 5-10 Minuten nach der Medikamentenapplikation einen Steady-State und erholte sich teilweise während einer 5-minütigen Periode, in der die Zelle kontinuierlich bei -60 mV geklemmt wurde (Abbildung 1B). Wenn die Zellen während einer 5-minütigen Periode, die bei -60 mV gehalten wurde, mit MK-0448 exponiert wurden, um die Kanäle im geschlossenen Zustand zu halten, unterschied sich IKv1.5 des ersten Pulses nach der Ruhephase nicht von dem vor der Ruhephase. Nachfolgende Pulse in Anwesenheit des Medikaments zeigten einen schnellen Beginn der Hemmung, die mit jedem Puls bis zum Erreichen des Steady-State zunahm (Abbildung 1C). MK-0448 (100 nM) reduzierte IKv1.5 von 82,3 ± 31,5 pA/pF auf 22,4 ± 6,0 pA/pF (n = 5) innerhalb von 3 Minuten kontinuierlicher Spannungsklemmenschritte bei 0,5 Hz und von 113,8 ± 52,7 pA/pF auf 12,9 ± 2,5 pA/pF bei 3 Hz (n = 4). Diese Ergebnisse stimmen damit überein, dass die Hemmung von Kv1.5 durch MK-0448 von einer Kanalaktivierung abhängt.

Abbildung 1. Auswirkungen von MK-0448 auf Kv1.5-Ströme, gemessen in HK2BN9-Zellen bei 25°C. (A) Spannungsklemmen und Stromkurven vor (schwarz) und nach Superfusion der Zellen mit 100 nM MK-0448 (grün) für 10 min. Rate der Klammerimpulse wie angegeben. (B) Einsetzen der blockierenden Wirkung von MK-0448 (100 nM) auf den Kv1.5-Spitzenstrom und Erholung von der Blockade während 5 Minuten bei einem Haltepotential von -60 mV. Die einzelnen Stromspuren oben wurden zu den Zeitpunkten aufgezeichnet, die im Diagramm unten durch kleine Buchstaben gekennzeichnet sind. (C) Einsetzen der Medikamentenwirkung nach der Exposition während 5 Minuten kontinuierlichen Klemmens bei -60 mV. Schrittfrequenz: 3 Hz.
Wirkungen von MK-0448 auf Aktionspotentiale
Aktionspotentiale, die in rechten Vorhoftrabekeln von Patienten mit SR aufgezeichnet wurden, hatten die typische Spike-and-Dome-Konfiguration (Abbildung 2), in permanentem Vorhofflimmern war die Form dreieckig und ist das Ergebnis eines elektrischen Remodellings. Die auffälligste konzentrationsabhängige Wirkung von MK-0448 (1-10 μM) auf SR-Aktionspotenziale bei der basalen Stimulationsfrequenz von 1 Hz war eine starke Erhöhung des Plateaupotenzials (PLT20) (Abbildung 2; Tabelle 2). In dieser Reihe von Experimenten wurde die APD90 tendenziell verkürzt (nicht signifikant), während APD20 und APD50 verlängert wurden, wobei nur bei der höchsten Konzentration das Niveau der statistischen Signifikanz erreicht wurde (siehe Tabelle 2). Das Ruhemembranpotenzial (RMP), die Aktionspotenzialamplitude (APA) und die maximale Depolarisationsgeschwindigkeit (dV/dtmax) wurden durch MK-0448 nicht signifikant beeinflusst (siehe Tabelle 2). Vor und nach der Medikamentenbehandlung folgten alle Präparate der Stimulation, selbst bei der höchsten Konzentration.
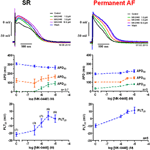
Abbildung 2. Konzentrationsabhängige Wirkungen von MK-0448 auf Aktionspotenziale, die in rechten Vorhoftrabekeln von Patienten im Sinusrhythmus (SR) und bei permanentem Vorhofflimmern (AF) aufgezeichnet wurden. Oben: Einzelne Tracings für typische Experimente, aufgezeichnet in Gegenwart steigender Konzentrationen der Substanz (siehe Farbcode). Expositionszeit bei jeder Konzentration: 20 min; Kontrolle: Kontrolle vor dem Wirkstoff. Mitte und unten: Mittelwerte ± s.e.m. aus 7 Experimenten in SR und 5 in AF, der Aktionspotentialdauer bei 90, 50 und 20% der Repolarisation (APD90, APD50 und APD20) und des Plateaupotentials (PLT20). Frequenz der Stimulation: 1 Hz. Bitte beachten Sie, dass nicht alle Präparate dem gesamten Konzentrationsbereich ausgesetzt waren (Anzahl der Präparate in Klammern).
Die Auswirkungen von MK-0448 auf das ERP wurden nur bei 3 μM untersucht. Diese Konzentration führte zu maximalen Veränderungen innerhalb von 40-50 Minuten nach der Verabreichung des Medikaments, und diese waren nach 60 Minuten Auswaschen teilweise reversibel. Bei 6 Präparaten von Patienten mit SR, APD90 und ERP waren diese signifikant verkürzt (Abbildung 3; Tabelle 3). Ähnliche Effekte wurden bei 2 Präparaten von Patienten mit intermittierendem Vorhofflimmern beobachtet (Abbildung 3).
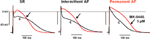
Abbildung 3. Auswirkungen von MK-0448 (3 μM, rote Kurve, Pfeil) auf Aktionspotenziale, die in rechten Vorhoftrabekeln von Patienten mit Sinusrhythmus (SR), intermittierendem Vorhofflimmern (iAF) und chronischem Vorhofflimmern (AF) aufgezeichnet wurden. Gezeigt werden Originalaufzeichnungen von einem Präparat jeder Gruppe. c, Kontrolle vor der Behandlung mit Medikamenten (schwarze Spur). Stimulationsfrequenz 1 Hz.
In permanenten Vorhofflimmern-Trabekeln erhöhte MK-0448 das Plateaupotenzial in ähnlichem Maße wie bei SR, verlängerte aber im Gegensatz zu SR die APD auf den drei analysierten Repolarisationsstufen (Abbildungen 2, 3; Tabelle 3). In Präparaten mit permanentem Vorhofflimmern wurden APA, RMP und dV/dtmax ebenfalls nicht signifikant beeinflusst, mit Ausnahme von RMP mit 10 μM MK-0448.
Aufgrund der begrenzten Verfügbarkeit konnten wir die Wirkungen von MK-0448 nur in 2 Trabekeln von Patienten mit intermittierendem Vorhofflimmern untersuchen, eine typische Aufzeichnung ist in Abbildung 3 dargestellt; 3 weitere wurden als TMCs verwendet. Ähnlich wie die Ergebnisse in SR-Präparaten verkürzte MK-0448 die APD90 und die ERP in den beiden Präparaten mit intermittierendem Vorhofflimmern.
In zeitlich abgestimmten Kontrollexperimenten mit Gewebe von Patienten mit SR, intermittierendem Vorhofflimmern und Vorhofflimmern veränderten sich die Aktionspotenzialparameter nicht signifikant (Daten nicht gezeigt).
Diskussion
Die charakteristischen Veränderungen der Aktionspotential-Parameter, die mit MK-0448 in menschlichen rechtsatrialen Trabekeln beobachtet wurden, stehen im Einklang mit der Blockierung von Kv1.5-Kanälen, wie sie zuvor für verschiedene Medikamente berichtet wurden.
MK-0448 wurde als hoch selektiv für exprimierte Kv1.5-Kanäle gegenüber einer Vielzahl von kardialen Standard-Ionenkanälen. hERG-Kanäle sind etwa 10.000-fach, Einwärtsgleichrichterstrom Kir2.1 und Kir3.1/3.4 etwa 1000-fach und Kv7.1 (IKs) etwa 10- bis 100-fach weniger empfindlich als Kv1.5 (Pavri et al, 2012). Die Voltage-Clamp-Daten in einem heterologen Expressionssystem bestätigen, dass MK-0448 (100 nM) eine robuste Blockade von menschlichem Kv1.5 mit einem eher langsamen Wirkungseintritt und einer teilweisen Erholung von der Blockade bei -60 mV bewirkt. Obwohl unsere Ergebnisse keine genaue Charakterisierung der Wechselwirkung zwischen Medikament und Kanal erlauben, weisen sie eindeutig darauf hin, dass sich ruhende Kanäle von der Blockade erholen und eine Aktivierung für die Entwicklung der Blockade notwendig ist, was auf eine bevorzugte Bindung an offene und/oder inaktivierte Kanäle hindeutet.
In früheren Experimenten haben wir gezeigt, dass niedrige Konzentrationen von 4-Aminopyridin selektiv Iso (IKur) in menschlichen Vorhofmyozyten hemmen (Wettwer et al., 2004). Dieser Blocker erhöhte das Plateaupotenzial in SR-Präparaten (EC50~15 μM). Darüber hinaus verkürzte 4-AP in Konzentrationen, die als selektiv für die IKur-Blockade gelten, die APD90 in SR signifikant, verlängerte jedoch die APD90 in permanenten AF-Trabekeln (Wettwer et al., 2004). Die auffälligsten Wirkungen von MK-0448 auf menschliche Vorhof-APs, d. h., d.h. Erhöhung des Plateaupotentials, Verkürzung der APD90 in SR und Verlängerung der APD20, APD50 und APD90 in permanentem Vorhofflimmern, stimmen mit unseren früheren Ergebnissen mit anderen IKur-Inhibitoren überein, so dass wir zuversichtlich sind, dass MK-0448 tatsächlich IKur in menschlichen Vorhoftrabekeln blockiert.
Im Gegensatz zur Hemmung von hERG-Kanälen war die Hemmung von IKs in Tiermodellen nicht mit einer proarrhythmischen ventrikulären Wirkung verbunden (Lynch et al., 1999). Dennoch könnte die Modulation von IKs durch MK-0448 auch die Repolarisationsreserve im Ventrikel verringern und unter geeigneten Bedingungen in Ventrikeln arrhythmogen wirken (Lynch et al., 1999). Es ist zu beachten, dass es schwierig ist, das ventrikuläre proarrhythmische Risiko eines Medikaments, das die IKs moduliert, bei gesunden Probanden mit normaler ventrikulärer Repolarisationsreserve zu beurteilen. Daher müsste die atriale Selektivität von MK-0448 bei Patienten sorgfältig geprüft werden.
Die Verkürzung der APD90 und der ERP durch Kv1.5-Blocker in SR soll durch die deutliche Anhebung des Plateaupotenzials in einen Spannungsbereich verursacht werden, in dem mehr hERG-Kanäle aktiviert werden, die zwar schnell inaktiviert werden, sich aber bei negativeren Potenzialen von der Inaktivierung erholen und somit die endgültige Repolarisierung beschleunigen können (Gintant, 2000).
Neben ausgeprägten Veränderungen in der Form der Aktionspotentiale ist der Verlust der Ratenanpassung von ERP und APD90 an die Frequenz als ein Kennzeichen des atrialen Remodelings sowohl bei Patienten (z.B., Attuel et al., 1982; Daoud et al., 1996) und in Ex-vivo-Studien (Franz et al., 1997; Dobrev und Ravens, 2003). In unserer vorliegenden Studie und in der kürzlich durchgeführten „First-time-in-human“-Studie mit MK-0448 fanden alle elektrophysiologischen Tests in einem Frequenzbereich statt, der weit unter dem von Vorhofflimmern liegt, und man könnte argumentieren, dass es auf der Grundlage unserer SR-Daten nicht überraschend ist, dass MK-0448 die AERP bei gesunden Probanden nicht verlängert hat (Pavri et al, 2012).
Experimentelle und klinische Belege deuten darauf hin, dass Vorhofflimmern auf Mikro-Reentry zurückzuführen ist, die durch ektopische Herde in der Nähe der Lungenvenen ausgelöst wird (Haissaguerre et al., 1998). Pharmakologische Interventionen zur Unterbrechung der Mikrorückkehr müssen die effektive Refraktärzeit verlängern, während die Unterdrückung der ektopischen Herde eine Verringerung der Erregbarkeit erfordert. Unter der Voraussetzung, dass MK-0448 tatsächlich selektiv IKur blockiert, ist es wahrscheinlicher, dass es die atriale Refraktärität (bei Vorhofflimmern) erhöht als die Erregbarkeit reduziert, obwohl nicht klar ist, wie die deutliche Erhöhung der Plateau-Amplitude mit der Verlängerung der ERP bei Vorhofflimmern zusammenhängt. Es muss jedoch betont werden, dass die Gesamtform des kardialen Aktionspotenzials durch mehrere Ionenleitfähigkeiten bestimmt wird, so dass die Interpretation von Aktionspotenzialdaten nicht schlüssig sein kann, welche Ionenkanäle zu einer bestimmten Veränderung beitragen.
In SR beobachteten wir sogar eine Verkürzung der ERP mit MK-0448, und wir können nicht beurteilen, ob dies eine anti- oder proarrhythmische Wirkung in den Vorhöfen ist. Dies kann nur in einer prospektiven Phase-2-Studie an Vorhofflimmerpatienten geklärt werden. Es ist jedoch erwähnenswert, dass für MK-0448 (Pavri et al., 2012) oder die Verkürzung der AERP bei gesunden Probanden keine Proarrhythmie berichtet wurde. Bei anderen Kv1.5-Inhibitoren, z. B. XEN-D0101, die in der Klinik untersucht wurden, wurde bei gesunden Probanden ebenfalls keine Pro-Arrhythmie (atrial oder ventrikulär) festgestellt (Ford et al., 2013). Genetische Studien ergaben eine Assoziation von „loss-of-function“-Mutationen im KCNA5-Gen, das für Kv1.5 kodiert, mit familiärem „einsamen“ Vorhofflimmern (Olson et al., 2006). In dieser Studie war jedoch die Genotypisierung/Phänotypisierung der Familienmitglieder unvollständig und es gab keine Hinweise auf eine primäre Verknüpfung. Die Wahrscheinlichkeit, dass diese Daten allein durch Zufall beobachtet werden, liegt zwischen 10 und 15 %. In einer kürzlich durchgeführten Studie an mehr als 300 Patienten mit früh einsetzendem alleinigem Vorhofflimmern wurden 3 „gain-of-function“-Mutationen in KCNA5 zusätzlich zu mehreren „loss-of-function“-Mutationen festgestellt, was die Hypothese stützt, dass die Anfälligkeit für Vorhofflimmern durch eine Veränderung der KCNA5-Funktion verstärkt werden kann (Christophersen et al, 2013).
Studieneinschränkungen
Bei einigen menschlichen Vorhofpräparaten bleibt die APD bei längerer Superfusion mit Kochsalzlösungen (typischerweise ~2 h) nicht stabil.- Die Klassifizierung von Patienten in SR und AF ist möglicherweise nicht immer zuverlässig, d. h., Die SR-Gruppe kann Vorhofgewebe von Patienten enthalten, die unerkannte Episoden von paroxysmalem oder kürzlich aufgetretenem Vorhofflimmern hatten.
Schlussfolgerung
Zusammenfassend lässt sich sagen, dass der IKur-Blocker MK-0448 das Aktionspotenzial-Plateau in menschlichen Vorhoftrabekeln konsequent anhebt, unabhängig von den anfänglichen Formen der Kontroll-Aktionspotenziale und davon, ob die Präparate von Patienten mit SR oder permanentem Vorhofflimmern stammen. In SR-Präparaten führte MK-0448 zu einer Verkürzung der APD90 und der ERP, aber in Gewebe mit permanentem Vorhofflimmern wurden mit dem Medikament deutliche APD90- und ERP-verlängernde Effekte beobachtet. Zur Vorbeugung des Wiederauftretens von persistierendem Vorhofflimmern ist die Verlängerung der ERP durch MK-0448 in Vorhofflimmern-Präparaten sicherlich ein höchst wünschenswerter Wirkmechanismus, der das Vorhofmyokard während der Phase des reversen Remodelings nach der Kardioversion schützen kann, auch wenn dies aufgrund der IKs-Modulation mit dem Risiko verbunden sein kann, ventrikuläre Proarrhythmien auszulösen. Es bleibt zu klären, ob selektive IKur-Medikamente (i) bei der Verlängerung der ERP bei höheren Vorhoffrequenzen wirksamer sind, (ii) kürzlich aufgetretenes Vorhofflimmern pharmakologisch umwandeln, (iii) die Vorhofflimmerbelastung bei paroxysmalem Vorhofflimmern verringern und (iv) das Wiederauftreten von persistierendem Vorhofflimmern verhindern.
Erklärung zu Interessenkonflikten
James Milnes und John Ford sind Mitarbeiter von Xention Ltd, John Ford ist Mitbegründer und hält Aktien von Xention Ltd. Ursula Ravens war als Beraterin für Xention tätig. Simone Loose, Judith Mueller, Michael Knaut, Erich Wettwer haben nichts zu veröffentlichen.
Danksagung
Die Autoren bedanken sich für die finanzielle Unterstützung der Europäischen Union (FP7-Gesundheit T2-2010-261057 „EUTRAF“) und Xention Limited. Wir danken allen Patienten und den Herzchirurgen Klaus Matschke und Michael Knaut für ihre unschätzbare Unterstützung und Konstanze Fischer für ihre kompetente technische Hilfe.
Amos, G. J., Wettwer, E., Metzger, F., Li, Q., Himmel, H. M., and Ravens, U. (1996). Unterschiede zwischen Auswärtsströmen menschlicher atrialer und subepikardialer ventrikulärer Myozyten. J. Physiol. 491(Pt 1), 31-50.
Pubmed Abstract | Pubmed Full Text
Attuel, P., Childers, R., Cauchemez, B., Poveda, J., Mugica, J., and Coumel, P. (1982). Versagen der Frequenzanpassung der atrialen Refraktärzeit: ihre Beziehung zur Vulnerabilität. Int. J. Cardiol. 2, 179-197. doi: 10.1016/0167-5273(82)90032-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christ, T., Wettwer, E., Voigt, N., Hala, O., Radicke, S., Matschke, K., et al. (2008). Pathologiespezifische Wirkungen des I(Kur)/I(to)/I(K,ACh)-Blockers AVE0118 auf Ionenkanäle bei chronischem Vorhofflimmern des Menschen. Br. J. Pharmacol. 154, 1619-1630. doi: 10.1038/bjp.2008.209
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christophersen, I. E., Olesen, M. S., Liang, B., Andersen, M. N., Larsen, A. P., Nielsen, J. B., et al. (2013). Genetische Variation in KCNA5: Auswirkungen auf den vorhofspezifischen Kaliumstrom IKur bei Patienten mit alleinigem Vorhofflimmern. Eur. Heart J. 34, 1517-1525. doi: 10.1093/eurheartj/ehs442
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Daoud, E. G., Bogun, F., Goyal, R., Harvey, M., Man, K. C., Strickberger, S. A., et al. (1996). Auswirkung von Vorhofflimmern auf die atriale Refraktärität beim Menschen. Circulation 94, 1600-1606. doi: 10.1161/01.CIR.94.7.1600
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dobrev, D., und Ravens, U. (2003). Remodeling von Kardiomyozyten-Ionenkanälen bei menschlichem Vorhofflimmern. Basic Res. Cardiol. 98, 137-148. doi: 10.1007/s00395-003-0409-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J., Milnes, J., Wettwer, E., Christ, T., Rogers, M., Sutton, K., et al. (2013). Elektrophysiologische und pharmakologische Eigenschaften von XEN-D0101 am Menschen: ein neuartiger selektiver Kv1.5/IKur-Inhibitor am Vorhof. J. Cardiovasc. Pharmacol. 61, 408-415. doi: 10.1097/FJC.0b013e31828780eb
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J. W., and Milnes, J. T. (2008). Neue Medikamente, die auf den ultraschnellen verzögerten Gleichrichterstrom des Herzens (I Kur) abzielen: Begründung, Pharmakologie und Hinweise auf einen möglichen therapeutischen Wert. J. Cardiovasc. Pharmacol. 52, 105-120. doi: 10.1097/FJC.0b013e3181719b0c
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franz, M. R., Karasik, P. L., Li, C., Moubarak, J., und Chavez, M. (1997). Elektrisches Remodeling des menschlichen Vorhofs: ähnliche Effekte bei Patienten mit chronischem Vorhofflimmern und Vorhofflattern. J. Am. Coll. Cardiol. 30, 1785-1792. doi: 10.1016/S0735-1097(97)00385-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gintant, G. A. (2000). Charakterisierung und funktionelle Konsequenzen des verzögerten Gleichrichterstroms bei der ventrikulären Repolarisation. Am. J. Physiol. Heart Circ. Physiol. 278, H806-H817.
Pubmed Abstract | Pubmed Full Text
Haissaguerre, M., Jais, P., Shah, D. C., Takahashi, A., Hocini, M., Quiniou, G., et al. (1998). Spontane Auslösung von Vorhofflimmern durch ektopische Schläge, die von den Lungenvenen ausgehen. N. Engl. J. Med. 339, 659-666. doi: 10.1056/NEJM199809033391003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lynch, J. J. Jr., Houle, M. S., Stump, G. L., Wallace, A. A., Gilberto, D. B., Jahansouz, H., et al. (1999). Antiarrhythmische Wirksamkeit der selektiven Blockade des langsam aktivierenden verzögerten Gleichrichterstroms des Herzens, I(Ks), in Hundemodellen maligner ischämischer ventrikulärer Arrhythmie. Circulation 100, 1917-1922. doi: 10.1161/01.CIR.100.18.1917
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mays, D. J., Foose, J. M., Philipson, L. H., und Tamkun, M. M. (1995). Lokalisierung des Kv1.5 K+ Kanalproteins in explantiertem Herzgewebe. J. Clin. Invest. 96, 282-292. doi: 10.1172/JCI118032
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Olson, T. M., Alekseev, A. E., Liu, X. K., Park, S., Zingman, L. V., Bienengraeber, M., et al. (2006). Kv1.5-Kanalopathie aufgrund einer KCNA5-Funktionsverlustmutation verursacht menschliches Vorhofflimmern. Hum. Mol. Genet. 15, 2185-2191. doi: 10.1093/hmg/ddl143
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pavri, B. B., Greenberg, H. E., Kraft, W. K., Lazarus, N., Lynch, J. J., Salata, J. J., et al. (2012). MK-0448, ein spezifischer Kv1.5-Inhibitor: Sicherheit, Pharmakokinetik und pharmakodynamische Elektrophysiologie in experimentellen Tiermodellen und beim Menschen. Circ. Arrhythm. Electrophysiol. 5, 1193-1201. doi: 10.1161/CIRCEP.111.969782
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Radicke, S., Cotella, D., Graf, E. M., Banse, U., Jost, N., Varro, A., et al. (2006). Funktionelle Modulation des transienten Auswärtsstroms Ito durch KCNE Beta-Untereinheiten und regionale Verteilung in menschlichen Herzen ohne und mit Herzinsuffizienz. Cardiovasc. Res, 71, 695-703. doi: 10.1016/j.cardiores.2006.06.017
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U. (2010). Antiarrhythmische Therapie bei Vorhofflimmern. Pharmacol. Ther. 128, 129-145. doi: 10.1016/j.pharmthera.2010.06.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U., and Wettwer, E. (2011). Ultra-rapid delayed rectifier channels: molecular basis and therapeutic implications. Cardiovasc. Res. 89, 776-785. doi: 10.1093/cvr/cvq398
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Regan, C. P., Wallace, A. A., Cresswell, H. K., Atkins, C. L., and Lynch, J. J. Jr. (2006). In vivo kardiale elektrophysiologische Effekte eines neuartigen Diphenylphosphinoxid-IKur-Blockers, (2-Isopropyl-5-methylcyclohexyl)-Diphenylphosphinoxid, bei Ratten und nichtmenschlichen Primaten. J. Pharmacol. Exp. Ther. 316, 727-732. doi: 10.1124/jpet.105.094839
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Snyders, D. J., Tamkun, M. M., and Bennett, P. B. (1993). Ein schnell aktivierender und langsam inaktivierender Kaliumkanal, kloniert aus dem menschlichen Herzen. Funktionelle Analyse nach stabiler Säugetierzellkultur-Expression. J. Gen. Physiol. 101, 513-543. doi: 10.1085/jgp.101.4.513
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tamargo, J., Caballero, R., Gomez, R., and Delpon, E. (2009). I(Kur)/Kv1.5-Kanalblocker für die Behandlung von Vorhofflimmern. Expert Opin. Investig. Drugs 18, 399-416. doi: 10.1517/13543780902762850
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, Z., Fermini, B., and Nattel, S. (1993). Sustained depolarization-induced outward current in human atrial myocytes. Nachweis eines neuen verzögerten Gleichrichter-K+-Stroms, der den klonierten Kv1.5-Kanalströmen ähnelt. Circ. Res. 73, 1061-1076. doi: 10.1161/01.RES.73.6.1061
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wettwer, E., Hala, O., Christ, T., Heubach, J. F., Dobrev, D., Knaut, M., et al. (2004). Die Rolle von IKur bei der Kontrolle von Aktionspotentialform und Kontraktilität im menschlichen Vorhof: Einfluss von chronischem Vorhofflimmern. Circulation 110, 2299-2306. doi: 10.1161/01.CIR.0000145155.60288.71
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text