Von Alyssa Cecchetelli und Lukas Morgan
Modellorganismen sind wichtige Hilfsmittel für Forscher auf der ganzen Welt. Diese Organismen haben viele Gene mit dem Menschen gemeinsam, lassen sich leicht im Labor halten und haben kurze Generationszeiten, so dass sich die Auswirkungen genetischer Manipulationen leicht untersuchen lassen. In diesem Blogbeitrag stellen wir fünf beliebte Modellorganismen vor, aber es gibt noch viele mehr.
Die Hausmaus (Mus musculus)
 Beginnen wir mit dem von vielen Forschern bevorzugten Säugetiermodellorganismus: der Maus (Mus musculus). Mäuse haben viele Vorteile als Säugetiermodellorganismus für Wissenschaftler, da sie eine für Säugetiere relativ kurze Generationszeit – die Zeit zwischen Geburt und Geburt – von etwa 10 Wochen haben. Ausgewachsene Mäuse pflanzen sich alle drei Wochen fort, so dass Wissenschaftler gleichzeitig mehrere Generationen von Mäusen beobachten können.
Beginnen wir mit dem von vielen Forschern bevorzugten Säugetiermodellorganismus: der Maus (Mus musculus). Mäuse haben viele Vorteile als Säugetiermodellorganismus für Wissenschaftler, da sie eine für Säugetiere relativ kurze Generationszeit – die Zeit zwischen Geburt und Geburt – von etwa 10 Wochen haben. Ausgewachsene Mäuse pflanzen sich alle drei Wochen fort, so dass Wissenschaftler gleichzeitig mehrere Generationen von Mäusen beobachten können.
Da Mäuse dem Menschen genetisch und physiologisch ähnlicher sind als viele andere Modellorganismen, werden sie häufig zur Untersuchung menschlicher Krankheiten verwendet. Krankheiten bei Mäusen zeigen viele ähnliche Phänotypen wie menschliche Krankheiten und haben den Forschern bei der Entwicklung einer Vielzahl von Therapien geholfen. So verwenden viele Wissenschaftler Mäuse zur Untersuchung von Krankheiten wie Krebs, da Mäuse die komplexen Wechselwirkungen zwischen Krebszellen, therapeutischen Medikamenten und dem übrigen Körper besser wiedergeben als andere Modellorganismen oder Zellkulturen. Das Labor von Scott Lowe beispielsweise untersuchte an Mäusen, wie sich verschiedene Mutationen bei Leukämie auf unterschiedliche Behandlungsmethoden auswirken (Zuber et al., 2009). Durch die Injektion von Mäusen mit retroviralen Vektoren, die verschiedene bei Leukämie vorkommende Mutationen enthielten, konnte das Lowe-Labor eine Reihe von Mutationen identifizieren, die Krebszellen resistenter gegen Chemotherapie machten. Diese Plasmide finden Sie bei Addgene.
Ein weiterer Vorteil von Mäusen als Modellorganismen besteht darin, dass sie genetisch vertretbar sind. Mäuse können mit Werkzeugen wie CRISPR leicht manipuliert werden, um transgene Linien zu erzeugen.
Die Fruchtfliege (Drosophila melanogaster)
 Ein weiterer beliebter Modellorganismus ist Drosophila melanogaster, oder, wie sie besser bekannt ist: die Fruchtfliege. Die Fruchtfliege wird seit über einem Jahrhundert in der wissenschaftlichen Forschung verwendet, wurde aber erst durch Thomas Hunt Morgan, der als „Vater“ der Drosophila-Forschung bekannt ist, in den Vordergrund gerückt. Morgan entdeckte anhand der Fruchtfliege, dass Gene in den Chromosomen zu finden sind, lange bevor wir überhaupt wussten, dass DNA genetisches Material ist (Jennings, 2011).
Ein weiterer beliebter Modellorganismus ist Drosophila melanogaster, oder, wie sie besser bekannt ist: die Fruchtfliege. Die Fruchtfliege wird seit über einem Jahrhundert in der wissenschaftlichen Forschung verwendet, wurde aber erst durch Thomas Hunt Morgan, der als „Vater“ der Drosophila-Forschung bekannt ist, in den Vordergrund gerückt. Morgan entdeckte anhand der Fruchtfliege, dass Gene in den Chromosomen zu finden sind, lange bevor wir überhaupt wussten, dass DNA genetisches Material ist (Jennings, 2011).
Die Fruchtfliege ist ein hervorragender Modellorganismus, da sie einfach und kostengünstig im Labor zu züchten und zu pflegen ist, einen kurzen Lebenszyklus von 8 bis 14 Tagen hat und eine große Anzahl von Nachkommen produziert, die außerhalb des Körpers abgelegt werden. Fruchtfliegen lassen sich auch relativ einfach genetisch manipulieren. Wissenschaftler können eine neue Fliegenlinie in nur 6 Wochen herstellen, während die Herstellung einer transgenen Mauslinie Monate dauert. Im Laufe der Jahre hat sich die Fliege zu einem idealen Modellorganismus für die Untersuchung einer Reihe von Themen wie Entwicklung, Genetik und Nervensystem entwickelt. Die Fliege hat sich auch als wichtiges Krankheitsmodell für den Menschen erwiesen, das Potenzial für die Entdeckung von therapeutischen Arzneimitteln hat, da schätzungsweise 75 % der krankheitsverursachenden Gene beim Menschen ein funktionelles Homolog in der Fliege haben (Pandey und Nichols, 2011).
Ein großer Vorteil der Fruchtfliege ist die Vielzahl genetischer Werkzeuge, wie das GAL4/UAS- und LexA-System, mit denen Wissenschaftler das Niveau und die räumlich-zeitliche Expression eines Gens von Interesse leicht kontrollieren können. Diese Art der Kontrolle der Genexpression ist in anderen Modellsystemen möglich, kann aber recht schwierig und zeitaufwendig sein. GAL4/UAS wurde erstmals 1993 im Labor von Norbert Perrimon beschrieben und seither kontinuierlich weiterentwickelt. Wenn Sie sich für diese Systeme interessieren, besuchen Sie das Labor von Gerald Rubin, der eine Reihe modularer Vektoren entwickelt hat, mit denen sich die Genexpression in bestimmten Zellen der Fliege optimal steuern lässt (Pfeiffer et al., 2010).
Hefe (Saccharomyces cerevisiae)
 Die Hefe, einer der einfachsten eukaryotischen Organismen, ist ein häufig verwendeter Modellorganismus in der wissenschaftlichen Forschung. Ja, die gleiche Art, die wir in Brot und anderen Backwaren verwenden! Hefe ist billig, einfach und leicht zu bearbeiten, da sie unter einer Vielzahl von Umweltbedingungen überleben kann und sich alle 2 Stunden verdoppelt. Hefe ist auch das erste eukaryotische Genom, das vollständig sequenziert wurde und sich sehr gut für genetische Manipulationen eignet.
Die Hefe, einer der einfachsten eukaryotischen Organismen, ist ein häufig verwendeter Modellorganismus in der wissenschaftlichen Forschung. Ja, die gleiche Art, die wir in Brot und anderen Backwaren verwenden! Hefe ist billig, einfach und leicht zu bearbeiten, da sie unter einer Vielzahl von Umweltbedingungen überleben kann und sich alle 2 Stunden verdoppelt. Hefe ist auch das erste eukaryotische Genom, das vollständig sequenziert wurde und sich sehr gut für genetische Manipulationen eignet.
Hefezellen sind nicht nur aus den oben genannten Gründen ein großartiger Modellorganismus, sondern auch, weil sie tatsächlich viele biologische Eigenschaften und Prozesse mit unseren eigenen Zellen teilen. Wie menschliche Zellen ist die Hefe-DNA in Chromosomen verpackt, und etwa 23 % der Hefegene haben ein Gegenstück beim Menschen (Liu et al., 2017). Daher kann Hefe verwendet werden, um die molekularen Grundlagen menschlicher Krankheiten zu untersuchen, die durch ein bestimmtes Gen verursacht werden. Zum Beispiel haben mehrere Gene, die bei menschlichen Krebserkrankungen mutiert sind, ein Homolog, das an der Zellteilung in Hefe beteiligt ist (Pray, 2008). Wissenschaftliche Entdeckungen in Hefe können dann in anderen Modellorganismen weiter untersucht werden, die In-vivo-Bedingungen, die denen des Menschen ähneln, besser nachbilden.
Aufgrund ihrer Einfachheit ist Hefe beispielsweise ein wichtiges Versuchsmodell für die Untersuchung neurologischer Krankheiten wie der Parkinson-Krankheit (PD) geworden. Morbus Parkinson ist in erster Linie durch eine Fehlfaltung von Proteinen gekennzeichnet, die zu einer Ansammlung von Proteinaggregaten, den so genannten „Lewy Bodies“, im Gehirn führt. Hefemodelle der Parkinson-Krankheit, bei denen das toxische Protein α-Synuclein (das häufigste Protein in den Lewy Bodies) überexprimiert wird, sind von unschätzbarem Wert für das Verständnis der grundlegenden molekularen Mechanismen der Krankheit (Menezes et al., 2015). Da es sich bei Hefe um einen einzelligen Organismus handelt, kann man mit ihnen auch leicht mehrere therapeutische Verbindungen in einem Versuch untersuchen.
Zebrafisch (Danio rerio)
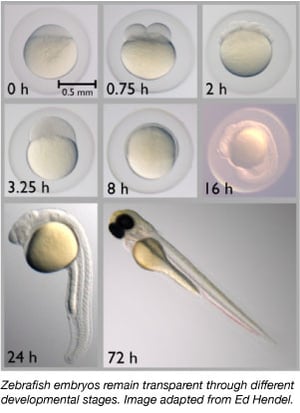 Seit den 1960er Jahren ist der Zebrafisch allmählich zu einem wichtigen Modellorganismus geworden. Sie teilen etwa 70 % ihrer Gene mit dem Menschen und 85 % der menschlichen Gene, die mit einer Krankheit in Verbindung gebracht werden, haben ein Homolog im Zebrafisch (Howe et al., 2013). Zebrafische sind klein, leicht zu halten, da sie in großen Gruppen gehalten werden, leicht zu züchten sind und 50-300 Eier auf einmal produzieren. Zebrafisch-Embryonen werden auch extern gelegt und befruchtet, so dass Wissenschaftler sie leicht manipulieren können. Wissenschaftler können den einzelligen Embryonen einfach DNA oder RNA injizieren, um ihr Genom zu verändern oder transgene Tiere zu erzeugen.
Seit den 1960er Jahren ist der Zebrafisch allmählich zu einem wichtigen Modellorganismus geworden. Sie teilen etwa 70 % ihrer Gene mit dem Menschen und 85 % der menschlichen Gene, die mit einer Krankheit in Verbindung gebracht werden, haben ein Homolog im Zebrafisch (Howe et al., 2013). Zebrafische sind klein, leicht zu halten, da sie in großen Gruppen gehalten werden, leicht zu züchten sind und 50-300 Eier auf einmal produzieren. Zebrafisch-Embryonen werden auch extern gelegt und befruchtet, so dass Wissenschaftler sie leicht manipulieren können. Wissenschaftler können den einzelligen Embryonen einfach DNA oder RNA injizieren, um ihr Genom zu verändern oder transgene Tiere zu erzeugen.
Zebrafische sind ein idealer Modellorganismus für Studien zur Embryonalentwicklung, da ihre Embryonen völlig transparent sind. So können Wissenschaftler frühe Entwicklungsstadien leicht beobachten, was bei anderen Wirbeltierarten schwierig sein kann. Die Transparenz ermöglicht es den Wissenschaftlern auch, fluoreszenzmarkierte Proteine und Gewebe zu beobachten, um Entwicklungsprozesse besser beurteilen zu können.
Das Stainier-Labor untersuchte beispielsweise die Vermehrung und Differenzierung von β-Zellen in der sich entwickelnden Bauchspeicheldrüse des Zebrafisches. Sie markierten diese Zellen zunächst mit Plasmiden. Mit Hilfe von HOTcre, einer Methode, bei der die zeitliche Expression verschiedener Transgene durch Hitzeeinwirkung gesteuert wird, stellte die Stainer-Gruppe dann fest, dass es tatsächlich zwei verschiedene Populationen von β-Zellen gibt, die aus verschiedenen Regionen der Bauchspeicheldrüse stammen und unterschiedliche Mengen an Insulin produzieren (Hesselson et al., 2009).
Der Wurm (Caenorhabditis elegans)
 Der Wurm, Caenorhabditis elegans, wird seit den 1970er Jahren ausgiebig als Modellorganismus verwendet, als Sydney Brenner ihn ins Labor brachte, um die neuronale Entwicklung zu untersuchen (Brenner, 1973). C. elegans sind kleine, durchsichtige Würmer, die einen raschen Lebenszyklus und eine große Brutgröße haben. Die meisten C. elegans sind außerdem selbstfruchtbare Hermaphroditen, was die Durchführung umfangreicher Experimente über mehrere Generationen hinweg erleichtert. Ähnlich wie bei anderen Modellorganismen ist auch das Genom von C. elegans vollständig sequenziert, und mehr als 60 % der menschlichen Gene haben ein Ortholog in C. elegans, was sie ideal für die Untersuchung grundlegender molekularbiologischer Prozesse macht.
Der Wurm, Caenorhabditis elegans, wird seit den 1970er Jahren ausgiebig als Modellorganismus verwendet, als Sydney Brenner ihn ins Labor brachte, um die neuronale Entwicklung zu untersuchen (Brenner, 1973). C. elegans sind kleine, durchsichtige Würmer, die einen raschen Lebenszyklus und eine große Brutgröße haben. Die meisten C. elegans sind außerdem selbstfruchtbare Hermaphroditen, was die Durchführung umfangreicher Experimente über mehrere Generationen hinweg erleichtert. Ähnlich wie bei anderen Modellorganismen ist auch das Genom von C. elegans vollständig sequenziert, und mehr als 60 % der menschlichen Gene haben ein Ortholog in C. elegans, was sie ideal für die Untersuchung grundlegender molekularbiologischer Prozesse macht.
C. elegans lassen sich auch sehr gut genetisch manipulieren. Transgene Tiere können durch einfache Mikroinjektion von DNA in den Wurm hergestellt werden, z. B. Tiere, die Fluoreszenzmarker exprimieren (Mello et al., 1991). Gene können auch leicht durch RNA-Interferenz (RNAi) ausgeschaltet werden, indem man den Wurm mit Bakterien füttert, die spezifische Plasmide (L4440) exprimieren, die das gewünschte Gen enthalten (Fire et al., 1998). Für die Entdeckung von RNAi im Wurm erhielten die Forscher Andrew Fire und Craig Mello 2006 den Nobelpreis.
Einer der größten Vorteile von C. elegans ist, dass sie während ihres gesamten Lebens transparent sind. So kann jede genetische Veränderung, wie die Expression eines fluoreszierenden Proteins oder die Unterbrechung eines Gens, in einem lebenden Organismus von der Embryonalentwicklung bis zum Erwachsenenalter leicht sichtbar gemacht werden. Diese Fähigkeit, Zellen und Gewebe genetisch zu manipulieren und sichtbar zu machen, ermöglicht es Wissenschaftlern, In-vivo-Studien durchzuführen, was bei anderen Modellorganismen recht schwierig sein kann. Würmer wurden zur Untersuchung einer Reihe von biologischen Systemen und Prozessen eingesetzt, darunter das Nervensystem, die Entwicklung, die Zellsignalübertragung, die Alterung und die Mechanotransduktion, um nur einige zu nennen. Das Labor von Andrew Leifer nutzte den Wurm beispielsweise zur Untersuchung der Kalzium-Signalübertragung im gesamten erwachsenen Gehirn unter Verwendung eines Plasmids, das einen genetisch kodierten Kalzium-Sensor, GCaMP6, exprimiert (Nguyen et al., 2015). Wenn Sie sich für C. elegans-Plasmide und -Ressourcen interessieren, besuchen Sie die Seite Worm Expression von Addgene.
Suchen Sie nach weiteren Modellorganismen? Schauen Sie sich Teil zwei der beliebten Serie über Modellorganismen an, und lesen Sie über neue Systeme, die für neue Modellorganismen entwickelt werden!
Brenner, Sydney. „The genetics of Caenorhabditis elegans.“ Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. „Distinct populations of quiescent and proliferative pancreatic β-cells identified by HOTcre mediated labeling.“ Proceedings of the National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. „The zebrafish reference genome sequence and its relationship to the human genome.“ Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. „Drosophila-a versatile model in biology & medicine.“ Materialien heute 14.5 (2011): 190-195.
Mello, Craig C., et al. „Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences.“ The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. „Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans.“ Proceedings of the National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan, und Charles D. Nichols. „Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery.“ Pharmacological Reviews 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.