Atome und Gold
Im Jahr 1911 starteten Rutherford und seine Mitarbeiter Hans Geiger und Ernest Marsden eine Reihe von bahnbrechenden Experimenten, die das anerkannte Modell des Atoms völlig verändern sollten. Sie beschossen sehr dünne Goldfolien mit sich schnell bewegenden Alphateilchen.

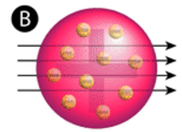

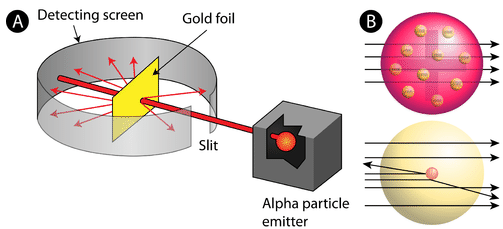
Abbildung \(\PageIndex{2}\) (A) Der Versuchsaufbau für Rutherfords Goldfolienexperiment: Ein radioaktives Element, das Alphateilchen aussandte, wurde auf eine dünne Goldfolie gerichtet, die von einem Schirm umgeben war, der den Nachweis der abgelenkten Teilchen ermöglichte. (B) Nach dem Plum-Pudding-Modell (oben) hätten alle Alphateilchen die Goldfolie mit geringer oder gar keiner Ablenkung durchdringen müssen. Rutherford stellte fest, dass ein kleiner Prozentsatz der Alphateilchen in großen Winkeln abgelenkt wurde, was durch ein Atom mit einem sehr kleinen, dichten, positiv geladenen Kern in seinem Zentrum erklärt werden konnte (unten).
Nach dem akzeptierten Atommodell, in dem Masse und Ladung eines Atoms gleichmäßig über das ganze Atom verteilt sind, erwarteten die Wissenschaftler, dass alle Alphateilchen die Goldfolie mit nur geringer oder gar keiner Ablenkung durchdringen würden. Überraschenderweise, wie in Abbildung \(\PageIndex{2}\) gezeigt, wurden zwar die meisten Alphateilchen tatsächlich nicht abgelenkt, aber ein sehr kleiner Prozentsatz (etwa 1 von 8000 Teilchen) prallte in sehr großen Winkeln von der Goldfolie ab. Einige wurden sogar zur Quelle zurückgelenkt. Auf diese Entdeckung waren sie durch keinerlei Vorwissen vorbereitet. In einem berühmten Zitat sagte Rutherford, es sei, „als hätte man eine 15-Zoll-Granate auf ein Stück Gewebe abgefeuert, das zurückkam und einen traf“
Rutherford musste ein völlig neues Modell des Atoms entwickeln, um seine Ergebnisse zu erklären. Da die überwiegende Mehrheit der Alphateilchen das Gold durchquert hatte, schlussfolgerte er, dass der größte Teil des Atoms leerer Raum war. Die Teilchen, die stark abgelenkt wurden, müssen dagegen innerhalb des Atoms eine ungeheuer starke Kraft erfahren haben. Er schloss daraus, dass die gesamte positive Ladung und der Großteil der Masse des Atoms in einem sehr kleinen Raum im Inneren des Atoms konzentriert sein müssen, den er als Kern bezeichnete. Der Kern ist der winzige, dichte, zentrale Kern des Atoms und besteht aus Protonen und Neutronen.
Rutherfords Atommodell wurde als Kernmodell bekannt. Im Kernatom befinden sich die Protonen und Neutronen, die fast die gesamte Masse des Atoms ausmachen, im Kern in der Mitte des Atoms. Die Elektronen sind um den Kern herum verteilt und nehmen den größten Teil des Volumens des Atoms ein. Es ist wichtig zu betonen, wie klein der Kern im Vergleich zum Rest des Atoms ist. Wenn man ein Atom auf die Größe eines großen Fußballstadions aufblasen könnte, wäre der Kern etwa so groß wie eine Murmel.
Rutherfords Modell erwies sich als wichtiger Schritt zum vollständigen Verständnis des Atoms. Allerdings ging es nicht vollständig auf die Natur der Elektronen und die Art und Weise ein, wie sie den riesigen Raum um den Kern herum besetzten. Für diese und andere Erkenntnisse wurde Rutherford 1908 mit dem Nobelpreis für Chemie ausgezeichnet. Leider hätte Rutherford lieber den Nobelpreis für Physik erhalten, denn er hielt die Physik für der Chemie überlegen. Seiner Meinung nach ist „alle Wissenschaft entweder Physik oder Briefmarkensammeln“.