Kemi hjælper os med at forstå egenskaberne og sammensætningen af verden omkring os. Her lærer du om stoftilstandene og en masse om en bestemt tilstand (tre gæt – den er hverken fast eller flydende…).
Materiens stoftilstande
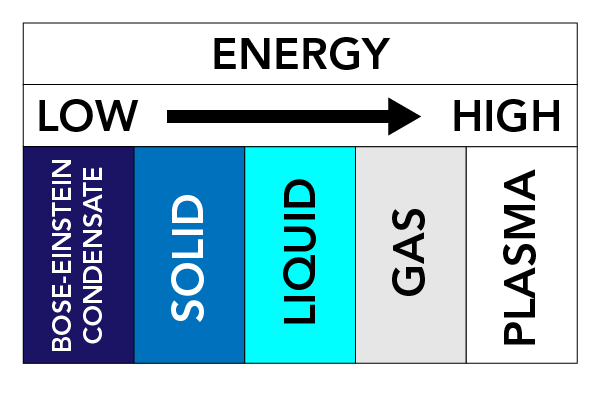
Afhængigt af temperatur, tryk og et stofs egenskaber kan et stof antage forskellige fysiske former. Vi kalder disse fysiske former for stoftilstande. Der findes tre meget velkendte stoftilstande: Faste stoffer, flydende stoffer og gasser. Der findes også andre stoftilstande. Disse omfatter plasma (en stoftilstand, der ligner en gas, men som indeholder frit bevægelige elektroner og ioner – atomer, der har mistet elektroner) og Bose-Einstein-kondensater (BEC’er) (bølger af stof, der kan forekomme med nogle typer af atomer ved superkolde temperaturer).
Kræfterne mellem partikler og trykket på partikler holder partiklerne sammen. Hvis vi varmer stoffet op (tilføjer energi), begynder partiklerne at bevæge sig hurtigere og har tendens til at sprede sig fra hinanden. Denne bevægelse af partikler har stor betydning for et stofs tilstand.
Feststoffer
I faste stoffer er de kræfter, der holder partiklerne sammen, relativt stærke, og partiklerne holder sig meget tæt på hinanden. Partiklerne kan vibrere, men de bevæger sig ikke meget rundt. Det er derfor, at faste stoffer er hårde og stive. Overladt til sig selv vil faste stoffer holde deres form.
Væsker
I væsker er kræfterne mellem partiklerne svagere end i faste stoffer. Partiklerne er stadig ret tæt på hinanden, men kan bevæge sig frit rundt. Væsker kan flyde rundt inde i en beholder og har ikke nogen bestemt fast form.
Gasser
Gasser er svære at forholde sig til, fordi de ofte er usynlige, men findes overalt. Man kan mærke dem, når f.eks. vinden blæser. Du kan nogle gange lugte dem, når du f.eks. kan lugte lugten af mad, der er ved at blive tilberedt, eller når et stinkdyr har været oppe at køre. Nogle gasser er vigtige for vores helbred (f.eks. ilt), mens andre kan være livsfarlige (f.eks. svovlbrinte og klor). Før en operation kan du få en bedøvende gas, som indeholder kemikalier, for at lindre smerter og gøre dig bevidstløs under indgrebet. Gasser er også ansvarlige for kraften i eksplosioner. Lad os se nærmere på gasser.
Typer af gasser
Der findes elementargasser (bestående af et enkelt grundstof) og gasser, der er forbindelser (bestående af mere end ét grundstof). Symbolerne for de elementære gasser kan findes i et hvilket som helst periodisk system over grundstofferne. De er opsummeret i nedenstående skema.
Diatomar gas |
Kemisk formel |
Monatomar gas |
Kemisk formel |
Hydrogen |
H2 |
Helium |
He |
|
Syren |
Oxygen |
O2 |
Neon |
Ne |
|
Sitrogen |
N2 |
Argon |
Ar |
Fluorin |
F2 |
Krypton |
Kr |
|
Klor |
Cl2 |
Xenon |
Xe |
En toatomig gas er en gas, hvor grundenheden er et molekyle, der består af to atomer, der er forbundet med hinanden. En monatomar gas er en gas, hvor grundenheden er et enkelt atom. De fleste gasser er imidlertid forbindelser, hvor to eller flere forskellige grundstoffer er kemisk forenet. Den mest almindelige er vanddamp, H2O. Her er navne, formler og anvendelsesmuligheder for nogle sammensatte gasser:
|
|
Kemisk formel |
Hvor du normalt finder det |
|
Koldioxid |
CO2 |
Atmosfære, biludstødning, pop, vores lunger |
|
Propan |
C3H8 |
BBQ’er, campingkomfurer, brændstof til visse køretøjer |
|
Methan |
CH4 |
Komponent i drivhus gas og naturgas |
|
Ammoniak |
NH3 |
Anvendes til fremstilling af gødning, rengøringsmidler |