Det er nødvendigt at kende nogle grundlæggende egenskaber ved den givne forbindelse og dens Lewisstruktur for at forstå dens molekylære geometri, polaritet og andre sådanne egenskaber. SF4 er en kemisk formel for svovltetrafluorid. Det er en farveløs ætsende gas, der anvendes i syntesen af flere organofluorforbindelser. SF4 er en ret farlig forbindelse, men anvendes i vid udstrækning i kemiske og farmaceutiske virksomheder.
| Navn på molekylet | Svovltetraflourid ( SF4) |
| Antal af valenselektroner i molekylet | 34 |
| Hybridisering af SF4 | sp3 hybridisering |
| Bindingsvinkler | 102 grader og 173 grader |
| Molekylær geometri af SF4 | Trigonal bipyramidal |
For at forstå dette molekyls egenskaber, såsom dets reaktivitet, polaritet og meget mere, skal man først kende SF4 Lewis-strukturen.
Indhold
SF4 Molekylær geometri
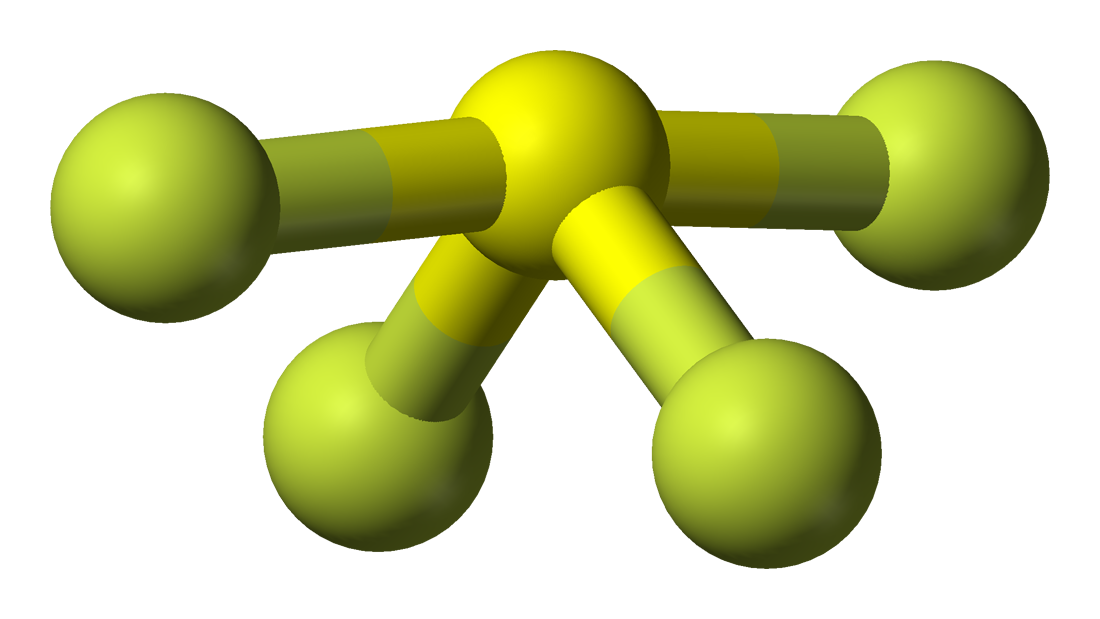
Det er let at forstå molekylær geometri for et givet molekyle ved hjælp af molekylformlen eller VSEPR-modellen. En molekylformel hjælper med at kende det nøjagtige antal og den nøjagtige type af atomer, der er til stede i den givne forbindelse. Her er der et svovlatom og fire fluoratomer i forbindelsen, hvilket gør, at den svarer til molekylformlen for AX4E.
Molekyler med molekylformlen AX4E har en trigonal bipyramidal molekylær geometri. Her er to fluoratomer, der danner bindinger med svovlatomet, på de ækvatoriale positioner, og de resterende to er på de aksiale positioner. Da der er et lone pair på det centrale atom, afstøder det det bindende elektronpar, hvilket ændrer formen en smule og får den til at ligne en vippe. Elektronerne følger dette mønster for arrangementet efter VSEPR-reglen for at minimere de frastødende kræfter mellem de ensomme elektronpar for at maksimere molekylets stabilitet.
Dermed har SF4 en trigonal bipyramidal molekylær geometri.
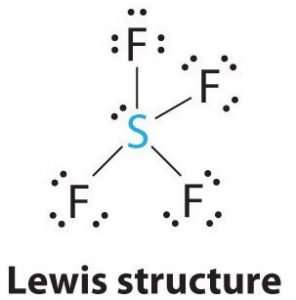
SF4 Lewis-struktur
Lewis-strukturen er en billedlig fremstilling af bindingerne og valenselektronerne i molekylet. De bindinger, der dannes mellem to atomer, er afbildet ved hjælp af linjer, mens valenselektroner, der ikke danner bindinger, er vist med prikker. De valenselektroner, der deltager i dannelsen af bindinger, kaldes bindingselektronpar, mens de elektroner, der ikke deltager eller danner nogen bindinger, kaldes ikke-bindende elektronpar eller lone par.
Og for at tegne Lewis-strukturen for SF4 skal vi først kende det samlede antal valenselektroner i dette molekyle.
Som man sikkert kan se, er der et svovlatom i denne forbindelse og fire fluoratomer. For at kende de samlede valenselektroner i denne forbindelse er vi nødt til at kende valenselektronerne for begge atomer hver for sig.
- Valenceelektroner for svovl: 6
- Valenceelektroner for fluor: 4* (7)
( da der er fire fluoratomer, skal vi tage hensyn til alle atomernes valenselektroner)
Totalt antal valenselektroner i SF4 = antal valenselektroner i svovl + antal valenselektroner i fluor
= 6 + 28
= 34 valenselektroner
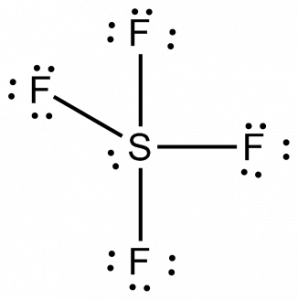
Nu kender vi det samlede antal valenselektroner, vil det blive let for os at forstå bindingsdannelsen mellem atomerne og også molekylets komplette arrangement.
Svovl vil være det centrale atom i dette molekyle, da det er det mindst elektronegative, med fire fluoratomer, der danner bindinger på siderne af dette centrale atom. Hvert fluoratom vil danne en binding med det centrale atom, hvilket betyder, at der vil være fire bindinger i molekylstrukturen, der bruger fire valenselektroner fra fluoratomer og fire elektroner fra svovlatomet. Nu bruges der altså otte valenselektroner, hvilket reducerer antallet af valenselektroner fra 34 til 24. Alle fluoratomer har seks valenselektroner, og det centrale atom har to valenselektroner.
Tegn linjer mellem S og F for at vise bindinger, og for ensomme elektronpar skal du bruge prikker til at vise elektroner. Hvert fluoratom vil have tre par af 6 valenselektroner ( vist som prikker) på atomet, sammen med en binding med svovl. I modsætning hertil vil det centrale atom have to valenselektroner og fire bindinger.
Det centrale atom, svovl, vil derfor have et enkelt elektronpar og fire bindingspar af elektroner i Lewis-strukturen for SF4. Samtidig vil hvert fluoratom have tre ensomme elektronpar.
Er SF4 polært?
Når vi kender Lewis-strukturen og molekylgeometrien for den givne forbindelse, bliver det lettere at afbilde molekylets polaritet. Her fører et lone pair på det centrale svovlatom og fire bindingspar af elektroner til den asymmetriske fordeling af elektroner på det centrale atom.
Dertil kommer, at da molekylets form er som en vippe, kan to fluoratomer ophæve hinandens dipolmoment, men det kan de to andre ikke på grund af elektronernes placering. Og da fluoratomer er mere elektronegative end svovlatomer, resulterer det i en ujævn fordeling af ladningen. Derfor ophæves dipolmomentet ikke, hvilket gør molekylet polært. Så ja, SF4 er polær.
SF4-hybridisering
For at kende hybridiseringen af SF4-molekylet skal vi først se på områderne med elektrontæthed for det centrale atom.
Svovl har fire bindingselektronpar og et enkelt elektronpar, hvilket gør det samlede antal regioner for elektrontæthed til 5. Svovlatomet anvender således fem hybridiserede orbitaler, et 3s orbital, tre 3p orbitaler og et 3d orbital. Dette arrangement af elektroner omkring atomet og hybridiserede orbitaler fører til sp3d-hybridisering. Man kan også bruge det steriske tal til at kende hybridiseringen; her er det steriske tal 5 for svovlatomet.
Så SF4 har sp3d-hybridisering.
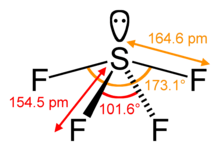
SF4 Bindingsvinkler og form
Det centrale svovlatom danner fire bindinger med de nærliggende fluoratomer og har ét enkelt elektronpar. Fluoratomer på de ækvatoriale positioner har bindingsvinkler på 102 grader, og de aksiale har 173 grader, hvilket er lidt anderledes end den trigonale bipyramide molekylærgeometri, der fører til en see-saw-form.
Det ensomme par på det centrale atom fører til ændringen af bindingsvinklerne fra 120 grader til 102 grader for de ækvatoriale fluoratomer og 173 grader i stedet for 180 grader for de aksiale fluoratomer.
Sluttende bemærkninger
For at konkludere alle egenskaberne kan vi sige, at,
- Svovltetrafluorid har 34 valenselektroner, hvoraf det danner fire kovalente bindinger og et lone par elektroner på det centrale atom i sin Lewis-struktur.
- Der er tre ensomme par på hvert fluoratom.
- Det har en molekylær geometri af formlen AX4E; det danner en see-saw-form og har en trigonal bipyramidal molekylær geometri.
- SF4 har sp3d-hybridisering og er polær i naturen.