US Pharm. 2017;42(4):HS16-HS20.
ABSTRACT: Nekrotiserende infektioner i blødt væv (NSTI’er) er en type alvorlig bakteriel infektion, der kræver hurtig genkendelse og indgriben af læger og kirurger i kombination med rettidig antibiotikabehandling. Disse infektioner kan have en polymikrobiel årsag, men i de fleste tilfælde er methicillinresistente Staphylococcus aureus involveret. Ved behandling af NSTI’er er tiden af afgørende betydning for at undgå komplikationer som f.eks. amputation, og der er for nylig blevet tilføjet nye lægemidler til listen over behandlingsmuligheder. Disse nye antibiotika omfatter tedizolid (Sivextro), oritavancin (Orbactiv) og dalbavancin (Dalvance). Den lange halveringstid for både dalbavancin og oritavancin gør det muligt at anvende enten et enkeltdosisregime eller dosering én gang om ugen.
Nekrotiserende bløddelsinfektion (NSTI) er et bredere begreb end nekrotiserende fasciitis, fordi infektionen i NSTI kan strække sig ud over fasciaen. De mundtlige udtryk omfatter “kødædende bakterier” og “kødædende infektion”. Denne type infektion blev første gang konstateret i det 5. århundrede f.Kr. af Hippokrates, som beskrev den som følger: “Mange blev angrebet af erysipelas over hele kroppen, når den spændende årsag var et ubetydeligt uheld … kød, sener og knogler faldt af i store mængder … der var mange dødsfald.”1 Siden da er der blevet brugt andre beskrivende udtryk til at karakterisere NSTI, såsom “phagedaenic ulcer, phagedena gangrenous, gangrenous ulcer, malignt ulcer, putrid ulcer, eller hospital gangrene. “2 Udtrykket gangrene bruges stadig, som i Fournier gangrene, som er nekrose af perineum og scrotum.3
Epidemiologi
Risikoen for NSTI er fortsat lav overordnet set, idet der forekommer ca. 1.000 tilfælde om året i USA. Dette antal kan dog være stigende, måske på grund af større bevidsthed om og anerkendelse af sygdomstilstanden, stigende antibiotikaresistens eller øget bakteriel virulenskapacitet.4
Etiologi
NSTI’er klassificeres efter anatomisk placering (f.eks. Fournier-gangræn), men de forekommer oftest i ekstremiteter, perineum og genitalier. Almindelige bakterielle forårsagende organismer omfatter methicillinresistente Staphylococcus aureus (MRSA), gramnegative organismer og anaerobe organismer samt gruppe A-streptokokker (GAS).4
Klinisk præsentation og diagnose
Den indledende præsentation af patienter med NSTI kan efterligne symptomer forbundet med cellulitis, herunder erytem, hævelse, feber, induration og ødem uden for området med hudforandringer.4 Patienterne kan beskrive ømhed eller smerte svarende til en forstrækning af en muskel.5 Symptomer, der bør øge klinikerens mistanke om NSTI, omfatter smerte, der er uforholdsmæssig stor i forhold til fund ved undersøgelse (tidligt i sygdomsforløbet), tilstedeværelsen af bullae, hudekchymose forud for hudnekrose, gas i vævene og kutan anæstesi. Sammenlignet med patienter med en cellulitisdiagnose peger infektionens kronologi hos patienter med NSTI desuden på en meget hurtigere sygdomsprogression.4 Derfor bør patienter, der mistænkes for at have cellulitis, få udelukket diagnosen nekrotiserende fasciitis.6 For at en infektion kan opstå, skal bakterierne komme ind i blodbanen, normalt gennem et inciterende sår (et brud i epitel- eller slimhindeoverfladen) som f.eks. et mindre snit eller skrab, et insektbid, et hudulcus eller et postoperativt sår; lejlighedsvis kan sådanne skader dog ikke identificeres. Risikofaktorer for NSTI omfatter en immunsupprimeret tilstand (AIDS, steroidbehandling), fedme, alkoholmisbrug, kræft, diabetes mellitus, perifer vaskulær sygdom, nyresygdom, underernæring og andre kroniske tilstande. Aktiv parenteral stofbrug (IV eller subkutan injektion af ulovlige stoffer) er også blevet identificeret som en risikofaktor, især i bymiljøet.7
Guidelines Review
The 2014 Infectious Diseases Society of America (IDSA) Practice Guidelines for the Diagnosis and Management of Skin and Soft Tissue Infections indeholder oplysninger om håndtering af alle typer hud- og blødtvævsinfektioner, lige fra simpel cellulitis til kutan miltbrand hos raske personer og kompromitterede patienter. Da disse infektioner forekommer i alle aldersgrupper, indeholder retningslinjerne anbefalinger for både pædiatriske og voksne patienter. Et underafsnit af retningslinjerne indeholder oplysninger om NSTI. Specifikke anbefalinger til behandling gives på grundlag af en vurdering, der angiver styrken af evidensen for anbefalingen i henhold til IDSA/U.S. Public Health Service grading system for rating recommendations in clinical guidelines.6 Retningslinjen giver svar på 24 kliniske spørgsmål, herunder to spørgsmål, der er relateret til NSTI.
Det første NSTI-relaterede spørgsmål, som retningslinjerne behandler, er: Hvad er den foretrukne evaluering og behandling af nekrotiserende fasciitis, herunder Fournier-gangræn? Den første anbefaling går ud på hurtig kirurgisk konsultation hos patienter med aggressive infektioner med tegn på systemisk toksicitet, eller hvis der er bekymring for nekrotiserende fasciitis eller gasgangræn.6 Dette efterfølges af to anbefalinger vedrørende antibiotikabehandling. Den indledende antimikrobielle behandling bør være bred for at dække både infektioner med enkeltorganismer og multiorganismer. Desuden anbefales penicillin i kombination med clindamycin ved dokumenteret GAS-nekrotiserende fasciitis. Alle tre anbefalinger er vurderet som stærke med evidens af lav kvalitet, hvilket indikerer, at de ønskværdige virkninger klart opvejer de uønskede virkninger. Efter anbefalingerne gives en gennemgang af evidensen, efterfulgt af en gennemgang af de mest almindelige kliniske træk, mikrobiologiske årsager (monomikrobielle versus polymikrobielle), diagnose og behandling.
Et særskilt afsnit i retningslinjerne fokuserer på håndteringen af clostridiel NSTI i henhold til følgende spørgsmål: Hvad er den passende tilgang til evaluering og behandling af clostridiel gasgangræn eller myonekrose? Først bør der foretages en akut kirurgisk udforskning af det formodede gasgangrænsted og debridering af det involverede væv. Der foreslås bredspektret antibiotikabehandling, medmindre der er en sikker mikrobiologisk årsag. I tilfælde af myonekrose forårsaget af clostridier foreslås penicillin i kombination med clindamycin. Endelig anbefales det ikke at anvende hyperbar oxygenbehandling. Alle disse forslag har en stærk anbefaling, og alle undtagen den kirurgiske anbefaling har en lav evidenskvalitet (den kirurgiske anbefaling har en moderat evidenskvalitet). En gennemgang af evidensen omkring disse anbefalinger afslutter afsnittet om NSTI.6
Ud over at NSTI’er adskiller sig fra mindre alvorlige hudinfektioner ved den kliniske præsentation og andre systemiske manifestationer, kræver NSTI’er en anden tilgang til behandlingen. Der findes mange varianter af NSTI, men antibiotikabehandlingen og den kirurgiske tilgang er ens for alle typer, og kirurgisk indgreb er den primære tilgang, når der forventes en NSTI. De fleste patienter vil kræve flere besøg på operationsstuen, indtil debridering ikke længere er nødvendig.6
Lægemiddelbehandling
Det indledende antibiotikavalg bør omfatte midler med aktivitet mod en bred vifte af organismer, herunder aerobier, MRSA og anaerobier (TABEL 1).6 Patientspecifikke faktorer såsom tidligere antibiotikaeksponering, samtidige sygdomstilstande, organdysfunktion og allergier bør tages i betragtning ved valg af antibiotika. Som det er tilfældet ved håndtering af de fleste infektioner, omfatter god antimikrobiel stewardship optimering af antibiotikabehandling til det snævrest mulige spektrum, når en mikrobiologisk årsag er blevet identificeret.
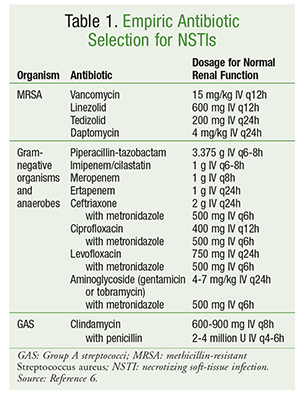
Den definitive håndtering af NSTI omfatter en række antibiotika. Ved polymikrobielle infektioner fortsættes ofte bredspektret antibiotikabehandling. I tilfælde af infektioner forårsaget af GAS bør der anvendes både clindamycin og penicillin. Tilføjelsen af clindamycin undertrykker toksin- og cytokinproduktionen, og brugen af penicillin giver dækning i tilfælde af clindamycinresistens over for GAS. Ved infektioner forårsaget af methicillinmodtagelige S aureus foretrækkes brugen af nafcillin, oxacillin eller cefazolin. Clostridieinfektioner bør behandles med clindamycin i kombination med penicillin. Antibiotikabehandling fortsættes typisk, indtil der ikke er behov for yderligere debridering, patienten har vist klinisk bedring, og feberen har været fraværende i 48 til 72 timer.6
Siden offentliggørelsen af IDSA-retningslinjerne fra 2014 er flere nye antibiotika blevet godkendt til brug ved behandling af komplicerede hud- og bløddelsinfektioner. Disse midler er tedizolid (Sivextro), oritavancin (Orbactiv) og dalbavancin (Dalvance).
Tedizolid er et oxazolidinon-antibiotikum, der ligner linezolid. Det har pålidelig aktivitet mod MRSA og andre multiresistente grampositive organismer, der er resistente over for flere lægemidler. I modsætning til den to gange daglige dosering af linezolid gives tedizolid i en enkelt daglig dosis, enten oralt eller IV. Tedizolid kan have en mere gunstig bivirknings- og lægemiddelinteraktionsprofil sammenlignet med linezolid.8 Selv om tedizolid er blevet undersøgt til behandling af akutte bakterielle hud- og hudstrukturinfektioner, er det ikke blevet undersøgt i NSTI.
Dalbavancin og oritavancin er lipoglycopeptider, der er godkendt til behandling af akutte bakterielle hud- og hudstrukturinfektioner. Disse midler er unikke, idet de har en lang halveringstid, hvilket gør det muligt at anvende enten et enkeltdosisregime eller et regime med en gang om ugen. Dosis af dalbavancin skal reduceres hos patienter med en kreatininclearance <30 mL/minut. Oritavancin kræver ingen organdysfunktion-relaterede dosisjusteringer, men det bør ikke anvendes til patienter, der modtager heparin, fordi det kunstigt forlænger koagulationstests. Oritavancin kan også øge virkningen af vitamin K-antagonister såsom warfarin.9 Begge midler har dokumenteret effektivitet i behandlingen af hud- og hudstrukturinfektioner, men de er ikke blevet evalueret til brug ved nekrotiserende infektioner.
Adjunktiv behandling af NSTI omfatter IV immunoglobulin (IVIG) og hyperbar oxygenbehandling. IVIG menes at være gavnlig på grund af en mulig neutralisering af de toksiner, der produceres i streptokokinfektioner. Reduktion af disse toksiner kunne potentielt mindske noget af det organsvigt, chok og den vævsdestruktion, der ofte ses ved NSTI.6 På det tidspunkt, hvor IDSA’s retningslinjer blev offentliggjort (april 2014), rapporterede en observationsundersøgelse og et forsøg fra Europa om visse succeser med brugen af IVIG ved streptokokinfektioner.6 På baggrund af den manglende evidens, der understøtter effektiviteten, anbefales brugen af IVIG dog ikke i øjeblikket.
En nyere undersøgelse beskrev effektiviteten af clindamycin og IVIG mod invasive GAS-infektioner.10 Fireogfirs fireogfirs patienter opfyldte kriterierne for invasiv GAS-sygdom, og IVIG blev anvendt til 14 patienter, herunder otte med nekrotiserende fasciitis. Mortaliteten var lavere hos patienter, der blev behandlet med clindamycin og IVIG, men denne forskel var ikke signifikant. Selv om der ikke var nogen statistisk forskel i dødeligheden, når IVIG blev tilføjet til clindamycin, foreslog forfatterne, at der kan være en mulig fordel hos voksne med mere alvorlig sygdom.10
Hyperbar oxygenbehandling (HBOT) er blevet anbefalet til behandling af gasgangræn, men dens rolle er kontroversiel.6 Laboratorieundersøgelser har vist, at iltrige vævstilstande bidrager til at undertrykke væksten af Clostridium perfringens og øge værtens forsvar mod fremmede celler, men der mangler kriterier til at identificere patienter, der kan have gavn af det, og det rette tidspunkt for at påbegynde behandlingen.6,11 Intet bør forsinke akut kirurgisk debridering og antibiotikaadministration, da begge dele er vigtige for at sikre overlevelse.6
Da størstedelen af de offentliggjorte undersøgelser var små og underbemidlede, blev der gennemført en undersøgelse for at evaluere data om brugen af HBOT fra flere centre med HBOT-faciliteter.11 I løbet af en 3-årig periode så 14 HBOT-faciliteter 1.583 tilfælde af NSTI og gav adjuverende HBOT i 117 tilfælde. HBOT-gruppen havde øgede omkostninger og en længere hospitalsopholdstid end kontrolgruppen, men den havde en signifikant lavere hospitalsdødelighed (henholdsvis 5 % vs. 12 %; P <.05). Når der blev taget hensyn til sygdommens sværhedsgrad, havde de mest alvorligt syge HBOT-patienter signifikant lavere dødelighed og komplikationer, men der var ingen forskelle i opholdslængde eller omkostninger. En multivariat analyse viste, at patienter, der ikke modtog HBOT, var mere tilbøjelige til at dø under indlæggelsen (odds ratio, 10,6; 95 % CI 5,2-25,1). Hver stigning i sygdommens sværhedsgrad medførte en øget risiko for død.
Denne undersøgelse af 14 HBOT-anlæg synes at vise forbedrede resultater, især for de mest syge patienter, der indlægges direkte på et center med mulighed for at yde denne behandling.11 Dette dæmper dog ikke kontroversen omkring brugen af HBOT, da denne undersøgelse havde flere begrænsninger. Undersøgelsen blev gennemført retrospektivt ved hjælp af en administrativ database på akademiske medicinske centre. Desuden kan nogle centre have en tredjepart, der ejer HBOT-anlægget, hvilket gør resultaterne mindre generaliserbare for patienter på disse institutioner. Et randomiseret, kontrolleret forsøg ville være nyttigt til at bestemme den endelige fordel ved denne behandling.
Komplikationer
Dødeligheden i forbindelse med NSTI er så høj som 30 % til 70 % hos patienter med GAS nekrotiserende fasciitis kombineret med hypotension og organsvigt.6 Da behandlingen indebærer flere besøg på operationsstuen, rapporteres der rutinemæssigt om store sår og mulige amputationer. Andre komplikationer, såsom rekonstruktiv kirurgi, sepsis, nosokomielle infektioner og forlænget tid på intensivafdelingen på grund af udvikling af organsvigt i flere systemer, er hyppige komplikationer til NSTI.12
Informationer om langtidsvirkninger af NSTI blev indsamlet gennem dybdegående interviews af 18 overlevende.12,13 Undersøgelsespersonerne fandt, at den rapporterede livskvalitet blev væsentligt påvirket af fysisk funktion og fortsatte smerter. Det blev også opdaget, at virkningen af oplevelsen på familie og andre relationer også var betydelig. Flere overlevende beskrev langsigtede psykologiske konsekvenser af sygdommen, herunder depression og posttraumatisk stress.
Slutning
Sygehusapoteker er meget velegnede til at bistå i plejen af patienter med NSTI’er, herunder strømlining af plejen; fremme af antimikrobiel stewardship; og forbedringer i de kliniske resultater, omkostningsreduktion, minimering af komplikationer og genindlæggelser. Andre roller for farmaceuten omfatter identifikation af de ideelle patienter til de nye, men dyrere terapeutiske midler (f.eks. oritavancin) og anerkendelse af lægemiddelinteraktioner (f.eks. antikoagulantia) med disse antibiotikaklasser.
1. Descamps V, Aitken J, Lee MG. Hippokrates om nekrotiserende fasciitis. Lancet. 1994;344:556.
2. Loudon I. Nekrotiserende fasciitis, hospitalsgangræn og phagedena. Lancet. 1994;344;344:1416-1419.
3. Sarani B, Strong M, Pascual J, Schwab CW. Nekrotiserende fasciitis: aktuelle koncepter og gennemgang af litteraturen. J Am Coll Surg. 2009;208:279-288.
4. Hakkarainen TW, Kopari NM, Pham TN, Evans HL. Nekrotiserende bløddelsinfektioner: gennemgang og aktuelle koncepter inden for behandling, omsorgssystemer og resultater. Curr Probl Surg. 2014;51:344-362.
5. CDC. Nekrotiserende fasciitis: en sjælden sygdom, især for raske mennesker. www.cdc.gov/features/necrotizingfasciitis/. Tilgået den 29. november 2016.
6. Stevens DL, Bisno AL, Chambers HF, et al. Praksisretningslinjer for diagnosticering og behandling af infektioner i hud og blødt væv: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis. 2014;59;59:147-159.
7. Bosshardt TL, Henderson VJ, Organ CH Jr. Necrotizing soft-tissue infections. Arch Surg. 1996;131:846-852.
8. Kisgen JJ, Mansour H, Unger NR, Childs LM. Tedizolid: et nyt oxazolidinon antimikrobielt middel. Am J Health Syst Pharm. 2014;71:621-633.
9. Roberts KD, Sulaiman RM, Rybak MJ. Dalbavancin og oritavancin: en innovativ tilgang til behandling af gram-positive infektioner. Farmakoterapi. 2015;35:935-948.
10. Carapetis JR, Jacoby P, Carville K, et al. Effektivitet af clindamycin og intravenøst immunoglobulin og risiko for sygdom hos kontaktpersoner ved invasive gruppe A-streptokokinfektioner. Clin Infect Dis. 2014;59:358-365.
11. Shaw JJ, Psoinos C, Ernhoff TA, et al. Not just full of hot air: Hyperbaric oxygen therapy increases survival in cases of necrotizing soft tissue infections. Surg Infect (Larchmt). 2014;15:328-335.
12. Hakkarainen TW, Burkette Ikebata N, Bulger E, Evans HL. Moving beyond survival as a measure of success: forståelse af patienternes oplevelse af nekrotiserende blødtvævsinfektioner. J Surg Res. 2014;192;192:143-149.
13. Miller LG, Perdreau-Remington F, Rieg G, et al. Nekrotiserende fasciitis forårsaget af fællesskabsassocieret methicillinresistent Staphylococcus aureus i Los Angeles. New Engl J Med. 2005;352:1445-1453.