Multiplex ligationsafhængig sondeforstærkning (MLPA) er en molekylær teknik, der blev udviklet af MRC-Holland tilbage i 2002. MLPA er kort fortalt en følsom teknik, der gør det muligt at kvantificere nukleinsyresekvenser hurtigt og effektivt. Den anvendes i mange laboratorier verden over og kan anvendes til at påvise ændringer i antallet af kopier (f.eks. deletioner eller duplikationer) af et gen, identificere DNA’s methyleringsstatus, påvise enkeltnukleotidpolymorfismer (SNP’er) og punktmutationer og kvantificere mRNA. Derfor anvendes den inden for mange forsknings- og diagnoseområder, f.eks. cytogenetik, kræftforskning og humangenetik, blandt andet.
Hvordan virker den?
MLPA består af følgende trin (figur 1):
- Denaturering
- Hybridisering
- Ligering
- Amplificering (ved PCR)
- Fragmentseparation og dataanalyse
Figur 1 – Visualisering af MLPA-teknikken (tilpasset fra Schouten, Jan P., et al.1). Vi kan også observere et typisk elektroferogram, der er opnået ved MLPA-analyse, og som viser en deletion af exon 46 (rød pil). (Elektrofjernogram tilpasset fra https://commons.wikimedia.org/wiki/File:MLPA_in_GeneMarker.jpg)
1-Denaturering og 2 – Hybridisering
Denaturering indebærer adskillelse af de annealerede DNA-strenge, således at dobbeltstrenget DNA bliver enkeltstrenget.
Hybridisering indebærer hybridisering af DNA-prøven til specifikke sonder. Da det er en multiplexteknik, kan man analysere hver prøve med op til 60 prober samtidig og dermed målrette forskellige steder!
Disse prober har en primersekvens, der binder sig til PCR-primeren i amplifikationsprocessen. Alle forskellige prober vil have den samme primerbindingssekvens. Derudover har proberne også en hybridiseringssekvens, der er komplementær til målstedet, og som gør det muligt for proben at binde sig til DNA’et. Begge prober vil hybridisere på tilstødende steder på DNA-strengen.
En af proberne fra parret indeholder en stuffersekvens, som er forskellig i længde for hvert målsted. Længden af stuffer-sekvensen ændres mellem de forskellige prober, hvilket muliggør multiplexing. Så man kan forvente, at hvert amplifikationsprodukt har en unik længde!
3-Ligering
Ligeringstrinnet binder de to sonder sammen. I dette trin anvendes et specifikt enzym kaldet DNA-ligase. Det binder de prober, der allerede er hybridiseret på tilstødende steder i DNA-strengen på målstedet. Den ligase, der anvendes i MLPA-protokoller, er ligase-65, et NAD-afhængigt ligaseenzym, som også kan være nyttigt i andre anvendelser.
Nu står spørgsmålet: Hvis vores mål er at ligere begge prober, hvorfor er de så separate molekyler til at begynde med? Jo, begge prober indeholder bindingsstederne for PCR-primere. Det betyder, at hvis vi skulle bruge proberne som et enkelt molekyle, ville vi få et amplifikationsprodukt, selv uden DNA-målstedet, hvilket ville give os uspecifik amplifikation. Enzymet ligase er ekstremt specifikt: hvis der er mismatches mellem proben og målstedet, vil ligasen ikke kunne binde proberne, og der vil ikke ske nogen amplifikation. Derfor påviser MLPA specifikke punktmutationer og skelner endda mellem pseudogener og det rigtige målgen.
4-Amplifikation
Det næste trin er amplifikation, som i det væsentlige er en polymerasekædereaktion (PCR) (tabel 1). Til PCR-trinnet tilsættes en polymerase, dNTP’er og en fremadrettet og omvendt primer. Da alle proberne har den samme PCR-primersekvens, er det kun nødvendigt at tilføje et par universelle primere for at undersøge alle vores mål. Den fremadrettede primer er fluorescerende mærket, hvilket giver mulighed for visualisering og kvantificering under analysen.
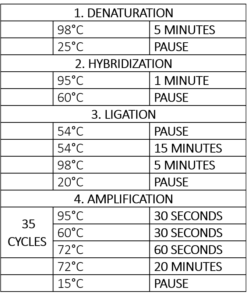
Tabel 1 – Termocyclerprogram for MLPA-reaktionen
5-Fragmentseparation og dataanalyse
Efter amplifikation adskilles fragmenterne ved kapillarelektroforese. Kapillarelektroforese adskiller fragmenter på grundlag af deres længde og viser fragmenter af forskellig længde som topmønstre, kaldet et elektroferogram (figur 1). Hver amplicon har en forskellig kendt størrelse på grund af stuffer-sekvensen på hver specifik probe, og derfor kan hver amplicon kvantificeres under dataanalysen.
De data, der opnås ved kapillarelektroforese, vil være input til analysen. MRC- Holland stiller en gratis software til dataanalyse til rådighed – Coffalyser.
Ved sammenligning af hver prøve med et sæt referenceprøver kan vi få et probeforhold. Dette sondeforhold oplyser os om, hvor mange kopiantal et gen har. Da de fleste menneskelige gener er diploide, vil forholdet være 1,0, hvis prøven præsenterer to kopier, dvs. at prøvens sonder har opnået det samme antal gener som referenceprøven.
Hvis derimod, hvis forholdet er 0,5, var der kun én kopi af genet i individet, hvilket sandsynligvis betyder en heterozygot deletion af målgenet. Hvis forholdet derimod er 1,5, er der sandsynligvis tale om en heterozygot duplikering af et gen.
MRC-Holland tilbyder mange forskellige kits, som måske har løsningen på dine problemer. Hvis du imidlertid forsøger at finde noget lidt mere obskurt eller undersøge noget, der ikke er i noget kit, kan du designe dine egne prober. Jeg råder dig til at læse protokollen for design af syntetiske sonder omhyggeligt.
Fordele ved MLPA
- MLPA er en meget følsom, robust og højgennemstrømningsteknik.
- Den kan skelne mellem punktmutationer samt duplikation/udslettelse af gener. Derfor har den en stor fordel i forhold til andre teknikker, som f.eks. sekventering, der kun kan finde punktmutationer. I modsætning til FISH kan MLPA desuden påvise små genændringer.
- Resultaterne er tilgængelige inden for 24 timer, og da det er en multiplexreaktion, giver det mulighed for en hurtig og effektiv indsamling af oplysninger.
- Små ændringer i MLPA-protokollen kan give mulighed for en række forskellige anvendelser. Ved at tilføje et ekstra fordøjelsestrin kan MLPA f.eks. også bruges til at påvise methyleringsmønstre i DNA (Methyleringsspecifik-MLPA (MS-MLPA)).
Limitationer ved MLPA
- MLPA er ekstremt følsom over for urenheder. Derfor skal der være ekstrem forsigtighed ved forberedelse af prøver og udførelse af teknikken.
- Der kan være et fald i signalet fra en sonde på grund af en sjælden polymorfi eller mutation, og det kan være nødvendigt at teste den ved hjælp af andre teknikker.
MLPA er en fantastisk teknik, der kan anvendes til varierede anvendelser og giver resultater hurtigt og effektivt. Den kommer dog ikke uden hikke. Som vi alle ved, har enhver teknik visse ulemper, og hver enkelt anvendelse skal undersøges grundigt for at sikre, at vi bruger den mest effektive og følsomme teknik.
Har du nogensinde brugt MLPA? Hvad er dine tanker om denne teknik?