Introduktion
Denne neoplasi, som har sit udspring i galdegangene epithel, eller kolangiokarcinom (CC), udgør 10% af de hepatobiliære tumorer og 2% af de maligne tumorer.1,2 CC kan opdeles i 3 undertyper afhængigt af deres anatomiske oprindelse i galdegangen: intrahepatisk eller perifert CC (ICC), perihilært CC eller Klatskins tumor (PHC) og distalt CC.
PHC, som er genstand for denne revision, er den hyppigste, og den udgør ca. 40-60 % af alle CC.2,3 Denne tumor er aggressiv og tavs, med uspecifikke symptomer indtil fremskredne stadier, hvilket fører til sen diagnose og kort overlevelse uden kirurgi på 6-12 måneder.4 Kirurgi, som er den eneste tilgængelige kurative mulighed, er kun mulig hos ca. 47 % af patienterne på diagnosetidspunktet.5-8 De vigtigste prognostiske faktorer for denne tumor er normalt forbundet med de kirurgiske muligheder, og tumorstadium, størrelse, ganglie- og vaskulær involvering, intrahepatisk metastase og histologisk type er de vigtigste faktorer.9-11
Anatomisk rum
Det anatomiske rum, som PHC optager, vil blive afgrænset af indgangen til den cystiske kanal på distalt niveau og bifurkationen af højre og venstre leverkanal på proximalt niveau.1,12 De mest udbredte klassifikationer omfatter alle CC, der har deres udspring i den galdeformige konfluens eller dens omgivelser. Nogle grupper har foreslået, at CC med oprindelse i hepatisk parenkym undertiden kan invadere den biliære konfluens med oprindelse i det anatomiske rum, der er afgrænset af kilden til den bageste højre portalvenetarm og det falciforme ligament.13-15 Disse ICC, der involverer den biliære konfluens, ville blive behandlet på samme måde som tumorer med en ekstrahepatisk oprindelse, og overlevelsen svarer til PHC i samme stadie. De er normalt højt udviklede tumorer med lokoregional vaskulær og lymfeknudeinvasion. Tvivl om den biologiske adfærd hos disse tumorer har fået mange grupper til at udelukke dem fra perihilære tumorer. I en undersøgelse offentliggjort af Ebata et al.13,15 af 250 patienter, der blev reseceret for CC med involvering af konfluensen, blev stadium og overlevelse analyseret alt efter, om tumoren var intrahepatisk med involvering af konfluensen (ICC), eller om tumorens oprindelse var i den ekstrahepatiske galdegang (PHC). I alt 83 patienter havde ICC og 167 PHC. Ved sammenligning af stadier viste patienter med ICC en højere hyppighed af vaskulær og lymfeknudeinvolvering, med en TNM højere end i PHC-gruppen, idet de havde stadium iii og iv i 59 % af tilfældene sammenlignet med 38 % i PHC-gruppen. Ikke desto mindre er der, hvis overlevelsen opdeles efter stadier i begge grupper, ingen statistisk signifikante forskelle efter 5 år, med en lidt højere samlet overlevelse i PHC-gruppen (henholdsvis 20 % vs. 29 %; P = 0,057), så det blev konkluderet, at de er sammenlignelige med hensyn til behandling og overlevelse. Med de forbedrede diagnostiske test og den forbedrede histopatologiske viden vil vi i fremtiden måske bedre kunne definere, om de er 2 forskellige enheder, eller om de klinisk og biologisk set er de samme.
Histopatologiske karakteristika
90% af PHC er adenokarcinomer. 10 % er adenoskvamøse eller pladeformede karcinomer, som i nogle tilfælde er blevet associeret med en historie med lithiasis, cyster eller anomalier i galdegangene. I henhold til tumorens udseende, væksttype og PHC’s biologiske og kliniske adfærd klassificeres de som16,17:
- –
Tumor eller “massedannende” CC: Dette er den mest almindelige præsentationsform ved ICC, selv om den også kan findes i et stort antal PHC. Den er karakteriseret ved dannelsen af en tumormasse med klart definerede margener. Den har en betydelig fibrotisk reaktion, og central nekrose er også hyppig. Denne tumor har sit udspring i åbningen af galdegangen, invaderer væggen og disseminerer ved at vokse tredimensionelt og danner en nodulær masse, der giver anledning til obstruktive symptomer.16-19
- –
Infiltrerende periduktal CC: Tumorer af denne type vokser langs en galdegang i form af en koncentrisk langsgående fortykkelse gennem bindevævet omkring galdegangen og forårsager stenose eller fuldstændig obstruktion af den berørte galdegang.19 Størstedelen af PHC er af denne type, og de er vanskelige at identificere ved hjælp af billeddannelsesteknikker.17
- –
Intraduktal eller intraduktal papillær CC: Denne variant er karakteriseret ved tilstedeværelsen af overfladiske og intraluminale tumorer i galdegangen. De producerer mucin og forårsager delvis obstruktion og dilatation af kanalerne.16 Denne tumor har en lav grad af malignitet og er normalt lille i størrelse, selv om den kan sprede sig gennem galdeslimhinden og give anledning til flere tumorer (papilomatose eller papillær karcinomatose).20
Den betydning af denne differentiering ligger i variationerne i overlevelsen afhængigt af den pågældende undertype. Flere undersøgelser har vist, at patienter med den intraduktale papillære type har en bedre prognose end patienter med de scleral-nodulære varianter,21 med en gennemsnitlig overlevelse på henholdsvis 55 og 33 måneder,22 mens vaskulær og ganglioninvolvering er mindre hyppig i den intraduktale papillære undertype.
For at opsummere er størstedelen af PHC adenokarcinomer med et periduktalt vækstmønster, der giver dem en dårligere prognose, mens varianten med intraduktal vækst er den mindst hyppige, selv om den har en bedre prognose.
Staging-systemer
Staging-systemer for PHC kan differentieres i præ- og postoperative klassifikationer. Af de første, som anvendes ved planlægning af operationen, er det vigtigste system Bismuth-Corlette-klassifikationen. Denne angiver, hvilken lobe der fortrinsvis er påvirket, og den viser derfor, hvilken type hepatectomi der bør anvendes (fig. 1).23 Denne klassifikation blev opfundet i 1970’erne og tager hverken hensyn til lymfeknudeinvolvering eller metastase, hvorfor den nu har mindre prognostisk værdi.
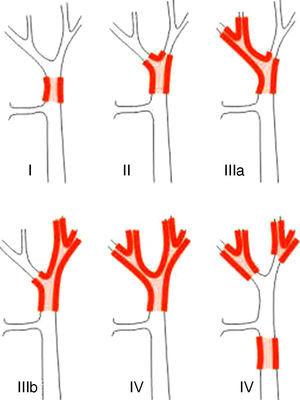
Bismuth-Corlette23-klassifikationen.
En anden præoperativ klassifikation, der anvendes i USA, er den, der er offentliggjort af Jarnagin et al.10 fra Memorial Sloan Kettering Cancer Centre, New York. Denne klassifikation har til formål at forudsige tumorers resektabilitet, idet der tages hensyn til 3 lokale udvidelsesfaktorer. Det drejer sig om udvidelse af galdeveje, vaskulær involvering og atrofi af lobe. Denne klassifikation tager hverken hensyn til lymfeknudeinvolvering eller metastasering, så den har mindre prognostisk værdi. Da resektabiliteten varierer fra gruppe til gruppe, mens tendensen går i retning af stadig mere aggressive behandlinger, vil dens værdi afhænge af de kriterier for ikke-resektabilitet, der gælder i de enkelte centre. Lokal involvering bør nu ikke være et kriterium for ikke-resektabilitet, forudsat at vi er i stand til at opnå en R0 med kirurgisk resektion.
Af de postoperative klassifikationer er den mest anvendte TNM-klassifikation fra Union for International Cancer Control (UICC), syvende udgave12 . Denne klassifikation tager hensyn til patologiske data, såsom lokal udvidelse, vaskulær involvering, lymfeknudeinvolvering og metastase, for at etablere en klassifikation, der omfatter tumorens udvidelse og er af prognostisk karakter.
For nylig offentliggjorde “Japanese Study Group on Perihilar Cholangiocarcinoma” (JSGPH) en undersøgelse, som foreslog en ændring af klassifikationen fra “Union for International Cancer Control”. De grundlæggende forskelle er vist i tabel 1, og de består hovedsageligt af13:
-
Der er ikke tale om, at Bismuth IV ikke betragtes som T4. JSGPH’s klassifikation tager derfor ikke hensyn til bilateral biliær udvidelse som en dårlig prognose, hvis der opnås en R0-resektion.
-
Med hensyn til stadierne prioriterer den lymfeknudeinvolvering som den dårligste prognose. De betragter derfor lymfeknudeinvolvering som stadium iva og ikke iiib (TNM7).
Sammenligning af de grundlæggende forskelle mellem UICC’s TNM 7-klassifikation og JSGPH’s forslag.
| Tumorklassifikation | UICC | JSGPH forslag | |
|---|---|---|---|
| Tis | Carcinoma in situ | ||
| T1 | Tumor begrænset til galdegangen | ||
| T2a | Undergår kanalvæggen og invaderer perihilært fedtvæv | ||
| T2b | Invaderer hepatisk parenkym | ||
| T3 | Ensidig invasion af den hepatiske arterie/åre | ||
| T4 | Invasion af HA/PV’s hovedgren, Bismuth IV, eller Bismuth III med kontralateral invasion af A/V | Vaskulær invasion af HA/PV’s hovedgren, med bilateral vaskulær eller kontralateral invasion | |
| TNM stadium | |||
| 0 | Tis N0 M0 | ||
| I | T1 N0 M0 | ||
| II | T2 N0 M0 | ||
| IIIa | T3 N0 M0 | ||
| IIIb | T1-3 N1 M0 | T4 N0 M0 | |
| Iva | T4 N× M0 | T× N1 M0 | T× N1 M0 |
| Ivb | T× N× M1 | ||
HA, leverarterie; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, tumorlymfeknudemetastase; UICC, Union for International Cancer Control; PV, portalvenen.
På europæisk plan er der blevet oprettet et internationalt register over perihilære tumorer, der er behandlet kirurgisk, under ledelse af “International Cholangiocarcinoma Group for the Staging of PHC”. Denne gruppe har offentliggjort en ny klassifikation1 , som tager hensyn til tumorstørrelsen sammen med biliær, venøs, arteriel, ganglion- og metastatisk involvering, præoperativt såvel som postoperativt. Begrænsningerne ved denne klassifikation er dog, at den blot beskriver tumorkarakteristika og den operation, der skal foretages, uden at inddele patienterne i grupper eller stadier på grundlag af disse variabler. Som følge heraf er det ikke muligt at drage prognostiske konklusioner, og det er også umuligt at sammenligne resultaterne af forskellige grupper.
Den præoperative klassifikation, der nu anvendes mest til at afgøre, hvilken type resektion der skal foretages, er Bismuth-Corlette-klassifikationen, mens TNM 7-klassifikationen anvendes til at definere langtidsprognosen.
Diagnostiske strategier
De symptomer, der hyppigst er forbundet med PHC, er: gulsot (90 %), vægttab og mavesmerter (35 %), pruritus (26 %) og akut kolangitis (10 %).17 På grund af disse symptomer stilles den indledende diagnose normalt ved hjælp af abdominal ultralyd, og dette er en god screeningstest. Andre diagnostiske test for denne type tumor ville være:
- –
Abdominal Doppler Ultralyd: Dette gør det muligt at vurdere arteriel og portal permeabilitet (trombose), hvilket kan betinge tumorens resektabilitet og den terapeutiske strategi, selv om det ikke er den foretrukne test til vurdering af vaskulær involvering.
- –
Abdominal computerbaseret aksial tomografi: denne er nyttig til diagnosticering af den primære tumor og sygdomsudbredelse, med en følsomhed på 80 % ved vurdering af galdeudbredelse. Det er den foretrukne teknik til præoperativ evaluering af den vaskulære anatomi med en sensitivitet på 93 % og 87 % ved evaluering af henholdsvis arteriel og portal involvering. Den har en lav følsomhed til præoperativ evaluering af lymfeknudeinvolvering (50 %).14,24 Den er også nyttig til udførelse af volumetriske test og beregning af det levervolumen, der er tilbage efter kirurgisk resektion. Det er også den mest økonomiske test til præoperativ staging.
- –
Magnetisk resonans og magnetisk resonans-kolangiografi (RM-kolangiografi): den bedste test til diagnosticering af primær tumor og til vurdering af galdeudvidelse. Den har en sensitivitet på 86-100 %, og den er bedre end direkte kolangiografi, samtidig med at det også er en ikke-invasiv test25 . På den anden side har den en lav sensitivitet til vurdering af vaskulær involvering (73 %) og en sensitivitet på 80 % for invasion af leverparenkymet.
- –
Direkte kolangiografi: endoskopisk retrograd kolangiopancreatografi (ERCP) og transparietal hepatisk kolangiografi (TPHC): Disse informerer os om graden af galdeobstruktion og gør det muligt at tage prøver fra læsionen med henblik på cytologi, med en sensitivitet på 20 %. De er nu blevet erstattet af MR-kolangiografi i forbindelse med diagnosticering. De er meget nyttige til præoperativ galdrænage og til palliativ behandling af PHC, hvor der fortrinsvis indsættes metalbelagte stents26 .-28
- –
Endoskopisk ultralyd: Denne er nyttig til evaluering af ganglieinddragelse i området omkring den celiakale stamme og peripancreatiske region, til fastlæggelse af præoperativ stadieinddeling og gør det muligt at tage fine needle aspiration biopsier.
- –
Positronemissionstomografi: Denne er nyttig ved undersøgelse af patienter med mistanke om metastatisk involvering samt involvering af adenopatier i celiacastrengen. Dens følsomhed er kontroversiel, og den kan variere fra 38 % til 90 %, afhængigt af de offentliggjorte serier.14,24,29
- –
Tumormarkører: Disse er af begrænset nytteværdi, og CA 19,9 er den mest almindeligt anvendte. De fleste undersøgelser har evalueret disse i pancreasneoplasier og i mindre grad i CC, uden at specificere deres placering eller karakteristika. Niveauerne i serum af disse markører er stærkt påvirket af galdeobstruktion og gulsot på grund af deres galdeudskillelse. Der er blevet foreslået forskellige normalværdier afhængigt af tilstedeværelsen af hepatopati (300U/ml) eller gulsot (1000U/ml), mens der ved pancreascancer opnås en sensitivitet på over 70 % og en specificitet på over 95 %. Koncentrationen hos disse patienter varierer meget og korrelerer ikke med tumorstørrelsen, selv om den korrelerer med metastatisk involvering. Sensitiviteten og specificiteten af denne markør kan øges ved at kombinere den med CEA, især i Lewis A-negative tilfælde (der ikke producerer CA 19,9).30
Det kan udledes af ovenstående data, at vi normalt begynder undersøgelsen ved hjælp af ultralydsscanning til diagnosticering af PHC. Dette sker i forbindelse med en patient med gulsot, mens computertomografi og MR-kolangiografi er de bedste stagingundersøgelser og de mest anbefalelsesværdige forud for operation. MR- eller computertomografi kan anvendes til volumetrisk undersøgelse, afhængigt af den type apparat eller de computerprogrammer, der er til rådighed på det enkelte hospital. Hvis der er tvivl om spredning til lymfeknuder, som kan kontraindicere kirurgi, anbefales positronemissionstomografi eller finnåleaspirationsendoskopi.
Kriterier for ikke-genoprettelighed
Kirurgi er den eneste kurative behandling for PHC, og den giver den bedste overlevelse på lang sigt. De kriterier, der er vedtaget for kirurgisk resektion, er blevet udvidet i de seneste år, fra de kriterier, der oprindeligt blev beskrevet af holdet fra Memorial Sloan Kettering Cancer Center af Burke et al.31 i 1998, til den nylige indførelse af tilgange med vaskulær resektion og udvidede hepatectomier.3,5,32-34 Kriterierne for ikke-resektabilitet varierer fra hospital til hospital, og de mest udbredte er: vaskulær involvering på den ene side med kontralateral galdeinvolvering op til deling af radikaler på andet niveau, fjernmetastaser i leveren, vaskulær involvering af begge leverlapper, ekstrahepatisk eller peritoneal involvering og adenopatisk involvering af celiakustrangen, den øvre mesenteriale arterie eller den paraaortiske region.3,5,8,31
I en multicenterundersøgelse offentliggjort af De Jong et al.34 , som analyserede 305 patienter, der blev opereret for PHC i 7 forskellige centre i USA og Europa, og som omfattede patienter med portalinvolvering, var de eneste 2 statistisk signifikante prognostiske faktorer i en multivariabel analyse involvering af resektionsgrænsen og lymfeknudeinvolvering (P=.02). I den undersøgelse offentliggjort af Ebata et al.15 , som analyserede 1352 patienter, der blev opereret på 8 japanske hospitaler for PHC med kurativ hensigt, viste multivariabel analyse af de statistisk signifikante prognostiske faktorer, at de var: vaskulær invasion, invasion af bugspytkirtlen, lymfeknudeinvolvering, tilstedeværelse af metastaser og involvering af resektionsgrænsen. Lymfeknudeinvolvering og metastase var de faktorer, der førte til dårligere overlevelse efter 5 år i forhold til de andre (henholdsvis 10 %, 20 % og 63 %). Disse resultater støtter brugen af kirurgi til disse tumorer, hvis det på trods af lokal udvidelse er muligt at foretage en R0-resektion, da det er muligt at øge overlevelsen til 5 år uanset lokal udvidelse.
På grund af alle ovenstående overvejelser anbefales det, at hvert enkelt tilfælde vurderes individuelt, og at kirurgi anvendes, hvis der kan opnås en R0-resektion i fravær af fjernmetastaser eller peritoneal involvering. Bilateral biliær og lokal vaskulær involvering bør derfor ikke være ikke-resektabilitetskriterier, hvis det er muligt at operere med bevarelse af mere end 30 % af levervolumen og opnå en onkologisk resektion.
Terapeutiske strategierBiliær drænage
Da størstedelen af PHC-patienterne debuterer med gulsot, er et af de vigtigste dilemmaer vedrørende nytten af præoperativ biliær drænage. Dette er imidlertid ikke uden komplikationer, og de komplikationer, der er forbundet med ERCP med indsættelse af en stent, er: pancreatitis, duodenal perforation, duodenal migration, kateterobstruktion og, vigtigst af alt, kolangitis. Ved drænage med CTPH er der en lavere frekvens af præoperativ kolangitis, men den er forbundet med blødning, katetermigration, op til 5 % tumorspredning inden for kateterets bane samt ubehag og smerter i indgangsområdet. Samlet set har ERCP ifølge de offentliggjorte undersøgelser en associeret morbiditet på 60 %, og det tilsvarende tal for CTPH er 31 %.14,35
På grund af ovenstående årsager er der blevet sat spørgsmålstegn ved nytten af præoperativ galdrænage ved hepatobiliopankreatisk kirurgi.36,37 Disse undersøgelser, som omfatter alle typer hepatobiliarkirurgi, har vist, at præoperativ galdrænage hos patienter med gulsot øger den associerede morbiditet uden at forbedre overlevelsen, idet den primært øger komplikationer, der involverer infektioner. Den europæiske multicenterundersøgelse, der blev offentliggjort i 2013 af Farges et al.38 , analyserede retrospektivt 366 patienter, der havde været udsat for hepatektomi eller udvidet hepatektomi og biliær resektion på grund af PHC. De blev klassificeret efter, om der var blevet udført præoperativ galdrænage eller ej. Gruppen uden præoperativ drænage (non-PBD) bestod af 186 patienter, og gruppen med biliær drænage (PBD) indeholdt 180 patienter. Grupperne var homogene med hensyn til alder, tumorstadie og portalresektion. PBD-gruppen udviste flere højre hepatectomier (56 % vs. 44 %). Når de to grupper blev sammenlignet efter den udførte operationstype, viste de patienter, der blev underkastet højre hepatectomi, et højere antal postoperative leversvigt, hvis de tilhørte ikke-PBD-gruppen, med en forekomst på 16 % mod 4 % i PBD-gruppen (P=.009). I den multivariable analyse af de faktorer, der var forbundet med højere dødelighed i gruppen med højre hepatektomi, var det en statistisk signifikant faktor at have et bilirubinniveau på under 3 mg/dL før operationen. Hvis de to grupper af venstre hepatectomipatienter blev sammenlignet, viste PBD-gruppen imidlertid et højere antal postoperative sepsis med en forekomst på 6 % sammenlignet med 0 % i ikke-PBD-gruppen (P=.014). Denne undersøgelse viser, at selv om det er rigtigt, at galdrænage øger forekomsten af postoperativ sepsis, bør galdrænage udføres hos de patienter, der skal underkastes højre hepatektomi for at reducere morbimortaliteten i forbindelse med postoperativ leversvigt, og andre undersøgelser støtter denne teori39 . I betragtning af at i behandlingen af PHC er de eneste undersøgelser, der har vist større overlevelse, de undersøgelser, der støtter omfattende resektioner for at opnå R0-resektion, anbefales biliær drænage, når kirurgi er indiceret, og det kan i sidste ende kræve omfattende hepatektomi af mere end 50 % af levervolumen eller trisegmentektomi, eller hvis der er kolangitis. Der er uenighed om grænseværdien for bilirubinniveauet for at indikere drænage, og >10mg/dL er en af de mest anvendte.5,37 Det anbefales, at der udføres biliær drænage ved CTPH med placering af ekstern drænage, hvorved manipulation af tumoren undgås. Dette har en lavere forekomst af infektioner end CPRE og gør det muligt, hos de patienter med unilateral dræning, som ikke normaliserer deres bilirubinniveau, at anvende bilateral biliær dræning.35,40
Tumorspredning på punkturstedet er blevet beskrevet i op til 5-10 % af de tilfælde, hvor der blev anvendt CTPH,14,24 selv om disse undersøgelser ikke specificerer, hvornår der blev anvendt ekstern eller intern-ekstern dræning, og de tager ikke hensyn til den tid, der er gået indtil operationen. Nogle forfattere anbefaler anvendelse af endoskopisk placeret nasobiliær drænage for at forhindre spredning på punktet for at forhindre spredning på punktet, med en lavere forekomst af cholangitis og obstruktion af stenten end det er tilfældet med CPRE41 . I de samme undersøgelser indrømmes det imidlertid, at det er vanskeligt at foretage præoperativ bilateral biliær drænage ved hjælp af dette system, og dette hindrer normalisering af bilirubinniveauet før operationen hos patienter, hvor unilateral drænage er mislykkedes.42
For at reducere den morbiditet, der er forbundet med infektioner efter præoperativ biliær drænage, foreslås det, at der systematisk dyrkes galde efter drænage og under operationen. Flere undersøgelser har vist, at 78 %-94 % af disse kulturer er positive for drænede patienter i modsætning til 20 %-30 % for ikke-drænede patienter,43-45 og enterokokker er den hyppigst isolerede organisme. Disse grupper forsvarer brugen af profylaktisk antibiotika, som, selv om de øger antibiotikaresistensen hos de isolerede arter, i offentliggjorte undersøgelser har vist sig at give en postoperativ infektionsmorbiditet, der svarer til den for ikke-drænede grupper. Det valgte antibiotikum afhænger af kulturerne og antibiogrammet, selv om flertallet af grupperne anvendte mindst tredje generations cefalosporin eller fluoroquinoloner+metronidazol, når der ikke var nogen kultur til rådighed, eller når den var negativ.43,44,46
Palliativ galdedrænage anvendes hos patienter, der ikke kan undergå resektion. Dræning kan ske ved ERCP, hvor der efterlades en belagt metalstent, eller ved CTPH i de tilfælde, hvor det ikke er muligt at opnå korrekt dræning af begge galdegange ved hjælp af ERCP.
Der bør således definitivt anvendes præoperativ galdedrænage hos alle patienter med bilirubin over eller lig med 10 mg/dL og hos dem, hvor leverresektionerne vil være større end 50 % af levervolumenet. Typen af fremgangsmåde afhænger af hospitalet, selv om CTPH med ekstern drænage anbefales for at undgå manipulation af tumoren og den lavere forekomst af kolangitis. Nogle forfattere anbefaler, at drænede patienter får profylaktisk antibiotika, der er egnet til deres galdekulturer.
Preoperativ portalembolisering
Preoperativ portalembolisering blev beskrevet i 1980’erne, først af Makuuchi et al.47 og derefter af Kinoshita et al.48 Formålet med portalembolisering er at øge det resterende levervolumen i de tilfælde, hvor det anses for utilstrækkeligt i den præoperative volumetri, hvilket reducerer sandsynligheden for postoperativ leversvigt. I en metaanalyse offentliggjort for nylig af Higuchi og Yamamoto49 , som omfattede 836 patienter med PHC med præoperativ portalembolisering, var morbiditeten 1 % og mortaliteten 0,09 %. Tumorprogression under proceduren, der forhindrede operation, udgjorde 19,4 %. Disse resultater støtter tanken om, at brugen af denne metode til PHC er berettiget hos de patienter med et tilbageværende præoperativt levervolumen på under 30 %.
Staging laparoskopi
Med de seneste års fremskridt i de ikke-invasive billeddannelsestestestestes sensitivitet og specificitet er laparoskopi til stadieinddeling ved at falde i ubrug. De vigtigste kriterier for ikke-resektabilitet er lymfeknudeinvolvering, galdeudvidelse og vaskulær invasion. Disse er vanskelige at vurdere ved laparoskopi, hvis præcision og effektivitet har været faldende i årevis. Dette fremgår af den nylige revision af Rotellar og Pardo50 , hvor præcision og effektivitet lå på henholdsvis 41 % og 72 % i 2002 og på 14 % og 32 % i undersøgelser offentliggjort i 2011. Dette fald skyldes især forbedringen af ikke-invasive undersøgelser som f.eks. MR-kolangiografi. Dens effektivitet øges, hvis der udvælges patienter med høj risiko for peritoneal spredning eller levermetastaser, hvorved unødvendige laparotomier undgås.50-52 Ikke-invasive billeddannelsesteknikker anbefales i avancerede stadier (T2/3/4), hvor der er mulighed for avanceret peritoneal eller lymfeknudeinvolvering, og som ikke kan punkteres ved hjælp af ekkoendoskopi, før der anlægges præoperativ galdeafledning. Vi udfører altid staging-laparoskopi ved hjælp af intraoperativ ultralydsscanning for at forbedre følsomheden for lokoregional og lymfeknudeinvolvering.53
Kirurgisk behandling
Kirurgi er stadig den eneste kurative behandling af PHC,3,14 og opnår en overlevelsesrate på 20-40 % efter 5 år (tabel 2).10,11 Der skal altid foretages kirurgisk resektion, hvis det er muligt at opnå en R0-resektion. De vigtigste faktorer, der påvirker overlevelsen efter kirurgi, er involvering af resektionsgrænserne, enten mikroskopisk (R1) eller makroskopisk (R2) sammen med lymfeknudeinvolvering (N1 og N2).14,17,44,54 Flere undersøgelser har vist, at overlevelsen øges, hvis resektionen udvides for at skabe negative marginer.3,5,33,45 De foreslåede teknikker omfatter udvidede hepatectomier med resektion af det caudatale segment, galderesektion, hylær lymfadectomi op til celiacastrengen og rekonstruktion med hepatojejunostomi.
Survival efter resektion af PHC i henhold til de publicerede serier.
| Author | År | Sager | Survival at 5 years (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20,2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Survival efter hepatisk resektion på grund af perihilært kolangiokarcinom.
Kun 2 års opfølgning.
Den “no-touch-teknik”, der først blev beskrevet af Neuhaus et al.32 indebærer blokresektion af hepatisk hilum uden manipulation af tumoren, hvilket øger patientoverlevelsen til 5 år i mere end 15 % af tilfældene.3,33,34,55 Denne teknik består grundlæggende af resektion af portvenen og højre leverarterie, når de er tæt på tumoren, hvorved man forhindrer dissektion af disse, hvis dette indebærer manipulation af tumoren, sammen med fuldstændig galderesektion med bred lymfadenektomi op til roden af cøliaki-stammen og rekonstruktion med hepaticojejunostomi. Det vil være at foretrække at vælge den højre leverlap (den vigtige “non-touch-teknik” ifølge Neuhaus)33 , på betingelse af at tumorens udvidelse gør det muligt at inddrage højre leverarterie, som er den, der er tættest på tumoren. Denne form for radikal kirurgi medfører en acceptabel postoperativ morbiditet på 50-70% afhængigt af den pågældende serie og en dødelighed på 10-20%.3,5 PHC-patienternes overlevelse efter 5 år ligger på 20-40 %, mens publicerede undersøgelser, der omfatter portaleresektion, og serier, der anvender “no-touch-teknikken”, opnår 58 % efter 5 år (fig. 2 og 3).3,5,33
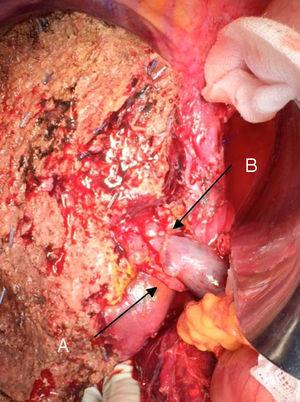
Venstre hepatectomi for Klatskins tumor med resektion af portvenen: (A) højre leverarterie i det øverste mesenterium; (B) portvenen.
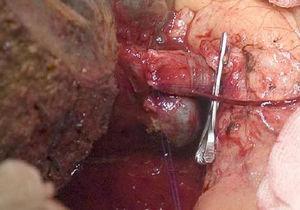
Højre hepatektomi med rekonstruktion af portvenen.
Det er også vigtigt at understrege nyere undersøgelser, der viser en stigning i overlevelsen hos patienter med præoperativ vaskulær involvering efter portresektion. De opnår endda overlevelsesrater, der er lig med eller højere end for patienter uden præoperativ vaskulær involvering, og som derfor ikke blev udsat for portalresektion.33,56,57 I disse undersøgelser svarer incidensen af lever- og vaskulære komplikationer til dem i gruppen uden portalresektion, undtagen for de patienter, der blev udsat for arteriel resektion, da disse udviser en højere morbimortalitet end de andre. På grund af alle disse overvejelser anbefales kirurgi til de patienter med unilateral portalinvolvering eller involvering af sammenløbet i præoperative tests, idet der foretages en en-bloc-resektion og vaskulær rekonstruktion. Arteriel resektion og rekonstruktion anbefales ikke, medmindre arterien er tydeligt påvirket, da dette er forbundet med dårligere postoperative resultater, så i sådanne tilfælde er højre hepatectomi at foretrække.
Sammenfattende vil de kirurgiske principper, der skal følges, være: radikal kirurgi med galde- og caudatresektion og lymfadenektomi, med R0-marginer og uden manipulation af tumoren, selv om dette indebærer resektion og rekonstruktion af portvenen og leverarterien.
Konklusioner
I øjeblikket består den eneste kurative behandling af kirurgisk resektion. Radikal en-bloc-resektion og vaskulær rekonstruktion er den teknik, som har opnået den højeste overlevelsesrate på lang sigt. For at reducere den postoperative morbimortalitet kan det anbefales at foretage galdeaftapning for at forhindre leversvigt med antibiotikaprofylakse efter aftapning og portalembolisering, når det fremtidige resterende levervolumen vil være mindre end 30 %. R0-resektion, lymfeknudeinvolvering og fjernmetastase er stadig de vigtigste prognostiske faktorer.
Interessekonflikter
Denne revision er ikke blevet præsenteret eller offentliggjort helt eller delvist i et tidsskrift eller på en kongres.