- Introduktion
- Metoder
- Musefibroblaster
- Patienternes diagnoser og medicinering
- Eksperimentel opsætning
- Måling af effektiv refraktær periode
- Stock Solutions and Drug Application
- Analyse af aktionspotentialeparametre
- Statistisk analyse
- Resultater
- Virkninger af MK-0448 på Kv1.5 strøm
- Virkninger af MK-0448 på aktionspotentialer
- Diskussion
- Studiebegrænsninger
- Slutning
- Interessekonflikterklæring
- Anerkendelser
Introduktion
Søgning efter mere sikre antiarytmiske lægemidler til behandling af atrieflimmer (AF), selektive inhibitorer af IKur er blevet designet som atrialselektive klasse III antiarytmiske midler med terapeutisk potentiale i AF. Da de er rettet mod Kv1.5-kanalerne, som kun er funktionelle i atrierne (Mays et al., 1995), anses disse midler for at være uden proarytmiske virkninger i ventriklerne og har derfor vakt stor interesse i det videnskabelige samfund (for en gennemgang se Ford og Milnes, 2008; Tamargo et al, 2009; Ravens, 2010; Ravens og Wettwer, 2011).
Vi har tidligere undersøgt de elektrofysiologiske virkninger af flere IKur-hæmmere, herunder 4-aminopyridin, AVE0118, XEN-D0101, som alle forhøjede plateaufasen af menneskelige højre atriale aktionspotentialer (AP’er) optaget i trabeculae af atriale appendiks, der er opnået fra patienter i sinusrytme (SR) eller AF (Wettwer et al, 2004; Christ et al., 2008; Ford et al., 2013). Interessant nok var aktionspotentialets varighed (APD90) og effektiv refraktær periode (ERP) forkortet i SR, men forlænget i AF-præparater.
Nu er der for første gang i mennesket blevet offentliggjort resultater med en anden selektiv Kv1.5-hæmmer, MK-0448 (Pavri et al., 2012). MK-0448 påvirkede ikke den relative atriale ERP hos raske frivillige, og forfatterne konkluderede, at IKur-blokering ikke kan forventes at udøve terapeutisk nyttige antiarytmiske virkninger i AF. Da der ikke er noget kendt om virkningerne af MK-0448 i ex-vivo humant atrialt væv, undersøgte vi dets virkninger på formen af atriale AP’er og ERP med standard mikroelektrodeteknikker i trabekulae isoleret fra højre atriale appendiks af patienter i SR og AF, som måtte gennemgå åben hjerteoperation. I SR-præparater forhøjede MK-0448 plateaupotentialet og forkortede APD og ERP ved 1 Hz som forventet af IKur-blokkere. Vi bekræfter også, at MK-0448 effektivt blokerer Kv1.5 strømmen i musefibroblaster, der udtrykker hKCNA5-genet stabilt.
Metoder
Musefibroblaster
HK2BN9-celler, der udtrykker humane Kv1.5-kanaler, blev venligst stillet til rådighed af Dr. Tamkun (Snyders et al., 1993). Cellerne blev dyrket i Dulbecco’s modificeret eagle-medium indeholdende 10% føtal kalveserum og 1% penicillin/streptomycin under atmosfæriske forhold på 5% CO2 ved 37°C. 250 μg/ml G418 blev tilsat mediet til selektion. Ekspression af Kv1.5 blev induceret ved at behandle cellerne med 1 μM dexamethason 24 timer før et forsøg. Cellerne blev undersøgt med en standard enkelt elektrode helcelle-spændingsklamp-opsætning som beskrevet tidligere (Radicke et al., 2006). Badopløsningen indeholdt (i mM): NaCl 150, KCl 5.4, MgCl2 2, CaCl2 2.0, HEPES 10, glukose 10, pH 7.4, temperatur 25°C. Elektrodeopløsningen indeholdt (i mM): KCl 40, kaliumaspartat 80, NaCl 8, CaCl2 2, MgATP 5, EGTA 5, GTP 0,1, HEPES 10, pH 7,4 justeret med KOH. Seriemodstandene var mellem 5 og 10 MΩ og blev kompenseret med op til 85%. Cellekapacitansen blev målt med små hyperpolariserende clamptrin fra -40 mV til -42 mV, den gennemsnitlige værdi var 20,8 ± 1,2 pA/pF (n = 33) og var ikke forskellig mellem celler testet ved 0,5 og 3 Hz. Spændingsklemmeimpulsgenerering, dataindsamling og analyse blev udført med ISO2-softwaren (MFK, Niedernhausen, Tyskland). Data blev ikke korrigeret for junctionpotentialet, som var 11,7 mV, som beregnet med JPCalc-softwaren (P.H. Barry, Sydney, Australien).
Patienternes diagnoser og medicinering
Atrialt væv blev indhentet fra patienter, der modtog hjertekirurgi på grund af koronararterie- eller hjerteklapsygdom. Alle patienter gav skriftligt informeret samtykke. Undersøgelsen blev godkendt af den etiske komité ved det medicinske fakultet ved Dresdens tekniske universitet (nr. EK790799). Patienterne er opført i tabel 1. Undersøgelsen omfattede 13 lægemiddeleksponerede og 9 TMC-præparater fra patienter i sinusrytme (SR-gruppen), 9 lægemiddeleksponerede og 9 TMC-præparater fra patienter med permanent atrieflimmer (AF-gruppen, defineret som permanent atrieflimmer i ≥6 måneder på tidspunktet for vævsudtagningen) og 3 lægemiddeleksponerede præparater fra patienter med intermitterende AF (episoder af spontant afsluttende AF af få sekunders varighed og op til flere timer). Patienternes medicinering omfattede typisk ACE-hæmmere, β -blokkere, nitrater, lipidsænkende lægemidler og diuretika.
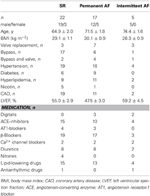
Tabel 1. Karakteristika for patienter, hvis trabekler blev anvendt til lægemiddeleksponering.
Eksperimentel opsætning
Små stykker (50-100 mg i vægt) af menneskelige højre atriale appendiks blev transporteret til laboratoriet i en speciel Ca2+-fri transportopløsning ved 20-25 °C, sammensætning i mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgSO4, 50 taurin, 5 MOPS, 30 2,3-butan-dionmonoxim (BDM), pH 7,0. Enten fritløbende trabekler (<1 mm i diameter og 2-5 mm i længden) eller trabekler sammen med fastsiddende atrialvæg blev dissekeret og monteret på bunden af et 5 ml organbad perfunderet med 50 ml recirkulerende, iltet Tyrodes opløsning ved en strømningshastighed på 7 ml/min ved 36 ± 1 °C (sammensætning i mM: 126.7 NaCl, 0,42 NaH2PO4, 22 NaHCO3, 5,4 KCl, 1,8 CaCl2, 1,5 MgCl2, pH 7,4 ved equilibrering med 5% CO2 i O2). Præparaterne blev elektrisk stimuleret ved en basal hastighed på 1 Hz med isolerede firkantede bølgestimuleringer af 1 ms varighed, 2 gange tærskelintensiteten. Transmembranpotentialer blev optaget med glasmikroelektroder fyldt med 2,5 M KCl. Elektrodernes spidsmodstande var mellem 20 og 80 MΩ. Både timingen af de drivende stimuli og forbehandlingen af transmembranpotentialsvarene blev udført med et computerstøttet handlingspotentialeoptagelsessystem (Wettwer et al., 2004). Chart for Windows, version 7.3.5, registreringsprogram (ADInstruments Pty Ltd., Castle Hill, Australien) blev anvendt til analyse af aktionspotentialeparametre.
Hvert eksperiment blev forudgået af en 60 min. equilibreringsperiode, hvor præparaterne fik lov til at stabilisere sig, og resterende BDM blev vasket helt ud. De numeriske værdier af de vigtigste aktionspotentialeparametre skulle forblive konstante, dvs. inden for et interval på ±5% i mindst 10 min. Når mikroelektroden flyttede sig ud af cellen, blev der foretaget en ny påføring samme sted, og forsøget blev fortsat, hvis den nye optagelse ikke adskilte sig fra den gamle ved en visuel vurdering og viste mindre end 3% forskel ved den endelige numeriske analyse.
Måling af effektiv refraktær periode
Effektiv refraktær periode (ERP) blev målt ved en enkelt ekstra stimulus interpoleret efter tog af 10 regelmæssige stimuleringsimpulser ved basalfrekvensen 1 Hz med faldende intervaller i trin på 5 ms fra den sidste regelmæssige impuls, indtil den ekstra stimulus ikke kunne fremkalde et aktionspotentiale. Efter en kort genopretningsperiode blev præparatet eksponeret for MK-0448 (3 μM) ved 1 Hz i yderligere 60 min, og ERP blev testet endnu en gang i tilstedeværelse af lægemiddel.
Stock Solutions and Drug Application
MK-0448 blev syntetiseret af Xention Ltd. Cambridge UK. I nogle få forsøg blev MK-0448 anvendt i kumulativt stigende koncentrationer ved direkte at tilsætte alikvater fra en 10 mM-stamopløsning med DMSO som opløsningsmiddel til 50 ml af det cirkulerende badmedium. DMSO-koncentrationen oversteg aldrig 0,2 %, en koncentration, som ikke medførte nogen væsentlig ændring, når den blev anvendt alene. Præparaterne blev udsat for hver koncentration af MK-0448 i 20 minutter.
Analyse af aktionspotentialeparametre
De følgende standardparametre for atriale AP’er blev analyseret: Der blev analyseret følgende parametre for de atrielle parametre: hvilemembranpotentiale, RMP (mV), aktionspotentialeamplitude, APA (mV), aktionspotentialevarighed ved 20, 50 og 90 % af repolariseringen, APD20, APD50 og APD90 (ms), maksimal depolariseringshastighed, dV/dtmax (V/s) og “plateaupotentialet” defineret som det gennemsnitlige absolutte membranpotentiale (mV) i tidsvinduet mellem 20 og 30 % af APD90 (PLT20). Præparater med hvilepotentialer mindre negative end -65 mV og amplituder under 80 mV blev frasorteret.
Statistisk analyse
GraphPad Prism (version 4.03) blev anvendt til statistisk analyse. I koncentrationsresponskurverne (se tabel 2) blev de værdier, der blev opnået ved stigende koncentrationer, sammenlignet med kontroller før medicinering ved envejs ANOVA efterfulgt af Bonferronis multiple sammenligningstest. De individuelle aktionspotentialeparametre for SR- og permanente AF-præparater i tilstedeværelse af 3 μM MK-0448 blev sammenlignet med kontroller før lægemidlet ved hjælp af parret Student’s t-test (se tabel 3). Forskelle betragtes som statistisk signifikante for P < 0,05.

Tabel 2. Koncentrationsafhængige virkninger af MK-0448 ved 1, 3 og 10μM (1 Hz).
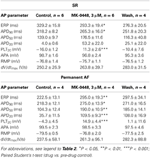
Tabel 3

Tabel 3. Virkninger af MK-0448 (3μM) på aktionspotentialeparametre og effektiv refraktær periode (ERP) af menneskelige højre atriale trabekler fra patienter i SR og AF (stimulationsfrekvens 1 Hz).
Resultater
Virkninger af MK-0448 på Kv1.5 strøm
Kv1.5 strømme, som blev målt under trinpotentialeændringer fra et holdepotentiale på -60 mV til forskellige testpotentialer mellem -40 og +80 mV havde et tærskelpotentiale på -30 mV, aktiveredes hurtigt og inaktiveredes næppe inden for 500 ms (data ikke vist). Til lægemiddelafprøvning valgte vi 50 ms varighed spændingsklampetrin til +50 mV, der fremkaldte gennemsnitlige strømamplituder på 85.0 ± 10.5 pA/pF ved 0.5 Hz (n = 16) og 110.6 ± 16.9 pA/pF ved 3 Hz n = 17, P = 0.2133). MK-0448 (100 nM) blokerede Kv1.5 strømamplitude på en frekvensafhængig måde (Figur 1A). Ved 0,5 Hz nåede blokaden en steady-state inden for 5-10 min efter lægemiddelanvendelse og blev delvist genoprettet i løbet af en 5-min periode, hvor cellen kontinuerligt blev klemt ved -60 mV (Figur 1B). Når celler blev udsat for MK-0448 i en 5 min. periode holdt ved -60 mV for at opretholde kanalerne i lukket tilstand, var IKv1.5 af den første post-rest-puls ikke forskellig fra pre-rest. Efterfølgende pulser i tilstedeværelse af lægemiddel afslørede en hurtigt indsættende hæmning, der steg med hver puls, indtil den nåede steady-state (Figur 1C). MK-0448 (100 nM) reducerede IKv1.5 fra 82.3 ± 31.5 pA/pF til 22.4 ± 6.0 pA/pF (n = 5) inden for 3 min. af kontinuerlige spændingsklampetrin ved 0.5 Hz og fra 113.8 ± 52.7 pA/pF til 12.9 ± 2.5 pA/pF ved 3 Hz (n = 4). Disse resultater er i overensstemmelse med, at MK-0448-hæmning af Kv1.5 er betinget af kanalaktivering.

Figur 1. Virkninger af MK-0448 på Kv1.5 strømme målt i HK2BN9-celler ved 25°C. (A) Spændingsklemme- og strømspor opnået før (sort) og efter superfusion af celler med 100 nM MK-0448 (grøn) i 10 min. Hastighed af klempulser som angivet. (B) Begyndelse af blokeringseffekt af MK-0448 (100 nM) på peak Kv1.5 strøm og genopretning fra blokering i løbet af 5 min ved et holdpotentiale på -60 mV. Individuelle strømspor øverst blev opnået på de tidspunkter, der er angivet med små bogstaver i dagbogsplottet nederst. (C) Begyndelse af lægemiddelvirkning efter eksponering under 5 min kontinuerlig klemning ved -60 mV. Trinfrekvens: 3 Hz.
Virkninger af MK-0448 på aktionspotentialer
Aktionspotentialer registreret i højre atriale trabekulae fra patienter i SR havde den typiske spike-og-dome-konfiguration (Figur 2), i permanent AF-væv var formen trekantet og er resultatet af elektrisk remodellering . Den mest slående koncentrationsafhængige effekt af MK-0448 (1-10 μM) på SR-aktionspotentialer ved den basale stimulationsfrekvens på 1 Hz var en robust forhøjelse af plateaupotentialet (PLT20) (Figur 2; Tabel 2). I dette sæt eksperimenter havde APD90 tendens til at blive forkortet (ikke signifikant), mens APD20 og APD50 blev forlænget og kun nåede op på niveauet for statistisk signifikans ved den højeste koncentration (se tabel 2). Hvilemembranpotentialet (RMP), aktionspotentialets amplitude (APA) og den maksimale depolarisationshastighed (dV/dtmax) blev ikke signifikant påvirket af MK-0448 (se tabel 2). Før og efter lægemiddelbehandling fulgte alle præparater stimuleringen, selv ved den højeste koncentration.
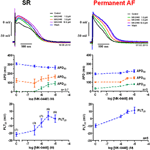
Figur 2. Koncentrationsafhængige virkninger af MK-0448 på aktionspotentialer optaget i højre atriale trabekel fra patienter i sinusrytme (SR) og permanent atrieflimren (AF). Øverst: Individuelle sporinger for typiske eksperimenter, optaget i tilstedeværelse af stigende koncentrationer af forbindelsen (se farvekode). Eksponeringstid ved hver koncentration: 20 min; kontrol: kontrol før lægemiddelkontrol. Midt og nederst: Gennemsnitsværdier ± s.e.m. fra 7 eksperimenter i SR og 5 i AF af aktionspotentialets varighed ved 90, 50 og 20% af repolariseringen (APD90, APD50 og APD20) og plateaupotentialet (PLT20). Stimulationsfrekvens: 1 Hz. Bemærk venligst, at ikke alle præparater blev udsat for hele koncentrationsområdet (antal præparater angivet i parentes).
Virkningerne af MK-0448 på ERP blev kun undersøgt ved 3 μM. Denne koncentration producerede maksimale ændringer inden for 40-50 min efter lægemiddelanvendelse, og disse var delvist reversible efter 60 min udvaskning. I 6 præparater fra patienter i SR, APD90 og ERP blev signifikant forkortet (Figur 3; Tabel 3). Lignende virkninger blev observeret i 2 præparater fra patienter i intermitterende AF (figur 3).
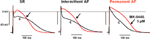
Figur 3. Virkninger af MK-0448 (3 μM, rødt spor, pil) på aktionspotentialer optaget i højre atriale trabekel fra patienter i sinusrytme (SR), intermitterende atrieflimmer (iAF) og kronisk atrieflimmer (AF). Originaloptagelser fra et præparat i hver gruppe er vist. c, kontrol før medicinering (sort spor). Stimulationsfrekvens 1 Hz.
I permanente AF-trabekler hævede MK-0448 også signifikant plateaupotentialet i et lignende omfang som i SR, men i modsætning til SR forlængede det APD på de tre analyserede repolariseringsniveauer (figur 2, 3; tabel 3). I permanente AF-præparater blev APA, RMP og dV/dtmax heller ikke signifikant påvirket, med undtagelse af RMP med 10 μM MK-0448.
På grund af begrænset tilgængeligt kunne vi kun undersøge virkningerne af MK-0448 i 2 trabekulae fra patienter med intermitterende AF, en typisk optagelse er vist i figur 3; 3 andre blev brugt som TMC’er. I lighed med resultaterne i SR-præparater forkortede MK-0448 APD90 og ERP i de 2 intermittente AF-præparater.
I tidsmatchede kontroleksperimenter med væv fra patienter i SR, intermittent AF og AF ændrede aktionspotentialeparametre sig ikke signifikant (data ikke vist).
Diskussion
De karakteristiske ændringer i aktionspotentialeparametre observeret med MK-0448 i menneskelige højre atriale trabekler er i overensstemmelse med blokering af Kv1.5-kanaler som tidligere rapporteret for flere lægemidler.
MK-0448 blev beskrevet som meget selektivt for udtrykt Kv1.5-kanaler i forhold til en lang række standard-ionkanaler i hjertet. hERG-kanaler er ca. 10.000-foldige, indadgående ensretterstrøm Kir2.1 og Kir3.1/3.4 ca. 1000-foldige og Kv7.1 (IKs) ca. 10- til 100-foldige mindre følsomme end Kv1.5 (Pavri et al, 2012). Spændingsklampdataene i et heterologt ekspressionssystem bekræfter, at MK-0448 (100 nM) producerede en robust blokering af human Kv1.5 med et ret langsomt virkningsdebut og delvis genopretning fra blokering ved -60 mV. Selv om vores resultater ikke tillader præcis karakterisering af lægemiddel-kanal-interaktion, viser de klart, at hvilende kanaler genvinder fra blokering og aktivering er nødvendig for udvikling af blokering, hvilket tyder på præferentiel binding til åbne og/eller inaktiverede kanaler.
I tidligere eksperimenter viste vi, at lave koncentrationer af 4-aminopyridin selektivt hæmmer Iso (IKur) i humane atriale myocytter (Wettwer et al., 2004). Denne blocker forhøjede plateaupotentialet i SR-præparater (EC50~15 μM). Desuden forkortede 4-AP ved koncentrationer, der anses for at være selektive for IKur-blokering, signifikant APD90 i SR, men forlængede APD90 i permanente AF-trabekler (Wettwer et al., 2004). De mest fremtrædende virkninger af MK-0448 på humane atriale AP’er, dvs, forhøjelse af plateaupotentialet, forkortelse af APD90 i SR og forlængelse af APD20, APD50 og APD90 i permanent AF, er i overensstemmelse med vores tidligere resultater med andre IKur-hæmmere, så vi er sikre på at konkludere, at MK-0448 faktisk blokerer IKur i humane atriale trabekulae.
I modsætning til hæmning af hERG-kanaler var hæmning af IKs ikke forbundet med en proarytmisk ventrikulær effekt i dyremodeller (Lynch et al., 1999). Ikke desto mindre kunne modulering af IKs med MK-0448 også reducere repolariseringsreserven i ventriklen og blive arytmogen i ventrikler under passende forhold (Lynch et al., 1999). Det er vigtigt at bemærke, at det er vanskeligt at vurdere den ventrikulære proarytmiske risiko ved et lægemiddel, der modulerer IKs, hos raske frivillige med normal ventrikulær repolariseringsreserve. Derfor vil den atrielle selektivitet af MK-0448 skulle vurderes omhyggeligt hos patienter.
Den forkortelse af APD90 og ERP ved Kv1.5-blokkere i SR foreslås at være forårsaget af den markante forhøjelse af plateaupotentialet i til et spændingsområde, hvor flere hERG-kanaler aktiveres, og, selv om de inaktiveres hurtigt, kan genoprette sig fra inaktivering ved mere negative potentialer og således fremskynde den endelige repolarisering (Gintant, 2000).
Bortset fra tydelige ændringer i aktionspotentialers form er tab af hastighedstilpasning af ERP og APD90 til frekvens blevet anerkendt som et kendetegn for atriel remodellering både hos patienter (f.eks, Attuel et al., 1982; Daoud et al., 1996) og i ex vivo-undersøgelser (Franz et al., 1997; Dobrev og Ravens, 2003). I vores nuværende undersøgelse og i den nylige “first-time-in-human”-undersøgelse med MK-0448 var alle elektrofysiologiske test i et frekvensområde langt under AF, og man kunne hævde, at baseret på vores SR-data, at det ikke er overraskende, at MK-0448 ikke forlængede AERP hos raske frivillige (Pavri et al, 2012).
Eksperimentelle og kliniske beviser tyder på, at atrieflimren skyldes mikro-reentry udløst af ektopiske foci, der er placeret i nærheden af lungevnerne (Haissaguerre et al., 1998). Farmakologiske interventioner til afbrydelse af mikro-reentry skal forlænge den effektive refraktære periode, mens undertrykkelse af ektopiske foci kræver en reduktion af excitabiliteten. Forudsat at MK-0448 faktisk blokerer IKur selektivt, er det mere sandsynligt, at det øger den atriale refraktæritet (i AF) end at reducere excitabiliteten, selv om det ikke er klart, hvordan den markante forhøjelse af plateauamplituden hænger sammen med forlængelsen af ERP i AF. Det skal dog understreges, at den overordnede form af hjertets aktionspotentiale bestemmes af flere ionledninger, hvorfor fortolkning af aktionspotentialdata ikke kan være entydig med hensyn til, hvilke ionkanaler der bidrager til en bestemt ændring.
I SR observerede vi endda en forkortelse af ERP med MK-0448, og vi kan ikke vurdere, om dette er en anti- eller proarytmisk effekt i forkamrene. Dette kan faktisk kun besvares i et prospektivt fase 2-forsøg hos AF-patienter. Det er dog værd at bemærke, at der ikke blev rapporteret om proarytmi for MK-0448 (Pavri et al., 2012) eller forkortelse af AERP hos raske frivillige. Andre Kv1.5-hæmmere, f.eks. XEN-D0101, som er blevet evalueret i klinikken, har heller ikke rapporteret pro-arytmi (atriel eller ventrikulær) hos raske frivillige (Ford et al., 2013). Genetiske undersøgelser afslørede en association af “tab af funktion”-mutationer i KCNA5-genet, der koder for Kv1.5, med familiær “lone” AF (Olson et al., 2006). I denne undersøgelse var der imidlertid ufuldstændig genotyping/fænotyping af familiemedlemmer og ingen beviser for primær linkage. Faktisk er sandsynligheden for at observere disse data ved tilfældigheder alene mellem 10 og 15%. En nylig undersøgelse af mere end 300 patienter med tidligt indsættende enlig AF afslørede 3 “gain-of-function”-mutationer i KCNA5 ud over flere loss-of-function-mutationer, hvilket understøtter hypotesen om, at modtagelighed for AF kan øges af enten en ændring i KCNA5-funktionen (Christophersen et al, 2013).
Studiebegrænsninger
I nogle humane atriepræparater forbliver APD ikke stabil under langvarig superfusion med saltvandsopløsninger (typisk ~2 timer).-Den klassificering af patienter i SR og AF er måske ikke altid pålidelig, dvs, SR-gruppen kan omfatte atrialt væv fra patienter, der har haft uerkendte episoder af paroksystisk eller nyligt opstået AF.
Slutning
Sammenfattende hæver IKur-blokkeren MK-0448 konsekvent aktionspotentialeplateauet i humane atriale trabekler uanset de oprindelige former af kontrolaktionspotentialerne og uanset om præparaterne blev opnået fra patienter i SR eller permanent AF. I SR-præparater producerede MK-0448 en forkortelse af APD90 og ERP, men i permanent AF-væv blev der observeret fremtrædende APD90- og ERP-forlængende virkninger med lægemidlet i permanent AF-væv. Med henblik på forebyggelse af vedvarende AF-recidiv er forlængelse af ERP ved hjælp af MK-0448 i AF-præparater bestemt en yderst ønskelig virkningsmåde, der kan beskytte atriummyokardiet i fasen med omvendt remodellering efter kardioversion, selv om dette, hvis det skyldes IKs-modulation, kan være forbundet med en risiko for induktion af ventrikulær proarytmi. Det skal endnu afgøres, om selektive IKur-præparater (i) er mere effektive til at forlænge ERP ved højere atriefrekvenser, (ii) farmakologisk konverterer nyopstået AF, (iii) reducerer AF-byrden i paroxysmal AF og (iv) forhindrer gentagelse af vedvarende AF.
Interessekonflikterklæring
James Milnes og John Ford er medarbejdere hos Xention Ltd., John Ford er medstifter af og ejer aktier i Xention Ltd., Ursula Ravens har fungeret som konsulent for Xention. Simone Loose, Judith Mueller, Michael Knaut, Erich Wettwer har intet at offentliggøre.
Anerkendelser
Forfatterne takker for den finansielle støtte fra Den Europæiske Union (FP7-Health T2-2010-261057 “EUTRAF”) og Xention Limited. Vi ønsker at takke alle patienter og hjertekirurgerne Klaus Matschke og Michael Knaut for deres uvurderlige støtte og Konstanze Fischer for hendes tekniske ekspertbistand.
Amos, G. J., Wettwer, E., Metzger, F., Li, Q., Himmel, H. M., og Ravens, U. (1996). Forskelle mellem udadgående strømme fra menneskelige atriale og subepicardiale ventrikulære myocytter. J. Physiol. 491(Pt 1), 31-50.
Pubmed Abstract | Pubmed Full Text
Attuel, P., Childers, R., Cauchemez, B., Poveda, J., Mugica, J., og Coumel, P. (1982). Fejl i frekvenstilpasningen af den atriale refraktære periode: dens relation til sårbarhed. Int. J. Cardiol. 2, 179-197. doi: 10.1016/0167-5273(82)90032-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christ, T., Wettwer, E., Voigt, N., Hala, O., Radicke, S., Matschke, K., et al. (2008). Patologispecifikke virkninger af I(Kur)/I(to)/I(K,ACh)-blokkeren AVE0118 på ionkanaler i menneskelig kronisk atrieflimren. Br. J. Pharmacol. 154, 1619-1630. doi: 10.1038/bjp.2008.209
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christophersen, I. E., Olesen, M. S., Liang, B., Andersen, M. N., Larsen, A. P., Nielsen, J. B., et al. (2013). Genetisk variation i KCNA5: indvirkning på den atriumspecifikke kaliumstrøm IKur hos patienter med enlig atrieflimren. Eur. Heart J. 34, 1517-1525. doi: 10.1093/eurheartj/ehs442
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Daoud, E. G., Bogun, F., Goyal, R., Harvey, M., Man, K. C., Strickberger, S. A., et al. (1996). Effekt af atrieflimren på atriel refraktærhed hos mennesker. Circulation 94, 1600-1606. doi: 10.1161/01.CIR.94.7.1600
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dobrev, D., og Ravens, U. (2003). Remodeling af kardiomyocyt ionkanaler i human atrieflimren. Basic Res. Cardiol. 98, 137-148. doi: 10.1007/s00395-003-0409-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J., Milnes, J., Wettwer, E., Christ, T., Rogers, M., Sutton, K., et al. (2013). Elektrofysiologiske og farmakologiske egenskaber hos mennesker af XEN-D0101: en ny atriel selektiv Kv1.5/IKur-hæmmer. J. Cardiovasc. Pharmacol. 61, 408-415. doi: 10.1097/FJC.0b013e31828780eb
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J. W., og Milnes, J. T. (2008). Nye lægemidler, der er rettet mod den hjertemæssige ultrahurtige forsinkede korrigatorstrøm (I Kur): begrundelse, farmakologi og beviser for potentiel terapeutisk værdi. J. Cardiovasc. Pharmacol. 52, 105-120. doi: 10.1097/FJC.0b013e318171919b0c
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franz, M. R., Karasik, P. L., Li, C., Moubarak, J., og Chavez, M. (1997). Elektrisk remodellering af det menneskelige atrium: lignende virkninger hos patienter med kronisk atrieflimren og atrieflagren. J. Am. Coll. Cardiol. 30, 1785-1792. doi: 10.1016/S0735-1097(97)00385-9
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | CrossRef Full Text
Gintant, G. A. (2000). Karakterisering og funktionelle konsekvenser af forsinket ensretterstrøms transient i ventrikulær repolarisering. Am. J. Physiol. hjerte-cirkulation. Physiol. 278, H806-H817.
Pubmed Abstract | Pubmed Full Text
Haissaguerre, M., Jais, P., Shah, D. C., Takahashi, A., Hocini, M., Quiniou, G., et al. (1998). Spontan initiering af atrieflimren ved ektopiske slag med oprindelse i lungevenerne. N. Engl. J. Med. 339, 659-666. doi: 10.1056/NEJM19980909033391003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lynch, J. J. J. Jr., Houle, M. S., Stump, G. L., Wallace, A. A., Gilberto, D. B., Jahansouz, H., et al. (1999). Antiarytmisk effekt af selektiv blokade af den langsomt aktiverende forsinkede retrækningsstrøm, I(Ks), i hundemodeller af malign iskæmisk ventrikulær arytmi. Circulation 100, 1917-1922. doi: 10.1161/01.CIR.100.18.1917
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mays, D. J., Foose, J. M., J. M., Philipson, L. H., and Tamkun, M. M. (1995). Lokalisering af Kv1.5 K+ kanalproteinet Kv1.5 i eksploderet hjertevæv. J. Clin. Invest. 96, 282-292. doi: 10.1172/JCI118032
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Olson, T. M., Alekseev, A. E., Liu, X. K., Park, S., Zingman, L. V., Bienengraeber, M., et al. (2006). Kv1.5-kanalopati på grund af KCNA5 tab af funktion mutation forårsager menneskelig atrieflimren. Hum. Mol. Genet. 15, 2185-2191. doi: 10.1093/hmg/ddl143
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pavri, B. B., Greenberg, H. E., Kraft, W. K., Lazarus, N., Lynch, J. J., Salata, J. J., et al. (2012). MK-0448, en specifik Kv1.5-inhibitor: sikkerhed, farmakokinetik og farmakodynamisk elektrofysiologi i eksperimentelle dyremodeller og hos mennesker. Circ. Arrhythm. Electrophysiol. 5, 1193-1201. doi: 10.1161/CIRCEP.111.969782
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Radicke, S., Cotella, D., Graf, E. M., Banse, U., Jost, N., Varro, A., et al. (2006). Funktionel modulering af den forbigående udadgående strøm Ito af KCNE beta-subunits og regional fordeling i menneskelige ikke-svækkende og svækkende hjerter. Cardiovasc. Res, 71, 695-703. doi: 10.1016/j.cardiores.2006.06.017
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | CrossRef Full Text
Ravens, U. (2010). Antiarytmisk behandling ved atrieflimmer. Pharmacol. Ther. 128, 129-145. doi: 10.1016/j.pharmthera.2010.06.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U., and Wettwer, E. (2011). Ultra-hurtige forsinkede retningsretterkanaler: molekylært grundlag og terapeutiske implikationer. Cardiovasc. Res. 89, 776-785. doi: 10.1093/cvr/cvq398
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Regan, C. P., Wallace, A. A., Cresswell, H. K., Atkins, C. L., og Lynch, J. J. Jr. (2006). In vivo kardiale elektrofysiologiske virkninger af en ny diphenylphosphinoxid IKur-blokker, (2-Isopropyl-5-methylcyclohexyl) diphenylphosphinoxid, hos rotte og ikke-menneskelig primat. J. Pharmacol. Exp. Ther. 316, 727-732. doi: 10.1124/jpet.105.094839
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Snyders, D. J., Tamkun, M. M., og Bennett, P. B. (1993). En hurtigt aktiverende og langsomt inaktiverende kaliumkanal klonet fra det menneskelige hjerte. Funktionel analyse efter stabil ekspression i pattedyrcellekultur. J. Gen. Physiol. 101, 513-543. doi: 10.1085/jgp.101.4.513
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | CrossRef Full Text
Tamargo, J., Caballero, R., Gomez, R., and Delpon, E. (2009). I(Kur)/Kv1.5-kanalblokkere til behandling af atrieflimmer. Expert Opin. Investig. Drugs 18, 399-416. doi: 10.1517/13543743780902762850
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, Z., Fermini, B., og Nattel, S. (1993). Vedvarende depolarisationsinduceret udadgående strøm i humane atriale myocytter. Bevis for en ny forsinket K+-strøm, der ligner de klonede Kv1.5-kanalstrømme. Circ. Res. 73, 1061-1076. doi: 10.1161/01.RES.73.6.1061
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wettwer, E., Hala, O., Christ, T., Heubach, J. F., Dobrev, D., Knaut, M., et al. (2004). IKur’s rolle i kontrollen af aktionspotentialets form og kontraktilitet i det menneskelige atrium: indflydelse af kronisk atrieflimren. Circulation 110, 2299-2306. doi: 10.1161/01.CIR.0000145155.60288.71
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Pubmed Full Text