Af Alyssa Cecchetelli og Lukas Morgan
Modelorganismer er vigtige redskaber, der anvendes af forskere over hele verden. Disse organismer deler mange gener med mennesker, er lette at vedligeholde i laboratoriet og har korte generationstider, hvilket gør det let at undersøge virkningerne af genetiske manipulationer. I dette blogindlæg vil vi dække fem populære modelorganismer, men der findes mange flere.
Husmusen (Mus musculus)
 Lad os starte med den mest foretrukne modelorganisme fra pattedyr blandt mange forskere: musen (Mus musculus). Mus har mange fordele som pattedyrmodelorganisme for forskere, da de har en for pattedyr relativt kort generationstid – tiden mellem fødsel og fødsel – på ca. 10 uger. Voksne mus reproducerer sig så ofte som hver tredje uge, så forskerne kan samtidig observere flere generationer af mus ad gangen.
Lad os starte med den mest foretrukne modelorganisme fra pattedyr blandt mange forskere: musen (Mus musculus). Mus har mange fordele som pattedyrmodelorganisme for forskere, da de har en for pattedyr relativt kort generationstid – tiden mellem fødsel og fødsel – på ca. 10 uger. Voksne mus reproducerer sig så ofte som hver tredje uge, så forskerne kan samtidig observere flere generationer af mus ad gangen.
Da musene genetisk og fysiologisk minder mere om mennesker end mange andre modelorganismer, bruges de ofte til at undersøge sygdomme hos mennesker. Sygdomme hos mus viser mange fænotyper, der ligner sygdomme hos mennesker, og har med succes hjulpet forskere med at udvikle en række terapier. Mange forskere bruger f.eks. mus til at undersøge sygdomme som kræft, da musene bedre gengiver de komplekse interaktioner mellem kræftceller, terapeutiske lægemidler og resten af kroppen end undersøgelser i andre modelorganismer eller cellekulturer. Scott Lowes laboratorium har f.eks. brugt mus til at undersøge, hvordan forskellige mutationer i leukæmi påvirker forskellige behandlingsformer (Zuber et al., 2009). Ved at injicere mus med retrovirale vektorer, der indeholdt forskellige mutationer, som findes i leukæmi, kunne Lowe-laboratoriet identificere et sæt mutationer, der gjorde kræftcellerne mere resistente over for kemoterapi. Du kan finde disse plasmider hos Addgene.
En anden fordel ved mus som modelorganismer er, at de er genetisk håndterbare. Mus kan let manipuleres med værktøjer som CRISPR for at lave transgene linjer.
Frugtfluen (Drosophila melanogaster)
 En anden populær modelorganisme er Drosophila melanogaster, eller som den er mere almindeligt kendt: frugtfluen. Frugtfluen har været anvendt i videnskabelig forskning i over et århundrede, men blev bragt i forgrunden af Thomas Hunt Morgan, der er kendt som “faderen” til Drosophila-forskningen. Morgan opdagede, at der fandtes gener i kromosomer ved hjælp af frugtfluen, længe før vi overhovedet vidste, at DNA var genetisk materiale (Jennings, 2011).
En anden populær modelorganisme er Drosophila melanogaster, eller som den er mere almindeligt kendt: frugtfluen. Frugtfluen har været anvendt i videnskabelig forskning i over et århundrede, men blev bragt i forgrunden af Thomas Hunt Morgan, der er kendt som “faderen” til Drosophila-forskningen. Morgan opdagede, at der fandtes gener i kromosomer ved hjælp af frugtfluen, længe før vi overhovedet vidste, at DNA var genetisk materiale (Jennings, 2011).
Frugtfluen er en fantastisk modelorganisme, fordi den er nem og billig at dyrke og vedligeholde i laboratoriet, har en kort livscyklus på 8 til 14 dage og producerer et stort antal afkom, der lægges udvendigt. Frugtfluer er også relativt ligetil at manipulere genetisk. Forskere kan lave en ny linje af fluer på kun 6 uger sammenlignet med de måneder, det tager at lave en transgene muselinje. I årenes løb er fluen blevet en ideel modelorganisme til at studere en lang række emner, herunder udvikling, genetik og nervesystemet. Fluen er også blevet en vigtig menneskelig sygdomsmodel med potentiale for opdagelse af terapeutiske lægemidler, da det anslås, at 75 % af de sygdomsfremkaldende gener hos mennesker har et funktionelt homolog i fluen (Pandey og Nichols, 2011).
En stor fordel ved at bruge frugtfluen er rækken af genetiske værktøjer, såsom GAL4/UAS- og LexA-systemet, der gør det muligt for forskere nemt at kontrollere niveauet og den rumlige og tidsmæssige ekspression af et gen af interesse. Denne type kontrol over genekspression er mulig i andre modelsystemer, men kan være ret vanskelig og tidskrævende. GAL4/UAS blev første gang beskrevet i 1993 af Norbert Perrimons laboratorium og er blevet løbende forbedret siden da. Hvis du er interesseret i disse systemer, så tjek Gerald Rubins laboratorium, som har skabt et sæt modulære vektorer, der kan bruges til at kontrollere genekspressionen optimalt i specifikke celler i fluen (Pfeiffer et al., 2010).
Yeast (Saccharomyces cerevisiae)
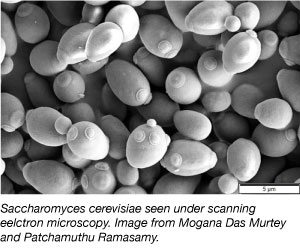 Yeast, en af de enkleste eukaryote organismer, er en almindeligt anvendt modelorganisme inden for videnskabelig forskning. Ja, den samme slags, som vi bruger i brød og andre bagværk! Gær er billigt, enkelt og nemt at arbejde med, da de kan overleve under en række forskellige miljøforhold og fordobles hver anden time. Gær er også det første eukaryote genom, der er blevet fuldstændigt sekventeret, og det er meget velegnet til genetisk manipulation.
Yeast, en af de enkleste eukaryote organismer, er en almindeligt anvendt modelorganisme inden for videnskabelig forskning. Ja, den samme slags, som vi bruger i brød og andre bagværk! Gær er billigt, enkelt og nemt at arbejde med, da de kan overleve under en række forskellige miljøforhold og fordobles hver anden time. Gær er også det første eukaryote genom, der er blevet fuldstændigt sekventeret, og det er meget velegnet til genetisk manipulation.
Gærceller er en fantastisk modelorganisme, ikke kun af ovennævnte grunde, men fordi de faktisk deler mange biologiske egenskaber og processer med vores egne celler. Ligesom menneskelige celler er gær-DNA pakket ind i kromosomer, og omkring 23 % af gærgenerne har en pendant i mennesker (Liu et al., 2017) . Gær kan således bruges til at studere det molekylære grundlag for menneskelige sygdomme, der er forårsaget af et specifikt gen. For eksempel har flere gener, der er muteret i menneskelige kræftformer, et homolog, der er involveret i celledeling i gær (Pray, 2008). Videnskabelige opdagelser i gær kan derefter kan kan yderligere undersøges i andre modelorganismer, der bedre genskaber in vivo forhold, der ligner mennesker.
For eksempel er gær på grund af sin enkelhed blevet en vigtig eksperimentel model i studiet af neurologiske sygdomme, såsom Parkinsons sygdom (PD). PD er primært karakteriseret ved proteinfejlfoldning, der fører til en ophobning af proteinaggregater, der kaldes “lewy bodies” i hjernen. Gærmodeller af PD, som f.eks. de modeller, der overudtrykker det giftige protein α-synuclein (det mest almindelige protein, der findes i lewy bodies), har været uvurderlige til at forstå de grundlæggende molekylære mekanismer, der ligger til grund for sygdommen (Menezes et al., 2015). Da gær er encellede organismer, kan de også bruges til nemt at screene flere terapeutiske forbindelser i ét forsøg.
Zebrafisk (Danio rerio)
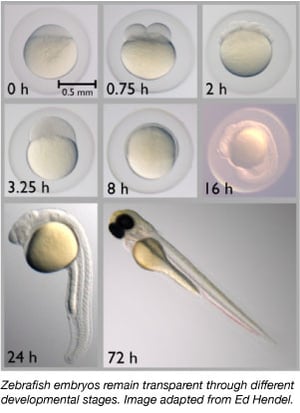 Siden 1960’erne er zebrafisken gradvist blevet en vigtig modelorganisme. De deler ca. 70 % af deres gener med mennesker, og 85 % af de menneskelige gener, der er forbundet med en sygdom, har en homolog i zebrafisk (Howe et al., 2013). Zebrafisk er små, nemme at vedligeholde, da de opstaldes i store grupper, er lette at opdrætte og producerer 50-300 æg ad gangen. Zebrafiskembryoner lægges og befrugtes også eksternt, hvilket gør det muligt for forskere at manipulere dem let. Forskere kan simpelthen injicere encellede embryoner med DNA eller RNA for at redigere deres genomer eller for at skabe transgene dyr.
Siden 1960’erne er zebrafisken gradvist blevet en vigtig modelorganisme. De deler ca. 70 % af deres gener med mennesker, og 85 % af de menneskelige gener, der er forbundet med en sygdom, har en homolog i zebrafisk (Howe et al., 2013). Zebrafisk er små, nemme at vedligeholde, da de opstaldes i store grupper, er lette at opdrætte og producerer 50-300 æg ad gangen. Zebrafiskembryoner lægges og befrugtes også eksternt, hvilket gør det muligt for forskere at manipulere dem let. Forskere kan simpelthen injicere encellede embryoner med DNA eller RNA for at redigere deres genomer eller for at skabe transgene dyr.
Zebrafisk er en ideel modelorganisme til undersøgelser af embryonal udvikling, da deres embryoner er helt gennemsigtige. Forskerne kan således nemt observere de tidlige udviklingsstadier, hvilket kan være vanskeligt hos andre hvirveldyrarter. Gennemsigtigheden gør det også muligt for forskerne let at observere fluorescensmærkede proteiner og væv for bedre at kunne vurdere udviklingsprocesser.
For eksempel har Stainier-laboratoriet undersøgt spredning og differentiering af β-celler i zebrafiskens bugspytkirtel under udvikling. De mærkede først disse celler ved hjælp af plasmider. Ved hjælp af HOTcre, en metode, der anvender varmeinduktion til at kontrollere den tidsmæssige ekspression af forskellige transgener, fastslog Stainer-gruppen derefter, at der faktisk er to forskellige populationer af β-celler, der stammer fra forskellige regioner af bugspytkirtlen og producerer forskellige niveauer af insulin (Hesselson et al, 2009).
Om ormen (Caenorhabditis elegans)
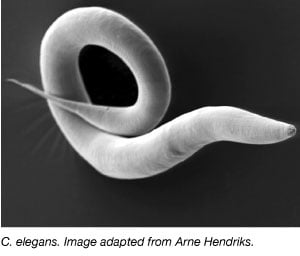 Om ormen, Caenorhabditis elegans, er blevet brugt flittigt som modelorganisme siden 1970’erne, da Sydney Brenner bragte den ind i laboratoriet for at studere neuronal udvikling (Brenner, 1973). C. elegans er små, gennemsigtige orme, der har en hurtig livscyklus og store kuldstørrelser. Størstedelen af C. elegans er også selvfertile hermafroditter, hvilket gør det let at gennemføre store eksperimenter over flere generationer. I lighed med andre modelorganismer er C. elegans-genomet også fuldstændig sekventeret, og over 60 % af de menneskelige gener har en ortolog i C. elegans, hvilket gør den ideel til at studere grundlæggende molekylærbiologiske processer.
Om ormen, Caenorhabditis elegans, er blevet brugt flittigt som modelorganisme siden 1970’erne, da Sydney Brenner bragte den ind i laboratoriet for at studere neuronal udvikling (Brenner, 1973). C. elegans er små, gennemsigtige orme, der har en hurtig livscyklus og store kuldstørrelser. Størstedelen af C. elegans er også selvfertile hermafroditter, hvilket gør det let at gennemføre store eksperimenter over flere generationer. I lighed med andre modelorganismer er C. elegans-genomet også fuldstændig sekventeret, og over 60 % af de menneskelige gener har en ortolog i C. elegans, hvilket gør den ideel til at studere grundlæggende molekylærbiologiske processer.
C. elegans er også meget velegnede til genetisk manipulation. Transgene dyr kan fremstilles ved blot at mikroinjicere DNA i ormen, f.eks. dyr, der udtrykker fluorescerende markører (Mello et al., 1991). Gener kan også let slås ned ved hjælp af RNA-interferens (RNAi) ved at fodre ormen med bakterier, der udtrykker specifikke plasmider (L4440), som indeholder det ønskede gen (Fire et al., 1998). Opdagelsen af RNAi i ormen belønnede faktisk indskyderne Andrew Fire og Craig Mello med en Nobelpris i 2006.
En af de store fordele ved C. elegans er, at de er gennemsigtige i hele deres levetid. Således kan enhver genetisk ændring, såsom ekspression af fluorescerende protein eller afbrydelse af et gen, let visualiseres i en levende organisme fra embryonal udvikling til voksenlivet. Denne evne til genetisk at manipulere og visualisere celler og væv gør det muligt for forskerne at foretage in vivo undersøgelser, hvilket kan være ret vanskeligt i andre modelorganismer. Orme er blevet brugt til at undersøge en lang række biologiske systemer og processer, herunder nervesystemet, udvikling, cellesignalering, aldring og mekanotransduktion for blot at nævne nogle få. For eksempel har Andrew Leifers laboratorium udnyttet ormen til at studere kalciumsignalering i hele den voksne hjerne ved hjælp af et plasmid, der udtrykker en genetisk kodet kalciumsensor, GCaMP6 (Nguyen et al., 2015). Hvis du er interesseret i C. elegans plasmider og ressourcer, så tjek Addgene’s Worm Expression side.
Søger du efter flere modelorganismer? Se anden del i den populære serie om modelorganismer, og læs om nye systemer, der er ved at blive udviklet til nye modelorganismer!
Brenner, Sydney. “Genetik af Caenorhabditis elegans”. Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. “Distinct populations of quiescent and proliferative pancreatic β-cells identified by HOTcre mediated labeling.” Proceedings of the National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. “The zebrafish reference genome sequence and its relationship to the human genome.” Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. “Drosophila-a versatile model in biology & medicine.” Materialer i dag 14.5 (2011): 190-195.
Mello, Craig C., et al. “Effektiv genoverførsel i C. elegans: ekstrachromosomal vedligeholdelse og integration af transformerende sekvenser.” The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. “Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans.” Proceedings of the National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan, og Charles D. Nichols. “Menneskelige sygdomsmodeller i Drosophila melanogaster og fluens rolle i opdagelse af terapeutiske lægemidler”. Pharmacological reviews 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.