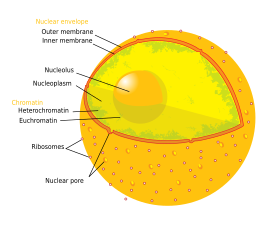
Kernen indeholder næsten hele cellens DNA, omgivet af et netværk af fibrøse intermediære filamenter og omsluttet af en dobbeltmembran kaldet “kernekuvertet”. Kerneomslaget adskiller væsken inde i kernen, kaldet nucleoplasma, fra resten af cellen. Størrelsen af kernen afhænger af størrelsen af den celle, den befinder sig i, idet en kerne typisk fylder ca. 8 % af det samlede cellevolumen. Kernen er den største organel i dyreceller:12 I pattedyrceller er kernens gennemsnitlige diameter ca. 6 mikrometer (µm).
Kernehinde og porer

Kernehulen består af to membraner, en indre og en ydre kernemembran. 649 Tilsammen tjener disse membraner til at adskille cellens genetiske materiale fra resten af cellens indhold og gør det muligt for kernen at opretholde et miljø, der er adskilt fra resten af cellen. På trods af at de to membraner ligger tæt sammen omkring en stor del af kernen, adskiller de to membraner sig væsentligt fra hinanden med hensyn til form og indhold. Den indre membran omgiver kerneindholdet og udgør dets definerende kant.:14 Indlejret i den indre membran binder forskellige proteiner de intermediære filamenter, der giver kernen dens struktur.:649 Den ydre membran omslutter den indre membran og er sammenhængende med den tilstødende endoplasmatiske retikulum-membran.:649 Som en del af den endoplasmatiske retikulummembran er den ydre kernemembran spækket med ribosomer, der aktivt oversætter proteiner på tværs af membranen. :649 Rummet mellem de to membraner, kaldet “det perinukleære rum”, er kontinuerligt med det endoplasmatiske retikulumlumen. :649
Kerneporer, som udgør vandige kanaler gennem kernehinden, er sammensat af flere proteiner, der kollektivt kaldes nukleoporiner. Porerne har en molekylvægt på ca. 60-80 millioner dalton og består af omkring 50 (i gær) til flere hundrede proteiner (i hvirveldyr).:622-4 Porerne har en samlet diameter på 100 nm; det hul, hvorigennem molekyler frit kan diffundere, er dog kun ca. 9 nm bredt på grund af tilstedeværelsen af reguleringssystemer i porens centrum. Denne størrelse tillader selektivt passage af små vandopløselige molekyler og forhindrer samtidig større molekyler, såsom nukleinsyrer og større proteiner, i at komme uhensigtsmæssigt ind i eller ud af kernen. Disse store molekyler skal i stedet transporteres aktivt ind i kernen. Kernen i en typisk pattedyrcelle vil have ca. 3000 til 4000 porer i hele sin kappe, som hver især indeholder en ottefoldssymmetrisk ringformet struktur på et sted, hvor den indre og den ydre membran smelter sammen. Til ringen er der knyttet en struktur kaldet kernekurven, som strækker sig ind i nukleoplasmaet, og en række filamentformede forlængelser, som når ind i cytoplasmaet. Begge strukturer tjener til at formidle binding til nukleare transportproteiner.:509-10
De fleste proteiner, ribosomale underenheder og nogle RNA’er transporteres gennem porekomplekserne i en proces, der formidles af en familie af transportfaktorer kendt som karyopheriner. De karyopheriner, der formidler bevægelse ind i kernen, kaldes også importiner, mens de karyopheriner, der formidler bevægelse ud af kernen, kaldes eksportiner. De fleste karyopheriner interagerer direkte med deres last, selv om nogle bruger adaptorproteiner. Steroidhormoner som kortisol og aldosteron samt andre små lipidopløselige molekyler, der er involveret i intercellulær signalering, kan diffundere gennem cellemembranen og ind i cytoplasmaet, hvor de binder nukleare receptorproteiner, der transporteres ind i kernen. Der fungerer de som transkriptionsfaktorer, når de er bundet til deres ligand; i fravær af en ligand fungerer mange af disse receptorer som histon-deacetylaser, der undertrykker genekspressionen.:488
Nuclear lamina
I dyreceller giver to netværk af intermediære filamenter kernen mekanisk støtte: Kernelaminaen danner et organiseret netværk på den indre side af konvolutten, mens mindre organiseret støtte gives på den cytosoliske side af konvolutten. Begge systemer giver strukturel støtte til kerneomslaget og forankringssteder for kromosomer og kerneporer.
Den nukleare lamina består hovedsagelig af laminproteiner. Som alle proteiner syntetiseres laminerne i cytoplasmaet og transporteres senere til kerneens indre, hvor de samles, inden de inkorporeres i det eksisterende netværk af kernelamina. Laminer, der findes på den cytosoliske side af membranen, såsom emerin og nesprin, binder sig til cytoskelettet for at give strukturel støtte. Laminer findes også inde i nukleoplasmaet, hvor de danner en anden regelmæssig struktur, kendt som det nukleoplasmatiske slør, som er synlig ved hjælp af fluorescensmikroskopi. Slørets egentlige funktion er ikke klarlagt, selv om det er udelukket fra nukleolus og er til stede under interfasen. Laminstrukturer, der udgør sløret, såsom LEM3, binder kromatin, og hvis deres struktur forstyrres, hæmmer det transkriptionen af proteinkodende gener.
Som komponenterne i andre intermediære filamenter indeholder lamin-monomeren et alfa-helikalt domæne, der bruges af to monomerer til at vikle sig om hinanden og danne en dimerstruktur, der kaldes en coiled coil. To af disse dimerstrukturer slutter sig derefter sammen side om side i et antiparallelt arrangement for at danne en tetramer kaldet et protofilament. Otte af disse protofilamenter danner et sideløbende arrangement, der er snoet for at danne et ropelagtigt filament. Disse filamenter kan samles eller adskilles på en dynamisk måde, hvilket betyder, at ændringer i filamentets længde afhænger af de konkurrerende hastigheder for tilføjelse og fjernelse af filamenter.
Mutationer i lamin-generne, der fører til defekter i filamentsamlingen, forårsager en gruppe sjældne genetiske lidelser, der kaldes laminopatier. Den mest bemærkelsesværdige laminopati er den familie af sygdomme, der er kendt som progeria, og som forårsager for tidlig aldring hos de ramte. Den nøjagtige mekanisme, hvormed de tilknyttede biokemiske ændringer giver anledning til den aldrende fænotype, er ikke velforstået.
Chromosomer

Cellekernen indeholder størstedelen af cellens genetiske materiale i form af flere lineære DNA-molekyler organiseret i strukturer kaldet kromosomer. Hver menneskecelle indeholder ca. to meter DNA:405 Under det meste af cellecyklussen er disse organiseret i et DNA-proteinkompleks, der kaldes kromatin, og under celledelingen kan kromatinet ses danne de veldefinerede kromosomer, som man kender fra en karyotype. En lille del af cellens gener er i stedet placeret i mitokondrierne.:438
Der findes to typer kromatin. Euchromatin er den mindre kompakte DNA-form og indeholder gener, der ofte udtrykkes af cellen. Den anden type, heterokromatin, er den mere kompakte form og indeholder DNA, der sjældent bliver transskriberet. Denne struktur kategoriseres yderligere i fakultativt heterokromatin, der består af gener, der kun er organiseret som heterokromatin i visse celletyper eller på visse stadier af udviklingen, og konstitutivt heterokromatin, der består af kromosomstrukturelle komponenter såsom telomerer og centromerer. I interfasen organiserer kromatinet sig i diskrete individuelle pletter, kaldet kromosomterritorier. Aktive gener, som generelt findes i den euchromatiske region af kromosomet, har tendens til at være placeret mod kromosomets territoriegrænse.
Antistoffer mod visse typer af kromatinorganisering, især nukleosomer, er blevet forbundet med en række autoimmune sygdomme, såsom systemisk lupus erythematosus. Disse er kendt som anti-kerneantistoffer (ANA) og er også blevet observeret sammen med multipel sklerose som en del af en generel dysfunktion i immunsystemet.
Nucleolus
Hovedartikel: Nucleolus
Videre information: Kernelegemer
 Et elektronmikroskopisk billede af en cellekerne, der viser den mørkt farvede nukleolus
Et elektronmikroskopisk billede af en cellekerne, der viser den mørkt farvede nukleolus

Nukleolus er den største af de diskrete tæt farvede, membranløse strukturer, kendt som kernelegemer, der findes i cellekernen. Den dannes omkring tandemrepeats af rDNA, DNA, der koder for ribosomalt RNA (rRNA). Disse regioner kaldes nucleolar organizer regions (NOR). Nukleolus’ vigtigste funktioner er at syntetisere rRNA og samle ribosomer. Nucleolus’ strukturelle sammenhængskraft afhænger af dens aktivitet, da ribosomal samling i nucleolus resulterer i en forbigående sammenslutning af nukleolære komponenter, hvilket letter yderligere ribosomal samling og dermed yderligere sammenslutning. Denne model understøttes af observationer af, at inaktivering af rDNA resulterer i sammenblanding af nukleolære strukturer.
I det første trin af ribosomsamlingen transskriberer et protein kaldet RNA-polymerase I rDNA, som danner en stor pre-rRNA-prækursor. Denne spaltes i to store rRNA-underenheder – 5,8S og 28S – og en lille rRNA-underenhed 18S.:328 Transkription, post-transkriptionel behandling og samling af rRNA sker i nukleolus med hjælp fra små nukleolære RNA-molekyler (snoRNA), hvoraf nogle er afledt af splejsede introner fra messenger RNA’er, der koder for gener relateret til ribosomal funktion. De samlede ribosomale underenheder er de største strukturer, der passerer gennem kerneporerne. 526
Ved observation i elektronmikroskopet kan man se, at nucleolus består af tre adskilte regioner: de inderste fibrillære centre (FC), omgivet af den tætte fibrillære komponent (DFC) (der indeholder fibrillarin og nucleolin), som igen er afgrænset af den granulære komponent (GC) (der indeholder proteinet nucleophosmin). Transkription af rDNA sker enten i FC eller ved grænsen mellem FC og DFC, og når rDNA-transkriptionen i cellen øges, påvises der derfor flere FC’er. Det meste af spaltningen og modificeringen af rRNA’er sker i DFC, mens de sidste trin, der involverer proteinmontering på de ribosomale underenheder, sker i GC.
Andre kernelegemer
| Strukturnavn | Strukturdiameter | Ref. |
|---|---|---|
| Cajallegemer | 0,2-2,0 µm | |
| Clastosomer | 0,2-0.5 µm | |
| PIKA | 5 µm | |
| PML-legemer | 0,2-1,0 µm | |
| Paraspeckles | 0.5-1,0 µm | |
| Speckles | 20-25 nm |
Udover nucleolus indeholder kernen en række andre kerneorganer. Disse omfatter Cajal-legemer, Gemini of Cajal-legemer, polymorphic interphase karyosomal association (PIKA), promyelocytic leukaemia (PML)-legemer, paraspeckles og splicing speckles. Selv om man kun ved lidt om en række af disse domæner, er de betydningsfulde, idet de viser, at nukleoplasmaet ikke er en ensartet blanding, men snarere indeholder organiserede funktionelle subdomæner.
Andre subkernestrukturer optræder som en del af unormale sygdomsprocesser. For eksempel er tilstedeværelsen af små intranukleære stave blevet rapporteret i nogle tilfælde af nemalin myopati. Denne tilstand skyldes typisk mutationer i aktin, og selve stavene består af muteret aktin samt andre cytoskeletale proteiner.
Cajal-legemer og ædelsten
En kerne indeholder typisk mellem en og ti kompakte strukturer kaldet Cajal-legemer eller coiled bodies (CB), hvis diameter måler mellem 0,2 µm og 2,0 µm afhængigt af celletype og -art. Når de ses under et elektronmikroskop, ligner de kugler af sammenfiltrede tråde og er tætte fordelingscentre for proteinet coilin. CB’er er involveret i en række forskellige roller i forbindelse med RNA-processering, især modning af små nukleolære RNA’er (snoRNA) og små nukleare RNA’er (snRNA) og modning af histon-mRNA’er.
Sammenfaldende med Cajal-legemer er Gemini af Cajal-legemer, eller perler, hvis navn er afledt af Gemini-konstellationen med henvisning til deres tætte “tvilling”-forhold til CB’er. Ædelsten ligner i størrelse og form CB’er og kan faktisk næsten ikke skelnes fra hinanden under mikroskopet. I modsætning til CB’er indeholder ædelsten ikke små nukleare ribonukleoproteiner (snRNP’er), men de indeholder et protein kaldet SMN (survival of motor neuron), hvis funktion er relateret til snRNP-biogenese. Man mener, at ædelstene hjælper CB’erne med snRNP-biogenese, selv om det også er blevet foreslået ud fra mikroskopiske beviser, at CB’er og ædelstene er forskellige manifestationer af den samme struktur. Senere ultrastrukturelle undersøgelser har vist, at gems er tvillinger af Cajal-legemer med forskellen i coilin-komponenten; Cajal-legemer er SMN-positive og coilin-positive, og gems er SMN-positive og coilin-negative.
PIKA- og PTF-domæner
PIKA-domæner, eller polymorfe interfasekaryosomale associationer, blev først beskrevet i mikroskopistudier i 1991. Deres funktion er fortsat uklar, selv om man ikke troede, at de var forbundet med aktiv DNA-replikation, transkription eller RNA-processering. De har vist sig ofte at være associeret med diskrete domæner, der er defineret ved tæt lokalisering af transkriptionsfaktoren PTF, som fremmer transkription af små nukleare RNA (snRNA).
PML-legemer
Promyelocytiske leukæmilegemer (PML-legemer) er sfæriske legemer, der findes spredt i hele nukleoplasmaet og måler omkring 0,1-1,0 µm. De er kendt under en række andre navne, herunder nukleært domæne 10 (ND10), Kremer-legemer og PML-onkogene domæner. PML-legemer er opkaldt efter en af deres hovedkomponenter, det promyelocytiske leukæmi-protein (PML). De ses ofte i kernen sammen med Cajal-legemer og spaltningslegemer. Pml-/- mus, som ikke er i stand til at danne PML-legemer, udvikler sig normalt uden tydelige bivirkninger, hvilket viser, at PML-legemer ikke er nødvendige for de fleste essentielle biologiske processer.
Splejsningsspeckles
Speckles er subkerne strukturer, der er beriget med pre-messenger RNA splejsning faktorer og er placeret i interchromatin regionerne i nucleoplasmaet i pattedyrceller. Ved fluorescensmikroskopi fremstår de som uregelmæssige, punktformede strukturer, der varierer i størrelse og form, og når de undersøges ved elektronmikroskopi, ses de som klynger af interchromatinkorn. Speckles er dynamiske strukturer, og både deres proteinkomponenter og RNA-proteinkomponenter kan cirkulere kontinuerligt mellem speckles og andre nukleare steder, herunder aktive transkriptionssteder. Undersøgelser af speckles’ sammensætning, struktur og opførsel har givet en model til forståelse af kernenes funktionelle opdeling af kernen og organiseringen af genudtrykkelsesmaskineriet, der splejser snRNP’er og andre splejsningsproteiner, der er nødvendige for pre-mRNA-processering. På grund af en celles skiftende krav ændres sammensætningen og placeringen af disse organer i overensstemmelse med mRNA-transkription og regulering via fosforylering af specifikke proteiner. Splejsningssplitterne er også kendt som nukleare pletter (nuclear speckles), splejsningfaktor-kompartmenter (SF-kompartmenter), interchromatin granule clusters (IGC’er) og B-snurposomer. B-snurposomer findes i amfibiens oocytkerner og i Drosophila melanogaster-embryoer. B-snurposomer optræder alene eller knyttet til Cajal-legemer i elektronmikrografer af amfibiekerner. IGC’erne fungerer som opbevaringssteder for splejsefaktorerne.
Paraspeckles
Paraspeckles, der blev opdaget af Fox et al. i 2002, er uregelmæssigt formede rum i interchromatinrummet i kernen. Først dokumenteret i HeLa-celler, hvor der generelt er 10-30 pr. kerne, er paraspeckles nu kendt for også at eksistere i alle humane primærceller, transformerede cellelinjer og vævsafsnit. Deres navn er afledt af deres fordeling i kernen; “para” er en forkortelse for parallel, og “speckles” henviser til de splejsningsspeckles, som de altid befinder sig i umiddelbar nærhed af.
Paraspeckles sekventerer nukleare proteiner og RNA og synes således at fungere som en molekylær svamp, der er involveret i reguleringen af genekspressionen. Desuden er paraspeckler dynamiske strukturer, der ændres som reaktion på ændringer i den cellulære metaboliske aktivitet. De er transkriptionsafhængige, og ved fravær af RNA Pol II-transkription forsvinder paraspecklen, og alle dens tilknyttede proteinkomponenter (PSP1, p54nrb, PSP2, CFI(m)68 og PSF) danner en halvmåneformet perinucleolær hætte i nukleolus. Dette fænomen er påvist i løbet af cellecyklussen. I cellecyklusen er paraspeckles til stede under interfasen og under hele mitosen undtagen telofasen. Under telofase, når de to datterkerner dannes, er der ingen RNA Pol II-transkription, så proteinkomponenterne danner i stedet en perinucleolær hætte.
Perichromatinfibriller
Perichromatinfibriller er kun synlige under elektronmikroskop. De er placeret ved siden af det transkriptionelt aktive kromatin og antages at være stederne for aktiv pre-mRNA-processering.
Clastosomer
Clastosomer er små kernekroppe (0,2-0,5 µm), der beskrives som værende tykke ringformede på grund af den perifere kapsel omkring disse kroppe. Navnet er afledt af græsk klastos, knækket, og soma, krop. Klastosomer er typisk ikke til stede i normale celler, hvilket gør dem svære at påvise. De dannes under høje proteolytiske betingelser i kernen og nedbrydes, når der sker et fald i aktiviteten, eller hvis cellerne behandles med proteasomhæmmere. Den ringe forekomst af clastosomer i cellerne tyder på, at de ikke er nødvendige for proteasomernes funktion. Osmotisk stress er også blevet vist at forårsage dannelse af clastosomer. Disse nukleare organer indeholder katalytiske og regulatoriske underenheder af proteasomet og dets substrater, hvilket indikerer, at clastosomer er steder for nedbrydning af proteiner.