Atomer og guld
I 1911 indledte Rutherford og kollegerne Hans Geiger og Ernest Marsden en række banebrydende eksperimenter, der fuldstændig ville ændre den accepterede model af atomet. De bombarderede meget tynde ark af guldfolie med hurtigt bevægende alfapartikler.

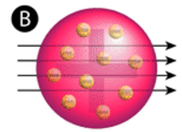

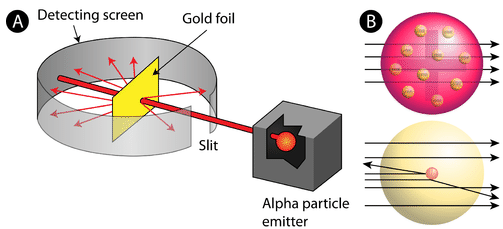
Figur \(\PageIndex{2}\) (A) Forsøgsopstillingen for Rutherfords guldfolieeksperiment: Et radioaktivt element, der udsendte alfapartikler, blev rettet mod et tyndt ark af guldfolie, der var omgivet af en skærm, som skulle gøre det muligt at detektere de afbøjede partikler. (B) Ifølge plum pudding-modellen (øverst) skulle alle alfapartiklerne have passeret gennem guldfolien med lille eller ingen afbøjning. Rutherford fandt, at en lille procentdel af alfapartiklerne blev afbøjet i store vinkler, hvilket kunne forklares ved et atom med en meget lille, tæt, positivt ladet kerne i centrum (nederst).
I henhold til den accepterede atommodel, hvor et atoms masse og ladning er jævnt fordelt i hele atomet, forventede forskerne, at alle alfapartiklerne ville passere gennem guldfolien med kun en lille afbøjning eller ingen afbøjning overhovedet. Som vist i figur \(\PageIndex{2}\) overraskende nok blev de fleste alfapartikler faktisk ikke afbøjet, men en meget lille procentdel (ca. 1 ud af 8000 partikler) prellede af på guldfolien i meget store vinkler. Nogle blev endda omdirigeret tilbage mod kilden. Ingen forudgående viden havde forberedt dem på denne opdagelse. I et berømt citat udbrød Rutherford, at det var “som om man havde affyret en 15-tommers granat mod et stykke væv, og den kom tilbage og ramte en.”
Rutherford måtte finde på en helt ny model af atomet for at kunne forklare sine resultater. Fordi langt størstedelen af alfapartiklerne havde passeret gennem guldet, ræsonnerede han, at det meste af atomet var tomt rum. I modsætning hertil måtte de partikler, der blev stærkt afbøjet, have oplevet en enormt kraftig kraft i atomet. Han konkluderede, at al den positive ladning og størstedelen af atomets masse måtte være koncentreret i et meget lille rum i atomets indre, som han kaldte kernen. Atomkernen er den lille, tætte, centrale kerne i atomet og består af protoner og neutroner.
Rutherfords atommodel blev kendt som kernemodellen. I kerneatomet er protonerne og neutronerne, som udgør næsten hele atomets masse, placeret i kernen i atomets centrum. Elektronerne er fordelt rundt om kernen og optager det meste af atomets volumen. Det er værd at understrege, hvor lille kernen er i forhold til resten af atomet. Hvis vi kunne sprænge et atom op til at være på størrelse med et stort professionelt fodboldstadion, ville kernen være på størrelse med en kugle.
Rutherfords model viste sig at være et vigtigt skridt i retning af en fuld forståelse af atomet. Den tog dog ikke helt stilling til elektronernes natur og den måde, hvorpå de indtog det store rum omkring kernen. For denne og andre indsigter blev Rutherford tildelt Nobelprisen i kemi i 1908. Desværre ville Rutherford have foretrukket at modtage Nobelprisen i fysik, fordi han anså fysik for at være bedre end kemi. Efter hans mening “er al videnskab enten fysik eller frimærkesamling.”