Man måste känna till några grundläggande egenskaper hos den givna föreningen och dess Lewisstruktur för att förstå dess molekylära geometri, polaritet och andra sådana egenskaper. SF4 är en kemisk formel för svaveltetrafluorid. Det är en färglös frätande gas som används vid syntesen av flera organofluorföreningar. SF4 är en ganska farlig förening men används flitigt i kemiska och farmaceutiska företag.
| Namn på molekyl | Svaveltetraflourid ( SF4) |
| Antal valenceelektroner i molekylen | 34 |
| Hybridisering av SF4 | sp3 hybridisering |
| Bindningsvinklar | 102 grader och 173 grader |
| Molekylär geometri för SF4 | Trigonal bipyramidal |
För att förstå denna molekyls egenskaper, såsom dess reaktivitet, polaritet med mera, måste man först känna till SF4:s Lewisstruktur.
Innehåll
SF4 Molekylgeometri
Det är lätt att förstå molekylgeometrin för en viss molekyl genom att använda molekylformeln eller VSEPR-modellen. En molekylformel hjälper till att känna till det exakta antalet och typen av atomer som finns i den givna föreningen. Här finns det en svavelatom och fyra fluoratomer i föreningen, vilket gör att den liknar molekylformeln för AX4E.
Molekyler med molekylformeln AX4E har en trigonal bipyramidal molekylgeometri. Här befinner sig två fluoratomer som bildar bindningar med svavelatomen i ekvatoriella positioner och de övriga två i axiella positioner. Eftersom det finns ett ensamstående par på den centrala atomen stöter det bort det bindande elektronparet, vilket ändrar formen lite grann och får den att se ut som en gungbräda. Elektronerna följer detta arrangemangsmönster enligt VSEPR-regeln för att minimera repulsionskrafterna mellan de ensamma elektronparen för att maximera molekylens stabilitet.
Därmed har SF4 en trigonal bipyramidal molekylgeometri.
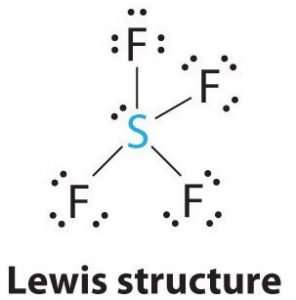
SF4 Lewisstruktur
Lewisstrukturen är en bildlig representation av bindningarna och valenceelektronerna i molekylen. De bindningar som bildas mellan två atomer avbildas med hjälp av linjer, medan de valenceelektroner som inte bildar några bindningar visas med prickar. De valenceelektroner som deltar i bildandet av bindningar kallas för bindningselektronpar, medan de elektroner som inte deltar eller bildar några bindningar kallas för icke-bindningselektronpar eller ensamma elektronpar.
Och för att rita Lewisstrukturen för SF4 måste vi först känna till det totala antalet valenceelektroner i denna molekyl.
Som man förmodligen kan se finns det en svavelatom i denna förening och fyra fluoratomer. För att känna till det totala antalet valenselektroner i denna förening måste vi känna till de båda atomernas valenselektroner var för sig.
- Valenceelektroner för svavel: 6
- Valenceelektroner för fluor: 4* (7)
( eftersom det finns fyra fluoratomer, måste vi ta hänsyn till alla atomers valenceelektroner)
Totalt antal valenceelektroner i SF4 = antal valenceelektroner i svavel + antal valenceelektroner i fluor
= 6 + 28
= 34 valenceelektroner
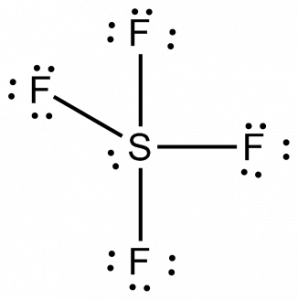
Nu när vi vet det totala antalet valenceelektroner, blir det lätt för oss att förstå bindningsbildningen mellan atomerna och även molekylens fullständiga arrangemang.
Svavel kommer att vara den centrala atomen i denna molekyl eftersom den är den minst elektronegativa, med fyra fluoratomer som bildar bindningar på sidorna av denna centrala atom. Varje fluoratom kommer att bilda en bindning med den centrala atomen, vilket innebär att det kommer att finnas fyra bindningar i molekylstrukturen som använder fyra valenselektroner hos fluoratomerna och fyra elektroner hos svavelatomen. Nu används alltså åtta valenceelektroner, vilket minskar antalet valenceelektroner från 34 till 24. Alla fluoratomer har sex valenceelektroner och den centrala atomen har två valenceelektroner.
Rita linjer mellan S och F för att visa bindningar och för ensamma elektronpar använder du prickar. Varje fluoratom kommer att ha tre par med 6 valenceelektroner ( visas som prickar) på atomen, tillsammans med en bindning med svavel. Däremot kommer den centrala atomen att ha två valenselektroner och fyra bindningar.
Därmed kommer den centrala atomen, svavel, att ha ett ensam elektronpar och fyra bindningspar av elektroner i Lewisstrukturen för SF4. Samtidigt kommer varje fluoratom att ha tre ensamma par.
Är SF4 polärt?
När vi väl känner till Lewisstrukturen och molekylgeometrin för den givna föreningen blir det lättare att skildra molekylens polaritet. Här leder ett ensamt par på den centrala svavelatomen och fyra bindningspar av elektroner till en asymmetrisk fördelning av elektroner på den centrala atomen.
Och eftersom molekylens form är som en gungbräda kan två fluoratomer upphäva varandras dipolmoment, men de övriga två kan inte göra det på grund av elektronernas placering. Och eftersom fluoratomer är mer elektronegativa än svavelatomer resulterar det i en ojämn fördelning av laddningen. Därför upphävs inte dipolmomentet, vilket gör molekylen polär. Så ja, SF4 är polär.
SF4-hybridisering
För att känna till hybridiseringen av SF4-molekylen ska vi först titta på elektrondensitetsområdena för den centrala atomen.
Svavlet har fyra bindningselektronpar och ett ensamt elektronpar, vilket gör att det totala antalet regioner för elektrontäthet är 5. Därför använder svavelatomen fem hybridiserade orbitaler, en 3s orbital, tre 3p orbitaler och en 3d orbital. Detta arrangemang av elektroner runt atomen och hybridiserade orbitaler leder till sp3d-hybridisering. Man kan också använda det steriska talet för att känna till hybridiseringen; här är det steriska talet 5 för svavelatomen.
Därmed har SF4 sp3d-hybridisering.
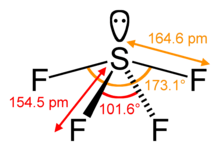
SF4 Bindningsvinklar och form
Den centrala svavelatomen bildar fyra bindningar med de närliggande fluoratomerna och har ett ensamt elektronpar. Fluoratomer på de ekvatoriella positionerna har bindningsvinklar på 102 grader och de axiella har 173 grader, vilket är lite annorlunda än den trigonala bipyramidala molekylgeometrin som leder till en vajerform.
Det ensamma paret på den centrala atomen leder till att bindningsvinklarna ändras från 120 grader till 102 grader för ekvatoriella fluoratomer och 173 grader i stället för 180 grader för axiella fluoratomer.
Slutsatser
För att sammanfatta alla egenskaper kan vi säga att,
- Svaveltetrafluorid har 34 valenselektroner, varav den bildar fyra kovalenta bindningar och ett ensamt elektronpar på den centrala atomen i sin Lewisstruktur.
- Det finns tre ensamma par på varje fluoratom.
- Den har en molekylär geometri av formeln AX4E; den bildar en se-saw-form och har en trigonal bipyramidal molekylär geometri.
- SF4 har sp3d-hybridisering och är polär i naturen.