Flaviviradae är en stor familj av virala patogener som orsakar allvarliga sjukdomar och dödlighet hos människor och djur. Familjen består av tre släkten: Flavivirus, Pestivirus och Hepacivirus. Släktet Flavivirus, som är det största av de tre, innehåller mer än 70 virus, däribland Denguevirus (DV), japanskt encefalitvirus (JEV), West Nile-virus (WNV), gula febern-virus (YFV) och zikavirus (ZIKV). Flavivirus uppvisar morfologisk enhetlighet med en isosaedrisk kapsid och ett tättslutande, spetsigt hölje. Kapsidens storlek är cirka 30 nm och hela virionen mäter 45 nm. Flavivirusens genom är ett enkeltrådigt sense-RNA med en storlek på cirka 10 kb. Det kodar för tre strukturella proteiner: kapsid (C-protein), membran (M, som uttrycks som prM, föregångaren till M och höljet (E-protein) och sju icke-strukturella proteiner: NS1, NS2A, NS2B, NS3, NS4A, NS4B och NS5 (figur 1 a.b).
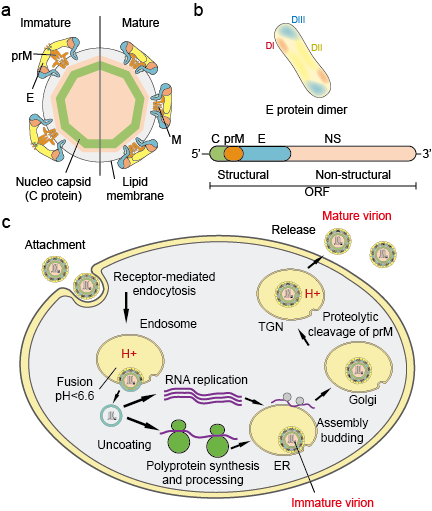
Figur 1. Flaviviruspartiklar (a), proteiner (b) och livscykel (c).
Bläddra bland alla Flavivirus-relaterade produkter
Flavivirus livscykel:
Virioner fäster sig på ytan av en värdcell och kommer därefter in i cellen genom receptormedierad endocytos (figur 1c). Flera primära receptorer och co-receptorer med låg affinitet för flavivirus har identifierats. Syrning av den endosomala vesikeln utlöser konformationsförändringar i virionen, fusion av virusmembran och cellmembran och nedmontering av partikeln. När väl genomet släpps ut i cytoplasman översätts det positivsinniga RNA:t till ett enda polyprotein som bearbetas co- och posttranslationellt av virala proteaser och värdproteaser. Replikationen av genomet sker på intracellulära membran. Viruset samlas på ytan av det endoplasmatiska retikulumet (ER) när de strukturella proteinerna och det nysyntetiserade RNA:t knoppas in i ER:s lumen. De resulterande icke-infektiösa, omogna virala och subvirala partiklarna transporteras genom trans-Golgi-nätverket (TGN). De omogna virionpartiklarna klyvs av värdproteaset furin, vilket resulterar i mogna, infektiösa partiklar. Subvirala partiklar klyvs också av furin. Mogna virioner och subvirala partiklar frigörs därefter genom exocytos.
Flavivirusepidemiologi:
Flavivirus som sprids av myggor överförs i naturen i en eller flera distinkta eller överlappande cykler som omfattar en myggvektor, i allmänhet Aedes-myggor för YFV och DENV och Culex-myggor för JEV och WNV, och en däggdjurs- eller fågelvärd. Överföring mellan myggor och ryggradsvärdar kallas horisontell överföring och orsakar sjukdom hos ryggradsdjur. I motsats till horisontell överföring kan myggburna flavivirus bibehållas i miljön genom vertikal, dvs. transgenerationell, överföring som gör det möjligt att sprida flavivirus enbart i myggor. Det mest direkta beviset för vertikal överföring av myggburna flavivirus kommer från isolering av virus från infekterade larver, förmodligen genom transovariell överföring. Denna observation stämmer överens med upptäckten av virusantigen i äggstocksvävnad hos infekterade myggor. (Figur 2)
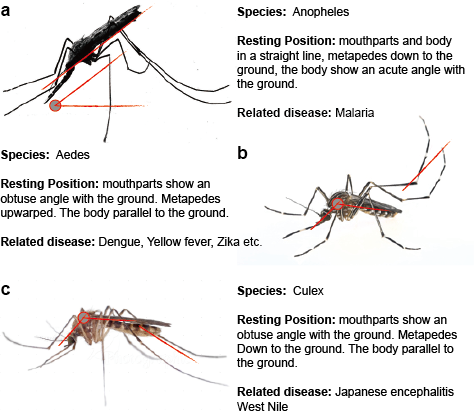
Figur 2. Tre typiska myggor som överför sjukdomar.
Flavivirus har en global utbredning, och vissa medlemmar av släktet utgör ett stort folkhälsoproblem (t.ex. gula febern-virus , denguevirus , West Nile-virus och japanskt encefalitvirus ), med hög morbiditet och/eller mortalitet. Under det senaste decenniet har flavivirus uppvisat en ökad prevalens och utgör en risk för mer än 3 miljarder människor i världen, vilket gör dem till ett paradigm för nya sjukdomar.
Under de senaste 50 åren har många flavivirus, t.ex. dengue-, West Nile- och gula febervirus, uppvisat dramatiska ökningar av incidensen, sjukdomens allvarlighetsgrad och/eller det geografiska utbredningsområdet. Viruspatogener som härrör från miljön uppvisar relativt enhetliga epidemiologiska egenskaper. Myggor, fästingar och bitande flugor fungerar som vektorer för de flesta virussjukdomar hos människor. Sjukdomar hos människor uppstår när vektorerna är aktiva, vanligtvis under vår, sommar och höst i tempererat klimat, och uppvisar ofta distinkta epidemiologiska egenskaper som motsvarar vektorns livsmiljö (figur 3).
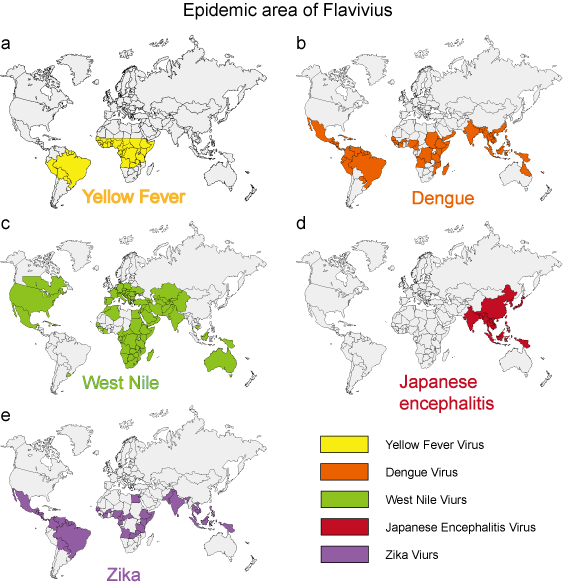
Figur 3. Det epidemiska området för fem typiska flavivirus.
Manifestationer:
Flavivirus varierar kraftigt när det gäller deras patogena potential och mekanismer för att framkalla sjukdomar hos människor (tabell 1). Infektion av människor med både myggburna och fästingburna flavivirus initieras genom att virus deponeras genom huden via saliven från en infekterad leddjur. Viruset replikeras lokalt och i regionala lymfkörtlar och ger upphov till viremi. Viktiga syndrom och exempel på orsakande flavivirus är: encefalit (japansk encefalit), febril sjukdom med utslag (denguevirus), hemorragisk feber (Kyasanur Forest disease virus och ibland denguevirus) och hemorragisk feber med hepatit (gula febervirus).
Tabell 1 Översikt över de viktigaste flavivirusen
| Virusarter | Överföringsvektor | Geografisk spridning | Syndrom. |
|---|---|---|---|
| Gula febern | Myggor (Aedes) | Se figur 3a | Hemorragisk feber |
| Denguefeber | Myggor (Aedes, Stegomyia) |
Se figur 3b | Denguesyndrom, DHF, DSS |
| West Nile feber | Myggor (Culex), fästingar (Argasidae) |
Se figur 3c | Dengue syndrom, encefalit |
| Japansk encefalit | Myggor (Culex) | Se figur 3d | Encefalit |
| Zika | Myggor (Aedes) | Se figur 3e | Mikrocefali |
Diagnostik:
Den kliniska diagnosen av de olika flavivirusen är inte tillförlitlig på grund av de ospecifika symtomen, och laboratoriediagnostik är obligatorisk för att bekräfta sjukdomens etiologi. Vid flavivirusinfektioner kan viruset hittas i serum eller plasma, i allmänhet 2-7 dagar efter sjukdomsdebuten, och varaktigheten av denna viremiska fas och den påvisade virusbelastningen varierar beroende på det infekterande viruset (tabell 2). Vanligtvis uppstår ett immunsvar mot infektionen 5-7 dagar efter insjuknandet, med IgM-antikroppar som når sin högsta nivå efter 15 dagar. Dessa IgM-antikroppar kan hålla i sig från månader (som i fallet med DENV) till år (som i fallet med WNV-infektioner). IgG-antikroppar uppträder efter 8-10 dagar från insjuknandet och kan påvisas under hela livet. De särskilda egenskaperna hos varje flavivirus påverkar markant de diagnostiska algoritmer som ska tillämpas vid identifiering av flavivirala infektioner. I allmänhet har många laboratorier valt serologiska tester för att diagnostisera infektioner orsakade av flavivirus, på grund av deras noggrannhet och tillgången till kommersiella tester som bygger på höga kvalitetsstandarder. Förekomsten av serologiska korsreaktioner mellan de olika virusen och den tid som krävs för att påvisa antikroppar vid vissa infektioner försvårar dock serologins användbarhet som ett diagnostiskt verktyg för akuta flavivirusinfektioner. Viral isolering utgör den ”gyllene standarden” för att uppnå en bekräftad flavivirusdiagnos.
Bläddra bland alla ELSIA-kit för flavivirus och RDT-produkter för flavivirus
Tabell 2. Algoritmer för diagnostik av flavivirus.
| Akut fas | Konvalescent fas | Företrädesvis prov† | Förväntad virusbelastning | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, virusisolering | IgM, IgG | Serum, plasma och vävnad | Hög |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, virusisolering | IgM, IgG | Serum, plasma, CSF och PBMCs | Upp till 106 virioner/ml |
| WNV | RT-PCR, IgM, IgG | IgM, IgG | CSF och serum | Låg |
| JEV | RT-PCR, IgM, IgG | IgM, IgG | CSF, serum, blod och PBMCs | Låg |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF och serum | Låg |
| Gould E A, Solomon T. Patogena flavivirus . The Lancet, 2008, 371(9611): 500-509. | |
| Gaunt M W, Sall A A A, de Lamballerie X, et al. Fylogenetiska relationer mellan flavivirus korrelerar med deras epidemiologi, sjukdomsassociation och biogeografi . Journal of General Virology, 2001, 82(8): 1867-1876. | |
| Kuno G, Chang G J J, Tsuchiya K R, et al. Phylogeny of the genus Flavivirus . Journal of virology, 1998, 72(1): 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle. Nature Reviews Microbiology, 2005, 3(1): 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Flavivirus-mosquito interaktioner. Viruses, 2014, 6(11): 4703-4730. |