Multiplex ligation-dependent probe amplification (MLPA) är en molekylär teknik som utvecklades av MRC-Holland 2002. MLPA är i korthet en känslig teknik som gör det möjligt att snabbt och effektivt kvantifiera nukleinsyresekvenser. Den används i många laboratorier över hela världen och kan användas för att upptäcka ändringar i antalet kopior (t.ex. deletioner eller duplikationer) av en gen, identifiera metyleringsstatusen för DNA, upptäcka polymorfismer av enskilda nukleotider (SNP) och punktmutationer samt kvantifiera mRNA. Därför används den inom många forsknings- och diagnostiska områden, t.ex. cytogenetik, cancerforskning och humangenetik.
Hur fungerar den?
MLPA består av följande steg (figur 1):
- Denaturering
- Hybridisering
- Ligering
- Amplifiering (genom PCR)
- Fragmentseparation och dataanalys
Figur 1 – Visualisering av MLPA-tekniken (anpassad från Schouten, Jan P., et al.1). Vi kan också observera ett typiskt elektroherogram som erhållits genom MLPA-analys och som visar en deletion av exon 46 (röd pil). (Elektroherogram anpassat från https://commons.wikimedia.org/wiki/File:MLPA_in_GeneMarker.jpg)
1-Denaturering och 2 – Hybridisering
Denaturering innebär att de glödgade DNA-strängarna separeras, så att dubbelsträngat DNA blir enkelsträngat.
Hybridisering innebär att DNA-provet hybridiseras till specifika prober. Eftersom det är en multiplexteknik kan man analysera varje prov med upp till 60 prober samtidigt och därmed rikta in sig på olika platser!
Dessa prober har en primersekvens som binder till PCR-primern i amplifieringsprocessen. Alla olika prober kommer att ha samma primerbindningssekvens. Dessutom har proberna också en hybridiseringssekvens som är komplementär till målplatsen och som gör det möjligt för proben att binda till DNA. Båda proberna kommer att hybridisera på intilliggande platser på DNA-strängen.
En av proberna från paret innehåller en stuffersekvens, som är olika lång för varje målplats. Längden på stuffersekvensen ändras mellan olika prober, vilket möjliggör multiplexering. Du kan alltså förvänta dig att varje amplifieringsprodukt har en unik längd!
3-Ligering
Ligeringssteget binder ihop de två proberna. I detta steg används ett särskilt enzym som kallas DNA-ligas. Det binder proberna som redan är hybridiserade på intilliggande platser i DNA-strängen på målplatsen. Det ligas som används i MLPA-protokoll är ligas-65, ett NAD-beroende ligasenzym, som också kan vara användbart i andra tillämpningar.
Nu står frågan: Om vårt mål är att ligera de båda proberna, varför är de då separata molekyler till att börja med? Jo, båda proberna innehåller bindningsställen för PCR-primers. Detta innebär att om vi skulle använda proberna som en enda molekyl skulle vi få en amplifieringsprodukt, även utan DNA-målplatsen, vilket skulle ge oss ospecifik amplifiering. Enzymet ligas är extremt specifikt: om det finns några missmatchningar mellan proben och målplatsen kommer ligaset inte att kunna binda proberna och ingen amplifiering kommer att ske. Följaktligen upptäcker MLPA specifika punktmutationer och skiljer till och med mellan pseudogener och den verkliga målgenen.
4-Amplifiering
Nästa steg är amplifiering, som i huvudsak är en polymeraskedjereaktion (PCR) (tabell 1). För PCR-steget tillsätts ett polymeras, dNTPs och en framåt- och bakåtriktad primer. Eftersom alla proberna har samma PCR-primerssekvens kommer det endast att vara nödvändigt att lägga till ett par universella primers för att studera alla våra mål. Den framåtriktade primern är fluorescerande märkt, vilket möjliggör visualisering och kvantifiering under analysen.
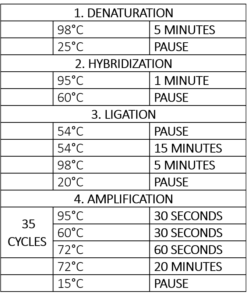
Tabell 1 – Thermocyclerprogram för MLPA-reaktionen
5-Fragmentseparation och dataanalys
Efter amplifiering separeras fragmenten genom kapillärelektrofores. Kapillärelektrofores separerar fragmenten utifrån deras längd och visar fragment av olika längd som toppmönster, ett så kallat elektroferogram (figur 1). Varje amplikon har en annan känd storlek på grund av stuffer-sekvensen på varje specifik sond, och därför kan varje amplikon kvantifieras under dataanalysen.
De data som erhålls genom kapillärelektrofores kommer att utgöra indata för analysen. MRC- Holland tillhandahåller en gratis programvara för dataanalys – Coffalyser.
Genom att jämföra varje prov med en uppsättning referensprover kan vi få fram ett sondförhållande. Detta sondförhållande informerar oss om hur många kopior en gen har. Eftersom de flesta mänskliga gener är diploida kommer förhållandet att vara 1,0 om provet uppvisar två kopior, dvs. provsonderna har erhållit samma antal gener som referensprovet.
Hursomhelst, om förhållandet är 0,5 fanns det bara en kopia av genen hos individen, vilket troligen innebär en heterozygot deletion av målgenen. Om förhållandet å andra sidan är 1,5 finns det troligen en heterozygot duplikation av en gen.
MRC-Holland erbjuder många olika kit som kan ha lösningen på dina problem. Men om du försöker hitta något lite mer obskyrt, eller studera något som inte finns i något kit, kan du designa dina egna prober. Jag råder dig att noggrant läsa protokollet för syntetisk sonddesign.
Fördelar med MLPA
- MLPA är en mycket känslig, robust och höggenomströmningsteknik.
- Den kan skilja mellan punktmutationer samt duplicering/utplåning av gener. Därför har den en stor fördel jämfört med andra tekniker, som sekvensering, som bara kan hitta punktmutationer. Dessutom kan MLPA, till skillnad från FISH, upptäcka små genförändringar.
- Resultaten är tillgängliga inom 24 timmar och eftersom det är en multiplexreaktion möjliggör den en snabb och effektiv insamling av information.
- Små ändringar i MLPA-protokollet kan möjliggöra en mängd olika tillämpningar. Genom att till exempel lägga till ett extra digestionssteg kan MLPA också användas för att upptäcka metyleringsmönster i DNA (Methylation specific-MLPA (MS-MLPA)).
Begränsningar av MLPA
- MLPA är extremt känslig för föroreningar. Därför måste man vara ytterst försiktig när man förbereder prover och utför tekniken.
- Det kan förekomma en minskning av signalen från en sond på grund av en sällsynt polymorfism eller mutation, och det kan då vara nödvändigt att testa den med andra tekniker.
MLPA är en utmärkt teknik som kan användas för varierande tillämpningar och ger resultat snabbt och effektivt. Den kommer dock inte utan hicka. Som vi alla vet har varje teknik vissa nackdelar, och varje tillämpning måste studeras noggrant för att se till att vi använder den mest effektiva och känsliga tekniken.
Har du någonsin använt MLPA? Vad anser du om denna teknik?