- Introduktion
- Metoder
- Musfibroblaster
- Patienternas diagnoser och mediciner
- Experimentella upplägg
- Mätning av effektiv refraktärperiod
- Stock Solutions and Drug Application
- Analys av aktionspotentialparametrar
- Statistisk analys
- Resultat
- Effekter av MK-0448 på Kv1.5 ström
- Effekter av MK-0448 på aktionspotentialer
- Diskussion
- Studiebegränsningar
- Slutsats
- Intressekonfliktförklaring
- Acknowledgments
Introduktion
I sökandet efter säkrare antiarytmiska läkemedel för behandling av förmaksflimmer (AF), selektiva hämmare av IKur har utformats som förmakselektiva klass III antiarytmiska medel med terapeutisk potential vid förmaksflimmer. Eftersom de är inriktade på Kv1.5-kanalerna, som endast är funktionella i förmaken (Mays et al., 1995), anses dessa medel sakna proarytmiska effekter i ventrikeln och har därför rönt stort intresse i forskarvärlden (för en översikt se Ford och Milnes, 2008; Tamargo et al, 2009; Ravens, 2010; Ravens och Wettwer, 2011).
Vi har tidigare undersökt de elektrofysiologiska effekterna av flera IKur-hämmare, inklusive 4-aminopyridin, AVE0118, XEN-D0101, som alla förhöjde platåfasen hos mänskliga högra förmaksaktionspotentialer (APs) inspelade i trabekel i förmaksappendix som erhållits från patienter i sinusrytm (SR) eller AF (Wettwer et al, 2004; Christ et al., 2008; Ford et al., 2013). Intressant nog var aktionspotentialens varaktighet (APD90) och effektiv refraktärperiod (ERP) förkortade i SR men förlängda i AF-preparat.
Nyligen publicerades resultat för första gången i människa med en annan selektiv Kv1.5-hämmare, MK-0448 (Pavri et al., 2012). MK-0448 lyckades inte påverka den relativa förmaks-ERP hos friska frivilliga, och författarna drog slutsatsen att IKur-blockering inte kan förväntas utöva terapeutiskt användbara antiarytmiska effekter vid AF. Eftersom ingenting är känt om effekterna av MK-0448 i ex-vivo mänsklig förmaksvävnad, undersökte vi dess effekter på formerna av förmaks-AP och ERP med standardmikroelektrodeteknik i trabeculae som isolerats från höger förmaksappendix hos patienter i SR och AF, som var tvungna att genomgå öppen hjärtkirurgi. I SR-preparat höjde MK-0448 platåpotentialen och förkortade APD och ERP vid 1 Hz som förväntat av IKur-blockerare. Vi bekräftar också att MK-0448 effektivt blockerar Kv1.5-strömmen i musfibroblaster som stabilt uttrycker hKCNA5-genen.
Metoder
Musfibroblaster
HK2BN9-celler som uttrycker humana Kv1.5-kanaler tillhandahölls vänligen av Dr Tamkun (Snyders et al., 1993). Cellerna odlades i Dulbeccos modifierade eagle-medium som innehöll 10 % fetalt kalvserum och 1 % penicillin/streptomycin under atmosfäriska förhållanden med 5 % CO2 vid 37 °C. 250 μg/ml G418 tillsattes till mediet för selektion. Uttryck av Kv1.5 inducerades genom att behandla cellerna med 1 μM dexametason 24 timmar före ett experiment. Cellerna studerades med en standarduppställning för spänningsklampning av hela celler med en enda elektrod enligt tidigare beskrivning (Radicke et al., 2006). Badlösningen innehöll (i mM): NaCl 150, KCl 5,4, MgCl2 2, CaCl2 2,0, HEPES 10, glukos 10, pH 7,4, temperatur 25 °C. Elektrolytlösningen innehöll (i mM): KCl 40, kaliumaspartat 80, NaCl 8, CaCl2 2, MgATP 5, EGTA 5, GTP 0,1, HEPES 10, pH 7,4 justerat med KOH. Seriemotstånden var mellan 5 och 10 MΩ och kompenserades med upp till 85 %. Cellkapacitansen mättes med små hyperpolariserande klämsteg från -40 mV till -42 mV, medelvärdet var 20,8 ± 1,2 pA/pF (n = 33) och skiljde sig inte mellan celler som testades vid 0,5 och 3 Hz. Generering av spänningsklampimpulser, datainsamling och analys utfördes med programvaran ISO2 (MFK, Niedernhausen, Tyskland). Data korrigerades inte för junctionpotentialen som var 11,7 mV, beräknad med programvaran JPCalc (P.H. Barry, Sydney, Australien).
Patienternas diagnoser och mediciner
Atriell vävnad erhölls från patienter som genomgick hjärtkirurgi på grund av kranskärls- eller klaffsjukdom. Alla patienter gav skriftligt informerat samtycke. Studien godkändes av den etiska kommittén vid den medicinska fakulteten vid Dresdens tekniska universitet (nr EK790799). Patienterna anges i tabell 1. Studien omfattade 13 läkemedelsexponerade och 9 TMC-preparat från patienter i sinusrytm (SR-gruppen), 9 läkemedelsexponerade och 9 TMC-preparat från patienter med permanent förmaksflimmer (AF-gruppen, definierad som permanent förmaksflimmer i ≥6 månader vid tidpunkten för vävnadssamlingen) och 3 läkemedelsexponerade preparat från patienter med intermittent förmaksflimmer (episoder av spontant avslutande förmaksflimmer som varar i några sekunder upp till flera timmar). Patienternas medicinering omfattade vanligtvis ACE-hämmare, β-blockerare, nitrater, lipidsänkande läkemedel och diuretika.
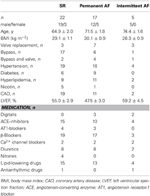
Tabell 1. Egenskaper hos patienter vars trabekler användes för läkemedelsexponering.
Experimentella upplägg
Små bitar (50-100 mg i vikt) av mänskliga högra förmaksändelser transporterades till laboratoriet i en speciell Ca2+-fri transportlösning vid 20-25°C, sammansättning i mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgSO4, 50 taurin, 5 MOPS, 30 2,3-butan-dionmonoxim (BDM), pH 7,0. Antingen fritt löpande trabekler (<1 mm i diameter och 2-5 mm i längd) eller trabekler tillsammans med fäst förmaksvägg dissekerades och monterades på botten av ett 5 ml organbad som perfunderades med 50 ml recirkulerande, syresatt Tyrode-lösning med en flödeshastighet på 7 ml/min vid 36 ± 1 °C (sammansättning i mM: 126.7 NaCl, 0,42 NaH2PO4, 22 NaHCO3, 5,4 KCl, 1,8 CaCl2, 1,5 MgCl2, pH 7,4 vid jämvikt med 5 % CO2 i O2). Preparaten stimulerades elektriskt vid en basalfrekvens på 1 Hz med isolerade fyrkantiga stimuli av 1 ms varaktighet, 2 gånger tröskelintensiteten. Transmembranpotentialer registrerades med glasmikroelektroder fyllda med 2,5 M KCl. Elektrodernas spetsmotstånd låg mellan 20 och 80 MΩ. Både timing av de drivande stimuli och förbearbetning av transmembranpotentialsvaren utfördes med ett datorstödt system för inspelning av aktionspotential (Wettwer et al., 2004). Inspelningsprogrammet Chart for Windows, version 7.3.5, (ADInstruments Pty Ltd., Castle Hill, Australien) användes för analys av aktionspotentialparametrar.
Varje experiment föregicks av en 60 minuters ekvilibreringsperiod under vilken preparaten tilläts stabilisera sig och resterande BDM tvättades bort fullständigt. De numeriska värdena för de viktigaste aktionspotentialparametrarna måste förbli konstanta, dvs. inom ett intervall på ±5 % under minst 10 min. När mikroelektroden rörde sig ut ur cellen gjordes en ny inpunktion på samma ställe och experimentet fortsatte om den nya inspelningen inte skiljde sig från den gamla genom visuell bedömning och visade mindre än 3 % skillnad vid den slutliga numeriska analysen.
Mätning av effektiv refraktärperiod
Effektiv refraktärperiod (ERP) mättes genom ett enda extra stimulus som interpolerades efter tåg av 10 regelbundna stimuleringspulser vid basalfrekvensen 1 Hz med minskande intervaller i steg om 5 ms från den sista regelbundna pulsen tills det extra stimuluset inte lyckades framkalla en aktionspotential. Efter en kort återhämtningsperiod exponerades preparatet för MK-0448 (3 μM) vid 1 Hz i ytterligare 60 minuter och ERP testades en gång till i närvaro av läkemedlet.
Stock Solutions and Drug Application
MK-0448 syntetiserades av Xention Ltd. Cambridge UK. I några experiment tillämpades MK-0448 i kumulativt ökande koncentrationer genom att direkt tillsätta alikvots från en 10 mM-stocklösning med DMSO som lösningsmedel till 50 ml av det cirkulerande badmediet. DMSO-koncentrationen översteg aldrig 0,2 %, en koncentration som inte medförde någon signifikant förändring när den applicerades ensam. Preparaten exponerades för varje koncentration av MK-0448 i 20 minuter.
Analys av aktionspotentialparametrar
Följande standardparametrar för förmaks-AP analyserades: De viktigaste parametrarna för atriella förmaksampuller var följande: vilande membranpotential, RMP (mV), aktionspotentialamplitud, APA (mV), aktionspotentialens varaktighet vid 20, 50 och 90 % av repolariseringen, APD20, APD50 och APD90 (ms), maximal depolarisationshastighet, dV/dtmax (V/s) och ”platåpotentialen”, definierad som den genomsnittliga absoluta membranpotentialen (mV) i tidsfönstret mellan 20 och 30 % av APD90 (PLT20). Preparat med vilopotentialer som var mindre negativa än -65 mV och amplituder under 80 mV valdes bort.
Statistisk analys
GraphPad Prism (version 4.03) användes för statistisk analys. I koncentrationsresponskurvorna (se tabell 2) jämfördes de värden som erhölls vid ökande koncentrationer med kontroller före läkemedlet med hjälp av One-Way ANOVA följt av Bonferronis multipla jämförelsetest. De enskilda aktionspotentialparametrarna för SR- och permanenta AF-preparat i närvaro av 3 μM MK-0448 jämfördes med kontrollerna före läkemedlet med hjälp av parade Student’s t-test (se tabell 3). Skillnader anses vara statistiskt signifikanta för P < 0,05.

Tabell 2. Koncentrationsberoende effekter av MK-0448 vid 1, 3 och 10μM (1 Hz).
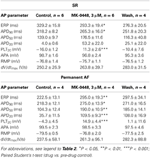
Tabell 3. Effekter av MK-0448 (3μM) på parametrar för aktionspotential och effektiv refraktärperiod (ERP) hos mänskliga höger förmaks trabekel från patienter i SR och AF (stimuleringsfrekvens 1 Hz).
Resultat
Effekter av MK-0448 på Kv1.5 ström
Kv1.5 strömmar, som mättes under stegpotentialförändringar från en hållpotential på -60 mV till olika testpotentialer mellan -40 och +80 mV hade en tröskelpotential på -30 mV, aktiverades snabbt och inaktiverades knappast inom 500 ms (data visas inte). För drogtestning valde vi spänningsklampsteg med 50 ms varaktighet till +50 mV som framkallade genomsnittliga strömamplituder på 85,0 ± 10,5 pA/pF vid 0,5 Hz (n = 16) och 110,6 ± 16,9 pA/pF vid 3 Hz n = 17, P = 0,2133). MK-0448 (100 nM) blockerade Kv1.5-strömsamplituden på ett frekvensberoende sätt (figur 1A). Vid 0,5 Hz nådde blockeringen ett steady-state inom 5-10 min efter läkemedelstillförsel och återhämtade sig delvis under en 5-minutersperiod under vilken cellen kontinuerligt klämdes vid -60 mV (figur 1B). När cellerna exponerades för MK-0448 under en 5-minutersperiod som hölls vid -60 mV, för att bibehålla kanalerna i stängt tillstånd, var IKv1.5 i den första pulsen efter vila inte annorlunda än före vila. Efterföljande pulser i närvaro av läkemedlet visade en snabbt begynnande hämning, som ökade med varje puls tills det nådde steady-state (figur 1C). MK-0448 (100 nM) minskade IKv1.5 från 82,3 ± 31,5 pA/pF till 22,4 ± 6,0 pA/pF (n = 5) inom 3 minuter av kontinuerliga spänningsklampsteg vid 0,5 Hz, och från 113,8 ± 52,7 pA/pF till 12,9 ± 2,5 pA/pF vid 3 Hz (n = 4). Dessa resultat är förenliga med att MK-0448-hämning av Kv1.5 är beroende av kanalaktivering.

Figur 1. Effekter av MK-0448 på Kv1.5 strömmar mätt i HK2BN9-celler vid 25 °C. (A) Spänningsklampning och strömspår erhållna före (svart) och efter superfusion av celler med 100 nM MK-0448 (grönt) i 10 min. Hastigheten på spänningsklampspulserna anges. (B) Start av den blockerande effekten av MK-0448 (100 nM) på toppströmmen av Kv1.5 och återhämtning från blockering under 5 minuter vid en hållpotential på -60 mV. Individuella strömspår högst upp erhölls vid de tidpunkter som anges med små bokstäver i dagboksdiagrammet längst ned. (C) Start av läkemedelseffekten efter exponering under 5 min kontinuerlig klämning vid -60 mV. Stegfrekvens: 3 Hz.
Effekter av MK-0448 på aktionspotentialer
Aktionspotentialer som registrerats i höger förmaks trabekel från patienter i SR hade den typiska spik- och kupolkonfigurationen (figur 2), i permanent AF-vävnad var formen triangulär och är ett resultat av elektrisk remodellering . Den mest slående koncentrationsberoende effekten av MK-0448 (1-10 μM) på SR-aktionspotentialer vid den basala stimuleringsfrekvensen 1 Hz var en kraftig förhöjning av platåpotentialen (PLT20) (figur 2; tabell 2). I denna uppsättning experiment tenderade APD90 att förkortas (ej signifikant) medan APD20 och APD50 förlängdes och nådde nivån för statistisk signifikans endast vid den högsta koncentrationen (se tabell 2). Vilande membranpotential (RMP), aktionspotentialamplitud (APA) och maximal depolarisationshastighet (dV/dtmax) påverkades inte signifikant av MK-0448 (se tabell 2). Före och efter läkemedelsbehandlingen följde alla preparat stimuleringen, även vid den högsta koncentrationen.
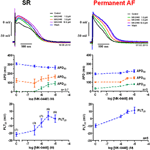
Figur 2. Koncentrationsberoende effekter av MK-0448 på aktionspotentialer som registrerats i höger förmaks trabekel från patienter i sinusrytm (SR) och permanent förmaksflimmer (AF). Överst: Individuella spårningar för typiska experiment, inspelade i närvaro av ökande koncentrationer av substansen (se färgkod). Exponeringstid vid varje koncentration: 20 min; kontroll: kontroll före läkemedel. I mitten och botten: Medelvärden ± s.e.m. från 7 experiment i SR och 5 i AF, av aktionspotentialens varaktighet vid 90, 50 och 20 % av repolariseringen (APD90, APD50 och APD20) och platåpotential (PLT20). Stimuleringsfrekvens: Stimuleringsfrekvens: 1 Hz. Observera att inte alla preparat exponerades för hela koncentrationsområdet (antalet preparat anges inom parentes).
Effekterna av MK-0448 på ERP studerades endast vid 3 μM. Denna koncentration gav upphov till maximala förändringar inom 40-50 minuter efter läkemedelstillförsel, och dessa var delvis reversibla efter 60 minuters utspolning. I 6 preparat från patienter i SR, APD90 och ERP förkortades signifikant (figur 3; tabell 3). Liknande effekter observerades i 2 preparat från patienter med intermittent AF (figur 3).
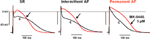
Figur 3. Effekter av MK-0448 (3 μM, rött spår, pil) på aktionspotentialer som registrerats i höger förmaks trabekel från patienter med sinusrytm (SR), intermittent förmaksflimmer (iAF) och kroniskt förmaksflimmer (AF). Originalinspelningar från ett preparat i varje grupp visas. c, kontroll före läkemedel (svart spår). Stimulationsfrekvens 1 Hz.
I permanenta AF-trabekler höjde MK-0448 också signifikant platåpotentialen i liknande utsträckning som i SR, men i motsats till SR förlängdes APD vid de tre analyserade repolariseringsnivåerna (figurerna 2, 3; tabell 3). I permanenta AF-preparat påverkades inte heller APA, RMP och dV/dtmax signifikant, med undantag för RMP med 10 μM MK-0448.
På grund av begränsad tillgång kunde vi bara studera effekterna av MK-0448 i 2 trabekel från patienter med intermittent AF, en typisk inspelning visas i figur 3; 3 andra användes som TMC:er. I likhet med resultaten i SR-preparat förkortade MK-0448 APD90 och ERP i de 2 intermittenta AF-preparaten.
I tidsmatchade kontrollexperiment med vävnad från patienter med SR, intermittent AF och AF förändrades inte aktionspotentialparametrarna nämnvärt (data visas inte).
Diskussion
De karakteristiska förändringarna i aktionspotentialparametrar som observerats med MK-0448 i humana högerförmaks-trabekler är förenliga med blockering av Kv1.5-kanaler som tidigare rapporterats för flera läkemedel.
MK-0448 beskrevs som mycket selektivt för uttryckt Kv1.5-kanaler jämfört med ett stort antal standard jonkanaler i hjärtat. hERG-kanaler är cirka 10 000 gånger, inåtriktad likriktarström Kir2.1 och Kir3.1/3.4 cirka 1 000 gånger och Kv7.1 (IKs) cirka 10- till 100-faldigt mindre känslig än Kv1.5 (Pavri et al, 2012). Spänningsklampsdata i ett heterologt uttryckssystem bekräftar att MK-0448 (100 nM) producerade en robust blockering av humant Kv1.5 med en ganska långsam verkningsstart och partiell återhämtning från blockering vid -60 mV. Även om våra resultat inte tillåter en exakt karakterisering av interaktionen mellan läkemedel och kanal visar de tydligt att vilande kanaler återhämtar sig från blockering och att aktivering är nödvändig för utveckling av blockering, vilket tyder på preferentiell bindning till öppna och/eller inaktiverade kanaler.
I tidigare experiment visade vi att låga koncentrationer av 4-aminopyridin selektivt hämmar Iso (IKur) i humana förmaksmyocyter (Wettwer et al., 2004). Denna blockerare höjde platåpotentialen i SR-preparat (EC50~15 μM). Dessutom förkortade 4-AP vid koncentrationer som anses vara selektiva för IKur-blockering signifikant APD90 i SR men förlängde APD90 i permanenta AF-trabekler (Wettwer et al., 2004). De mest framträdande effekterna av MK-0448 på humana förmaks-APs, dvs, Förhöjning av platåpotentialen, förkortning av APD90 i SR och förlängning av APD20, APD50 och APD90 i permanent AF, är i linje med våra tidigare resultat med andra IKur-hämmare, så att vi med tillförsikt kan dra slutsatsen att MK-0448 verkligen blockerar IKur i humana förmaks-trabekler.
Till skillnad från hämning av hERG-kanaler var hämning av IKs inte förknippad med en proarrytmisk ventrikelverkan i djurmodeller (Lynch et al., 1999). Ändå kan modulering av IKs med MK-0448 också minska repolariseringsreserven i ventrikeln och bli arytmogen i ventriklar under lämpliga förhållanden (Lynch et al., 1999). Det är viktigt att notera att det är svårt att bedöma den ventrikulära proarytmiska risken för ett läkemedel som modulerar IKs hos friska frivilliga med normal ventrikulär repolariseringsreserv. Därför skulle MK-0448:s förmakselektivitet behöva bedömas noggrant hos patienter.
Förkortningen av APD90 och ERP av Kv1.5-blockerare i SR föreslås orsakas av den markanta förhöjningen av platåpotentialen in i ett spänningsområde där fler hERG-kanaler aktiveras och, även om de inaktiveras snabbt, kan återhämta sig från inaktivering vid mer negativa potentialer och på så sätt påskynda den slutgiltiga repolariseringen (Gintant, 2000).
Förutom distinkta förändringar i aktionspotentialernas form har förlust av hastighetsanpassning av ERP och APD90 till frekvensen erkänts som ett kännetecken för förmaksremodellering både hos patienter (t.ex, Attuel et al., 1982; Daoud et al., 1996) och i ex vivo-studier (Franz et al., 1997; Dobrev och Ravens, 2003). I vår nuvarande studie och i den nyligen genomförda studien ”första gången i människa” med MK-0448 var all elektrofysiologisk testning i ett frekvensområde som låg långt under AF och man skulle kunna hävda att baserat på våra SR-data är det inte förvånande att MK-0448 inte förlängde AERP hos friska frivilliga (Pavri et al, 2012).
Experimentella och kliniska bevis tyder på att förmaksflimmer beror på mikro-reentry som utlöses av ektopiska foci som ligger i närheten av lungvenerna (Haissaguerre et al., 1998). Farmakologiska interventioner för att avbryta mikro-reentry måste förlänga den effektiva refraktära perioden, medan undertryckande av ektopiska foci kräver minskning av excitabiliteten. Förutsatt att MK-0448 verkligen selektivt blockerar IKur är det mer sannolikt att det ökar förmaksrefraktäriteten (i AF) än att det minskar excitabiliteten, även om det inte är klart hur den markanta förhöjningen av platåamplituden hänger samman med förlängningen av ERP i AF. Det måste dock betonas att den övergripande formen av hjärtats aktionspotential bestäms av flera jonledningar, varför tolkningen av aktionspotentialdata inte kan vara avgörande med avseende på vilka jonkanaler som bidrar till en viss förändring.
I SR observerade vi till och med en förkortning av ERP med MK-0448 och vi kan inte bedöma om detta är en anti- eller proarytmisk effekt i förmaken. Faktum är att detta endast kan besvaras i en prospektiv fas 2-studie i AF-patienter. Det är dock värt att notera att ingen proarytmi rapporterades för MK-0448 (Pavri et al., 2012) eller förkortning av AERP hos friska frivilliga. Andra Kv1.5-hämmare, t.ex. XEN-D0101, som har utvärderats kliniskt har inte heller rapporterat pro-arytmi (förmaks- eller ventrikulär) hos friska frivilliga (Ford et al., 2013). Genetiska studier avslöjade ett samband mellan ”loss-of-function”-mutationer i KCNA5-genen som kodar för Kv1.5 och familjär ”ensam” AF (Olson et al., 2006). I den här studien fanns dock ofullständig genotypning/fenotypning av familjemedlemmar och inga bevis för primär koppling. Sannolikheten för att observera dessa uppgifter enbart av en slump är faktiskt mellan 10 och 15 %. En nyligen genomförd studie av mer än 300 patienter med tidig insjuknande av ensam AF avslöjade 3 ”gain-of-function”-mutationer i KCNA5 utöver flera loss-of-function-mutationer, vilket stödjer hypotesen att AF-benägenheten kan ökas av endera förändringen i KCNA5-funktionen (Christophersen et al, 2013).
Studiebegränsningar
I vissa humana förmaksberedningar förblir APD inte stabil under långvarig superfusion med saltlösningar (vanligtvis ~2 timmar).-Klassificeringen av patienter i SR och AF är kanske inte alltid tillförlitlig, dvs, SR-gruppen kan inkludera förmaksvävnad från patienter som har haft oidentifierade episoder av paroxysmal eller nyligen uppkommen AF.
Slutsats
Sammanfattningsvis höjer IKur-blockeraren MK-0448 konsekvent aktionspotentialplatån i humana förmaks-trabekler, oberoende av de initiala formerna hos kontroll-aktionspotentialen och oavsett om preparaten erhölls från patienter i SR eller permanent AF. I SR-preparat gav MK-0448 en förkortning av APD90 och ERP, men i permanent AF-vävnad observerades framträdande APD90- och ERP-förlängande effekter med läkemedlet. För förebyggande av återfall i permanent AF är förlängning av ERP med MK-0448 i AF-preparat säkerligen ett mycket önskvärt verkningssätt som kan skydda förmaksmyokardiet under fasen av omvänd remodellering efter kardioversion, även om detta, om det beror på IKs-modulering, kan innebära en risk för induktion av ventrikulär proarytmi. Det återstår att fastställa om selektiva IKur-läkemedel (i) är effektivare när det gäller att förlänga ERP vid högre förmaksfrekvenser, (ii) farmakologiskt omvandlar nyligen uppkommen AF, (iii) minskar AF-bördan vid paroxysmal AF och (iv) förhindrar återfall av persisterande AF.
Intressekonfliktförklaring
James Milnes och John Ford är anställda av Xention Ltd., John Ford är medgrundare och innehar aktier i Xention Ltd., Ursula Ravens har fungerat som konsult för Xention. Simone Loose, Judith Mueller, Michael Knaut, Erich Wettwer har inget att avslöja.
Acknowledgments
Författarna är tacksamma för det ekonomiska stödet från Europeiska unionen (FP7-Health T2-2010-261057 ”EUTRAF”) och Xention Limited. Vi vill tacka alla patienter och hjärtkirurgerna Klaus Matschke och Michael Knaut för deras ovärderliga stöd och Konstanze Fischer för hennes sakkunniga tekniska hjälp.
Amos, G. J., Wettwer, E., Metzger, F., Li, Q., Himmel, H. M. och Ravens, U. (1996). Skillnader mellan utåtriktade strömmar i mänskliga förmaks- och subepikardiella ventrikelmyocyter. J. Physiol. 491(Pt 1), 31-50.
Pubmed Abstract | Pubmed Full Text
Attuel, P., Childers, R., Cauchemez, B., Poveda, J., Mugica, J. och Coumel, P. (1982). Fel i hastighetsanpassningen av den förtida refraktärperioden: dess relation till sårbarhet. Int. J. Cardiol. 2, 179-197. doi: 10.1016/0167-5273(82)90032-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christ, T., Wettwer, E., Voigt, N., Hala, O., Radicke, S., Matschke, K., et al. (2008). Patologispecifika effekter av I(Kur)/I(to)/I(K,ACh)-blockeraren AVE0118 på jonkanaler i kroniskt förmaksflimmer hos människa. Br. J. Pharmacol. 154, 1619-1630. doi: 10.1038/bjp.2008.209
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christophersen, I. E., Olesen, M. S., Liang, B., Andersen, M. N., Larsen, A. P., Nielsen, J. B., et al. (2013). Genetisk variation i KCNA5: inverkan på den förmaks-specifika kaliumströmmen IKur hos patienter med ensamt förmaksflimmer. Eur. Heart J. 34, 1517-1525. doi: 10.1093/eurheartj/ehs442
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Daoud, E. G., Bogun, F., Goyal, R., Harvey, M., Man, K. C., Strickberger, S. A., et al. (1996). Effekten av förmaksflimmer på förmaksrefraktäritet hos människor. Circulation 94, 1600-1606. doi: 10.1161/01.CIR.94.7.1600
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dobrev, D., and Ravens, U. (2003). Remodellering av kardiomyocyternas jonkanaler vid humant förmaksflimmer. Basic Res. Cardiol. 98, 137-148. doi: 10.1007/s00395-003-0409-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J., Milnes, J., Wettwer, E., Christ, T., Rogers, M., Sutton, K., et al. (2013). Elektrofysiologiska och farmakologiska egenskaper hos människa för XEN-D0101: en ny selektiv Kv1.5/IKur-hämmare för förmaksfältet. J. Cardiovasc. Pharmacol. 61, 408-415. doi: 10.1097/FJC.0b013e31828780eb
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J. W., and Milnes, J. T. (2008). Nya läkemedel som riktar sig mot hjärtats ultrasnabba fördröjda rektriktionsström (I Kur): motivering, farmakologi och bevis för potentiellt terapeutiskt värde. J. Cardiovasc. Pharmacol. 52, 105-120. doi: 10.1097/FJC.0b013e3181719b0c
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franz, M. R., Karasik, P. L., Li, C., Moubarak, J. och Chavez, M. (1997). Elektrisk remodellering av det mänskliga förmaket: liknande effekter hos patienter med kroniskt förmaksflimmer och förmaksfladder. J. Am. Coll. Cardiol. 30, 1785-1792. doi: 10.1016/S0735-1097(97)00385-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gintant, G. A. (2000). Karaktärisering och funktionella konsekvenser av fördröjd likriktarströmsövergång vid ventrikulär repolarisering. Am. J. Physiol. Heart Circ. Physiol. 278, H806-H817.
Pubmed Abstract | Pubmed Full Text
Haissaguerre, M., Jais, P., Shah, D. C., Takahashi, A., Hocini, M., Quiniou, G., et al. (1998). Spontan initiering av förmaksflimmer genom ektopiska slag med ursprung i lungvenerna. N. Engl. J. Med. 339, 659-666. doi: 10.1056/NEJM199809033391003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lynch, J. J. Jr., Houle, M. S., Stump, G. L., Wallace, A. A., Gilberto, D. B., Jahansouz, H., et al. (1999). Antiarytmisk effekt av selektiv blockering av den långsamt aktiverande fördröjda likriktarströmmen, I(Ks), i hundmodeller av malign ischemisk ventrikelarytmi. Circulation 100, 1917-1922. doi: 10.1161/01.CIR.100.18.1917
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mays, D. J., Foose, J. M., Philipson, L. H. och Tamkun, M. M. (1995). Lokalisering av Kv1.5 K+ kanalprotein i exploaterad hjärtvävnad. J. Clin. Invest. 96, 282-292. doi: 10.1172/JCI118032
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Olson, T. M., Alekseev, A. E., Liu, X. K., Park, S., Zingman, L. V., Bienengraeber, M., et al. (2006). Kv1.5-kanalopati på grund av KCNA5-förlust av funktionsmutation orsakar mänskligt förmaksflimmer. Hum. Mol. Genet. 15, 2185-2191. doi: 10.1093/hmg/ddl143
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pavri, B. B., Greenberg, H. E., Kraft, W. K., Lazarus, N., Lynch, J. J., Salata, J. J., et al. (2012). MK-0448, en specifik Kv1.5-hämmare: säkerhet, farmakokinetik och farmakodynamisk elektrofysiologi i experimentella djurmodeller och hos människor. Circ. Arrhythm. Electrophysiol. 5, 1193-1201. doi: 10.1161/CIRCEP.111.969782
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Radicke, S., Cotella, D., Graf, E. M., Banse, U., Jost, N., Varro, A., et al. (2006). Funktionell modulering av den transienta utåtriktade strömmen Ito av KCNE beta-subenheter och regional fördelning i mänskliga icke-sviktande och sviktande hjärtan. Cardiovasc. Res, 71, 695-703. doi: 10.1016/j.cardiores.2006.06.017
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U. (2010). Antiarytmisk behandling vid förmaksflimmer. Pharmacol. Ther. 128, 129-145. doi: 10.1016/j.pharmthera.2010.06.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ravens, U., and Wettwer, E. (2011). Ultrasnabba fördröjda likriktarkanaler: molekylär grund och terapeutiska implikationer. Cardiovasc. Res. 89, 776-785. doi: 10.1093/cvr/cvq398
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Regan, C. P., Wallace, A. A., Cresswell, H. K., Atkins, C. L. och Lynch, J. J. Jr. (2006). In vivo kardiella elektrofysiologiska effekter av en ny IKur-blockerare av difenylfosfinoxid, (2-Isopropyl-5-metylcyklohexyl) difenylfosfinoxid, hos råtta och icke-mänsklig primat. J. Pharmacol. Exp. Ther. 316, 727-732. doi: 10.1124/jpet.105.094839
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Snyders, D. J., Tamkun, M. M., and Bennett, P. B. (1993). En snabbt aktiverande och långsamt inaktiverande kaliumkanal klonad från människohjärtat. Funktionell analys efter stabilt uttryck i däggdjurscellkultur. J. Gen. Physiol. 101, 513-543. doi: 10.1085/jgp.101.4.513
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tamargo, J., Caballero, R., Gomez, R. och Delpon, E. (2009). I(Kur)/Kv1.5-kanalblockerare för behandling av förmaksflimmer. Expert Opin. Investig. Drugs 18, 399-416. doi: 10.1517/13543780902762850
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, Z., Fermini, B. och Nattel, S. (1993). Hållbar depolarisationsinducerad utåtriktad ström i humana förmaksmyocyter. Bevis för en ny fördröjd likriktare K+-ström som liknar Kv1.5-klonade kanalströmmar. Circ. Res. 73, 1061-1076. doi: 10.1161/01.RES.73.6.1061
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wettwer, E., Hala, O., Christ, T., Heubach, J. F., Dobrev, D., Knaut, M., et al. (2004). IKur:s roll i kontrollen av aktionspotentialens form och kontraktilitet i det mänskliga förmaket: påverkan av kroniskt förmaksflimmer. Circulation 110, 2299-2306. doi: 10.1161/01.CIR.0000145155.60288.71
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text