av Alyssa Cecchetelli och Lukas Morgan
Modellorganismer är viktiga verktyg som används av forskare över hela världen. Dessa organismer delar många gener med människor, är lätta att upprätthålla i laboratoriet och har korta generationstider som gör det lätt att studera effekterna av genetiska manipulationer. I det här blogginlägget tar vi upp fem populära modellorganismer, men det finns många fler.
Husmusen (Mus musculus)
 Låt oss börja med den mest föredragna däggdjursmodellorganismen för många forskare: musen (Mus musculus). Möss har många fördelar som däggdjursmodellorganism för forskare eftersom de har en relativt kort generationstid för däggdjur – tiden mellan att födas och föda – på cirka 10 veckor. Vuxna möss reproducerar sig så ofta som var tredje vecka, så forskare kan samtidigt observera flera generationer av möss åt gången.
Låt oss börja med den mest föredragna däggdjursmodellorganismen för många forskare: musen (Mus musculus). Möss har många fördelar som däggdjursmodellorganism för forskare eftersom de har en relativt kort generationstid för däggdjur – tiden mellan att födas och föda – på cirka 10 veckor. Vuxna möss reproducerar sig så ofta som var tredje vecka, så forskare kan samtidigt observera flera generationer av möss åt gången.
Då möss genetiskt och fysiologiskt liknar människor mer än många andra modellorganismer används de ofta för att studera mänskliga sjukdomar. Sjukdomar hos möss uppvisar många liknande fenotyper som mänskliga sjukdomar och har framgångsrikt hjälpt forskare att utveckla en mängd olika terapier. Många forskare använder till exempel möss för att studera sjukdomar som cancer eftersom möss bättre återger de komplexa interaktionerna mellan cancerceller, terapeutiska läkemedel och resten av kroppen än studier i andra modellorganismer eller cellkulturer. Scott Lowes labb använde till exempel möss för att studera hur olika mutationer i leukemi påverkar olika behandlingsmetoder (Zuber et al., 2009). Genom att injicera möss med retrovirala vektorer som innehöll olika mutationer som finns i leukemi kunde Lowes labb identifiera en uppsättning mutationer som gjorde cancercellerna mer motståndskraftiga mot kemoterapi. Du kan hitta dessa plasmider på Addgene.
En annan fördel med möss som modellorganismer är att de är genetiskt lätthanterliga. Möss kan lätt manipuleras med verktyg som CRISPR för att göra transgena linjer.
Fruktflugan (Drosophila melanogaster)
 En annan populär modellorganism är Drosophila melanogaster, eller som den är mer allmänt känd: fruktflugan. Fruktflugan har använts i vetenskaplig forskning i över hundra år, men kom i förgrunden av Thomas Hunt Morgan, som är känd som ”fadern” till Drosophilaforskningen. Morgan upptäckte att gener fanns i kromosomer med hjälp av fruktflugan långt innan vi ens visste att DNA var genetiskt material (Jennings, 2011).
En annan populär modellorganism är Drosophila melanogaster, eller som den är mer allmänt känd: fruktflugan. Fruktflugan har använts i vetenskaplig forskning i över hundra år, men kom i förgrunden av Thomas Hunt Morgan, som är känd som ”fadern” till Drosophilaforskningen. Morgan upptäckte att gener fanns i kromosomer med hjälp av fruktflugan långt innan vi ens visste att DNA var genetiskt material (Jennings, 2011).
Fruktflugan är en utmärkt modellorganism eftersom de är lätta och billiga att odla och underhålla i laboratoriet, har en kort livscykel på 8-14 dagar och producerar ett stort antal avkommor som läggs externt. Fruktflugor är också relativt enkla att manipulera genetiskt. Forskare kan skapa en ny linje av flugor på bara sex veckor jämfört med månader för att skapa en transgen muslinje. Under årens lopp har flugan blivit en idealisk modellorganism för att studera en rad olika ämnen, bland annat utveckling, genetik och nervsystemet. Flugan har också utvecklats som en viktig sjukdomsmodell för människor med potential för upptäckt av terapeutiska läkemedel, eftersom det uppskattas att 75 % av de gener som orsakar sjukdomar hos människor har en funktionell motsvarighet hos flugan (Pandey och Nichols, 2011).
En stor fördel med att använda fruktflugan är den stora mängd genetiska verktyg, t.ex. GAL4/UAS- och LexA-systemet, som gör det möjligt för forskarna att enkelt kontrollera nivån och det spatiotemporala uttrycket av en gen av intresse. Denna typ av kontroll av genuttryck är möjlig i andra modellsystem, men kan vara ganska svår och tidskrävande. GAL4/UAS beskrevs första gången 1993 av Norbert Perrimons laboratorium och har kontinuerligt förbättrats sedan dess. Om du är intresserad av dessa system kan du kolla in Gerald Rubins labb som skapade en uppsättning modulära vektorer som kan användas för att optimalt kontrollera genuttrycket i specifika celler i flugan (Pfeiffer et al., 2010).
Yeast (Saccharomyces cerevisiae)
 Yeast, som är en av de enklaste eukaryotiska organismerna, är en vanligt förekommande modellorganism inom vetenskaplig forskning. Ja, samma sort som vi använder i bröd och andra bakverk! Jäst är billig, enkel och lätt att arbeta med eftersom den kan överleva i en mängd olika miljöförhållanden och fördubblas varannan timme. Jäst är också det första eukaryotiska genomet som har sekvenserats helt och hållet och är mycket mottagligt för genetisk manipulation.
Yeast, som är en av de enklaste eukaryotiska organismerna, är en vanligt förekommande modellorganism inom vetenskaplig forskning. Ja, samma sort som vi använder i bröd och andra bakverk! Jäst är billig, enkel och lätt att arbeta med eftersom den kan överleva i en mängd olika miljöförhållanden och fördubblas varannan timme. Jäst är också det första eukaryotiska genomet som har sekvenserats helt och hållet och är mycket mottagligt för genetisk manipulation.
Jästceller är utmärkta modellorganismer, inte bara av ovanstående skäl utan också för att de faktiskt delar många biologiska egenskaper och processer med våra egna celler. Liksom mänskliga celler är jäst-DNA förpackat i kromosomer och cirka 23 % av jästgener har en motsvarighet hos människor (Liu et al., 2017) . Således kan jäst användas för att studera den molekylära grunden för mänskliga sjukdomar som orsakas av en specifik gen. Till exempel har flera gener som är muterade i mänsklig cancer en homolog som är involverad i celldelningen i jäst (Pray, 2008). Vetenskapliga upptäckter i jäst kan sedan kan vidare studeras i andra modellorganismer som bättre återger in vivo förhållanden som liknar människans.
För att vara enkel har jäst till exempel blivit en viktig experimentell modell i studiet av neurologiska sjukdomar, till exempel Parkinsons sjukdom (PD). Parkinson kännetecknas främst av felveckning av proteiner som leder till en uppbyggnad av proteinaggregat som kallas ”lewy bodies” i hjärnan. Jästmodeller av PD, som de som överuttrycker det giftiga proteinet α-synuklein (det vanligaste proteinet som finns i lewy bodies), har varit ovärderliga för att förstå de grundläggande molekylära mekanismer som ligger till grund för sjukdomen (Menezes et al., 2015). Eftersom jäst är encelliga organismer kan de också användas för att enkelt screena flera terapeutiska föreningar i ett experiment.
Zebrafisk (Danio rerio)
 Sedan 1960-talet har zebrafisken gradvis blivit en viktig modellorganism. De delar cirka 70 % av sina gener med människan och 85 % av de mänskliga gener som är associerade med en sjukdom har en homolog i zebrafisk (Howe et al., 2013). Zebrafiskar är små, lättskötta eftersom de hålls i stora grupper, lätt uppfödda och producerar 50-300 ägg åt gången. Zebrafiskembryon läggs och befruktas också externt, vilket gör att forskare lätt kan manipulera dem. Forskare kan helt enkelt injicera encelliga embryon med DNA eller RNA för att redigera deras arvsmassa eller för att skapa transgena djur.
Sedan 1960-talet har zebrafisken gradvis blivit en viktig modellorganism. De delar cirka 70 % av sina gener med människan och 85 % av de mänskliga gener som är associerade med en sjukdom har en homolog i zebrafisk (Howe et al., 2013). Zebrafiskar är små, lättskötta eftersom de hålls i stora grupper, lätt uppfödda och producerar 50-300 ägg åt gången. Zebrafiskembryon läggs och befruktas också externt, vilket gör att forskare lätt kan manipulera dem. Forskare kan helt enkelt injicera encelliga embryon med DNA eller RNA för att redigera deras arvsmassa eller för att skapa transgena djur.
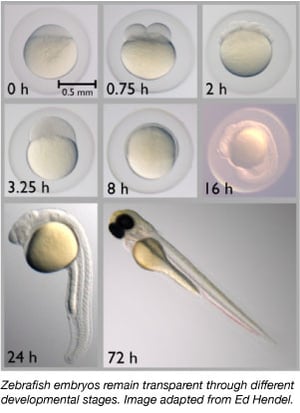
Zebrafiskar är en idealisk modellorganism för studier av embryonal utveckling eftersom deras embryon är helt genomskinliga. Forskare kan därför lätt observera tidiga utvecklingsstadier, vilket kan vara svårt för andra ryggradsdjursarter. Transparensen gör det också möjligt för forskare att enkelt observera fluorescerande märkta proteiner och vävnader för att bättre kunna bedöma utvecklingsprocesser.
Till exempel har Stainier-laboratoriet studerat spridningen och differentieringen av β-celler i zebrafiskens pankreas under utveckling. De märkte först dessa celler med hjälp av plasmider. Med hjälp av HOTcre, en metod som använder värmeinduktion för att kontrollera det tidsmässiga uttrycket av olika transgener, fastställde Stainer-gruppen sedan att det faktiskt finns två olika populationer av β-celler som har sitt ursprung i olika regioner av bukspottkörteln och som producerar olika nivåer av insulin (Hesselson m.fl, 2009).
Mask (Caenorhabditis elegans)
 Mask, Caenorhabditis elegans, har använts flitigt som modellorganism sedan 1970-talet då Sydney Brenner tog in den i labbet för att studera neuronal utveckling (Brenner, 1973). C. elegans är små, genomskinliga maskar som har en snabb livscykel och stora yngelstorlekar. Majoriteten av C. elegans är också självfertila hermafroditer vilket gör det lätt att genomföra stora experiment över flera generationer. I likhet med andra modellorganismer är C. elegans genom också fullständigt sekvenserat och över 60 % av de mänskliga generna har en ortolog i C. elegans, vilket gör den idealisk för att studera grundläggande molekylärbiologiska processer.
Mask, Caenorhabditis elegans, har använts flitigt som modellorganism sedan 1970-talet då Sydney Brenner tog in den i labbet för att studera neuronal utveckling (Brenner, 1973). C. elegans är små, genomskinliga maskar som har en snabb livscykel och stora yngelstorlekar. Majoriteten av C. elegans är också självfertila hermafroditer vilket gör det lätt att genomföra stora experiment över flera generationer. I likhet med andra modellorganismer är C. elegans genom också fullständigt sekvenserat och över 60 % av de mänskliga generna har en ortolog i C. elegans, vilket gör den idealisk för att studera grundläggande molekylärbiologiska processer.
C. elegans är också mycket mottagliga för genetisk manipulation. Transgena djur kan framställas genom att helt enkelt mikroinjicera DNA i masken, t.ex. djur som uttrycker fluorescerande markörer (Mello et al., 1991). Gener kan också enkelt slås ut genom RNA-interferens (RNAi) genom att mata masken med bakterier som uttrycker specifika plasmider (L4440) som innehåller den aktuella genen (Fire et al., 1998). Upptäckten av RNAi i masken belönade faktiskt insättarna Andrew Fire och Craig Mello med Nobelpriset 2006.
En av de stora fördelarna med C. elegans är att de är transparenta under hela sin livstid. Således kan alla genetiska modifieringar, t.ex. uttryck av fluorescerande protein eller störning av en gen, lätt visualiseras i en levande organism från embryonal utveckling till vuxen ålder. Denna förmåga att genetiskt manipulera och visualisera celler och vävnader gör det möjligt för forskare att genomföra in vivo-studier, vilket kan vara ganska svårt i andra modellorganismer. Maskar har använts för att undersöka en rad biologiska system och processer, bland annat nervsystemet, utveckling, cellsignalering, åldrande och mekanotransduktion för att nämna några. Andrew Leifers labb använde till exempel masken för att studera kalciumsignalering i hela den vuxna hjärnan med hjälp av en plasmid som uttrycker en genetiskt kodad kalciumsensor, GCaMP6 (Nguyen et al., 2015). Om du är intresserad av plasmider och resurser för C. elegans, kolla in Addgene’s Worm Expression page.
Söker du fler modellorganismer? Kolla in del två i den populära serien om modellorganismer och läs om nya system som utvecklas för nya modellorganismer!
Brenner, Sydney. ”Genetiken hos Caenorhabditis elegans”. Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. ”Distinct populations of quiescent and proliferative pancreatic β-cells identified by HOTcre mediated labeling”. Proceedings of the National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. ”The zebrafish reference genome sequence and its relationship to the human genome”. Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. ”Drosophila-a versatile model in biology & medicine”. Materials today 14.5 (2011): 190-195.
Mello, Craig C., et al. ”Effektiv genöverföring i C. elegans: extrachromosomalt underhåll och integration av transformerande sekvenser”. The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. ”Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans”. Proceedings of the National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan och Charles D. Nichols. ”Mänskliga sjukdomsmodeller i Drosophila melanogaster och flugans roll vid upptäckt av terapeutiska läkemedel”. Pharmacological reviews 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.