Sulfonering av metylbensen
Metylbensen är mer reaktivt än bensen på grund av metylgruppens tendens att ”trycka” elektroner mot ringen.
Effekten av denna större reaktivitet är att metylbensen reagerar med rykande svavelsyra vid 0°C och med koncentrerad svavelsyra om de upphettas under återflöde i ca 5 minuter.
Som effekt på reaktionshastigheten måste man med metylbensen också tänka på var på ringen som sulfonsyragruppen hamnar i förhållande till metylgruppen. Metylgrupper har en tendens att ”styra” nya grupper till 2- och 4-positionerna på ringen (om man antar att metylgruppen befinner sig i 1-positionen). Metylgrupper sägs vara 2,4-dirigerande.
Så får man en blandning som huvudsakligen består av två isomerer. Endast ca 5 – 10 % av 3-isomeren bildas. De viktigaste reaktionerna är:
![]()
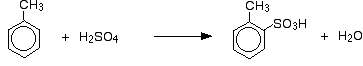
och:
![]()
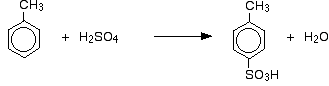
I fallet med sulfonering beror den exakta andelen bildade isomerer på reaktionens temperatur. När temperaturen ökar får man ökande andelar av 4-isomeren och mindre av 2-isomeren. Detta beror på att sulfonering är reversibel. Sulfonsyragruppen kan falla av ringen igen och fästa på nytt någon annanstans. Detta tenderar att gynna bildandet av den termodynamiskt mest stabila isomeren. Detta utbyte sker mer vid högre temperaturer.
4-isomeren är stabilare eftersom det inte finns någon rörighet i molekylen som det skulle göra om metylgruppen och sulfonsyragruppen låg bredvid varandra.