Atomer och guld
1911 inledde Rutherford och hans medarbetare Hans Geiger och Ernest Marsden en serie banbrytande experiment som helt skulle förändra den accepterade modellen av atomen. De bombarderade mycket tunna ark av guldfolie med snabbt rörliga alfapartiklar.

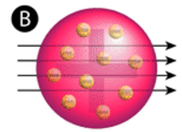

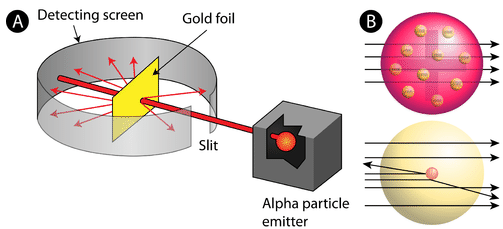
Figur \(\PageIndex{2}\) (A) Försöksuppställningen för Rutherfords experiment med guldfolie: Ett radioaktivt element som avgav alfapartiklar riktades mot ett tunt ark av guldfolie som omgavs av en skärm som skulle göra det möjligt att upptäcka de avböjda partiklarna. (B) Enligt plumpuddingmodellen (överst) borde alla alfapartiklar ha passerat genom guldfolien med liten eller ingen avböjning. Rutherford fann att en liten andel alfapartiklar avböjdes i stora vinklar, vilket kunde förklaras av en atom med en mycket liten, tät, positivt laddad kärna i centrum (nederst).
Enligt den accepterade atommodellen, där en atoms massa och laddning är jämnt fördelade över hela atomen, förväntade sig vetenskapsmännen att alla alfapartiklar skulle passera genom guldfolien med endast en liten avböjning eller ingen alls. Som framgår av figur \(\PageIndex{2}\) (medan de flesta alfapartiklarna faktiskt inte avleddes, studsade en mycket liten andel (cirka 1 av 8 000 partiklar) mot guldfolien i mycket stora vinklar. En del av dem omdirigerades till och med tillbaka mot källan. Ingen tidigare kunskap hade förberett dem på denna upptäckt. I ett berömt citat utropade Rutherford att det var ”som om du hade skjutit en 15-tums granat mot en bit vävnad och den kom tillbaka och träffade dig.”
Rutherford var tvungen att ta fram en helt ny modell av atomen för att kunna förklara sina resultat. Eftersom den stora majoriteten av alfapartiklarna hade passerat genom guldet resonerade han att större delen av atomen var tomt utrymme. Däremot måste de partiklar som avböjdes kraftigt ha upplevt en enormt stark kraft inom atomen. Han drog slutsatsen att all positiv laddning och majoriteten av atomens massa måste vara koncentrerade till ett mycket litet utrymme i atomens inre, som han kallade kärnan. Kärnan är den lilla, täta, centrala kärnan i atomen och består av protoner och neutroner.
Rutherfords atommodell blev känd som kärnmodellen. I kärnatomen är protonerna och neutronerna, som utgör nästan hela atomens massa, placerade i kärnan i atomens centrum. Elektronerna är fördelade runt kärnan och upptar större delen av atomens volym. Det är värt att understryka hur liten kärnan är jämfört med resten av atomen. Om vi kunde blåsa upp en atom så att den blev lika stor som en stor professionell fotbollsstadion skulle kärnan vara ungefär lika stor som en marmor.
Rutherfords modell visade sig vara ett viktigt steg mot en fullständig förståelse av atomen. Den tog dock inte helt och hållet upp elektronernas natur och hur de upptog det stora utrymmet runt kärnan. För denna och andra insikter tilldelades Rutherford Nobelpriset i kemi 1908. Tyvärr skulle Rutherford ha föredragit att få Nobelpriset i fysik eftersom han ansåg att fysiken var överlägsen kemin. Han ansåg att ”all vetenskap är antingen fysik eller frimärkssamling”
.