Introducere
Această neoplazie, care își are originea în epiteliul canalelor biliare, sau colangiocarcinom (CC), reprezintă 10% din tumorile hepatobiliare și 2% din tumorile maligne.1,2 CC poate fi împărțit în 3 subtipuri, în funcție de originea lor anatomică în cadrul canalului biliar: CC intrahepatic sau periferic (ICC), CC perihilar sau tumora lui Klatskin (PHC) și CC distal.
PHC, care face obiectul acestei revizuiri, este cel mai frecvent și reprezintă aproximativ 40%-60% din totalul CC.2,3 Această tumoră este agresivă și silențioasă, cu simptome nespecifice până în stadii avansate, ceea ce duce la un diagnostic tardiv și la o supraviețuire scurtă fără intervenție chirurgicală de 6 până la 12 luni.4 Intervenția chirurgicală, care este singura opțiune curativă disponibilă, este posibilă doar la aproximativ 47% dintre pacienți în momentul diagnosticului.5-8 Cei mai importanți factori de prognostic pentru această tumoră sunt de obicei asociați cu opțiunile chirurgicale, iar stadiul tumoral, dimensiunea, implicarea ganglionară și vasculară, metastazele intrahepatice și tipul histologic sunt cei mai importanți factori.9-11
Spațiul anatomic
Spațiul anatomic ocupat de CCP ar fi delimitat de intrarea în canalul chistic la nivel distal și bifurcația canalelor hepatice drept și stâng la nivel proximal.1,12 Cele mai utilizate clasificări includ toate CC care își au originea în confluența biliară sau în vecinătatea acesteia. Unele grupuri au sugerat că CC care își au originea în parenchimul hepatic pot invada uneori confluența biliară, cu o origine în spațiul anatomic delimitat de sursa ramurii posterioare a venei porte drepte și de ligamentul falciform.13-15 Aceste CC care implică confluența biliară ar fi tratate în același mod ca și tumorile cu origine extrahepatică, iar supraviețuirea este similară cu cea a CPS în același stadiu. De obicei sunt tumori foarte dezvoltate, cu invazie vasculară și ganglionară locoregională. Îndoielile privind comportamentul biologic al acestor tumori au determinat multe grupuri să le excludă din tumorile perihiliare. Într-un studiu publicat de Ebata et al.13,15 pe 250 de pacienți rezecați pentru CC cu afectarea confluenței, stadiul și supraviețuirea au fost analizate în funcție de faptul dacă tumora era intrahepatică cu afectarea confluenței (ICC) sau dacă originea tumorii era în canalul biliar extrahepatic (PHC). În total, 83 de pacienți au prezentat ICC și 167 PHC. Atunci când au fost comparate stadiile, pacienții cu ICC au prezentat o frecvență mai mare de implicare vasculară și ganglionară, cu un TNM mai mare decât cel al grupului PHC, prezentând stadiile iii și iv în 59% din cazuri, față de 38% în grupul PHC. Cu toate acestea, dacă supraviețuirea este împărțită în funcție de stadii în ambele grupuri, nu există diferențe semnificative din punct de vedere statistic la 5 ani, cu o supraviețuire generală ușor mai mare în grupul PHC (20% față de 29%, respectiv; P=.057), astfel încât s-a concluzionat că acestea sunt comparabile din punct de vedere al tratamentului și al supraviețuirii. Odată cu îmbunătățirea testelor de diagnostic și a cunoștințelor histopatologice, în viitor vom putea defini mai bine dacă sunt 2 entități distincte sau dacă din punct de vedere clinic și biologic sunt aceleași.
Caracteristici histopatologice
90% din PHC sunt adenocarcinoame. 10% sunt carcinoame adenoscuamoase sau scuamoase, care, în unele cazuri, au fost asociate cu antecedente de litiază, chisturi sau anomalii ale canalelor biliare. În funcție de aspectul tumorii, de tipul de creștere și de comportamentul biologic și clinic al CPS, acestea sunt clasificate astfel16,17:
- –
CCC tumoral sau cu „formare de masă”: aceasta este cea mai frecventă formă de prezentare în ICC, deși poate fi întâlnită și la un număr mare de CPS. Se caracterizează prin formarea unei mase tumorale cu margini clar definite. Prezintă o reacție fibrotică majoră, iar necroza centrală este, de asemenea, frecventă. Această tumoră își are originea în deschiderea canalului biliar, invadând peretele și diseminându-se prin creștere tridimensională, formând o masă nodulară care dă naștere la simptome obstructive.16-19
- –
CC periductal infiltrant: tumorile de acest tip cresc de-a lungul unui canal biliar sub forma unei îngroșări longitudinale concentrice prin țesutul conjunctiv din jurul canalului, provocând stenoza sau obstrucția completă a canalului biliar afectat.19 Majoritatea CPH sunt de acest tip și sunt dificil de identificat cu ajutorul tehnicilor imagistice.17
- –
CCC intraductal sau intraductal papilar: această varietate se caracterizează prin prezența unor tumori superficiale și intraluminale în canalul biliar. Acestea produc mucină și determină obstrucția și dilatarea parțială a canalelor.16 Această tumoră are un grad scăzut de malignitate și este de obicei de dimensiuni mici, deși se poate răspândi prin mucusul biliar, dând naștere la tumori multiple (papilomatoză sau carcinomatoză papilară).20
Importanța acestei diferențieri constă în variațiile de supraviețuire în funcție de subtipul în cauză. Mai multe studii au arătat că pacienții cu tipul papilar intraductal au un prognostic mai bun decât cei cu varietățile scleral-nodulare,21 cu o supraviețuire medie de 55 și, respectiv, 33 de luni,22 în timp ce implicarea vasculară și ganglionară este mai puțin frecventă în subtipul papilar intraductal.
Pentru a rezuma, majoritatea CPS sunt adenocarcinoame cu un model de creștere periductală care le conferă un prognostic mai slab, în timp ce varianta cu creștere intraductală este cea mai puțin frecventă, deși are un prognostic mai bun.
Sisteme de stadializare
Sistemele de stadializare pentru CPS pot fi diferențiate în clasificări pre și postoperatorii. Dintre primele, care sunt utilizate la planificarea intervenției chirurgicale, cel mai important sistem este clasificarea Bismuth-Corlette. Aceasta indică ce lob este afectat în mod preferențial și, prin urmare, arată tipul de hepatectomie care ar trebui utilizat (Fig. 1).23 Această clasificare a fost inventată în anii 1970 și nu ia în considerare nici afectarea ganglionilor limfatici, nici metastazele, astfel încât în prezent are o valoare prognostică mai mică.
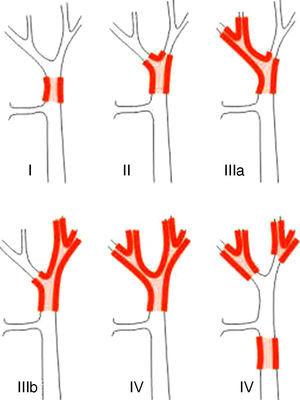
Clasificarea Bismuth-Corlette23.
O altă clasificare preoperatorie folosită în SUA este cea publicată de Jarnagin et al.10 de la Memorial Sloan Kettering Cancer Centre, New York. Această clasificare urmărește să prezică rezecabilitatea tumorilor, luând în considerare 3 factori de extensie locală. Aceștia sunt extensia biliară, implicarea vasculară și atrofia lobară. Această clasificare nu ia în considerare nici implicarea ganglionilor limfatici și nici metastazele, astfel încât are o valoare prognostică mai mică. Deoarece rezecabilitatea diferă de la un grup la altul, în timp ce tendința este spre tratamente din ce în ce mai agresive, valoarea sa va depinde de criteriile de nerezecabilitate ale fiecărui centru. În prezent, implicarea locală nu ar trebui să fie un criteriu de nerezecabilitate, cu condiția să putem obține un R0 prin rezecție chirurgicală.
Dintre clasificările postoperatorii, cea mai utilizată este clasificarea TNM a Uniunii pentru Controlul Internațional al Cancerului (UICC), ediția a șaptea.12 Această clasificare ia în considerare datele patologice, cum ar fi extensia locală, afectarea vasculară, afectarea ganglionilor limfatici și metastazele, pentru a stabili o clasificare care include extensia tumorii și este de natură prognostică.
Recent, „Japanese Study Group on Perihilar Cholangiocarcinoma” (JSGPH) a publicat un studiu care a propus modificarea clasificării „Union for International Cancer Control”. Diferențele de bază sunt prezentate în tabelul 1 și constau, în principal, în13:
-
Nu se consideră Bismut IV ca fiind T4. Prin urmare, clasificarea JSGPH nu ia în considerare extensia biliară bilaterală ca prognostic nefavorabil dacă se realizează o rezecție R0.
-
În ceea ce privește stadiile, aceasta prioritizează implicarea ganglionară ca fiind cel mai prost prognostic. Prin urmare, consideră implicarea ganglionilor limfatici ca fiind stadiul iva și nu iiib (TNM7).
Compararea diferențelor de bază între clasificarea TNM 7 a UICC și propunerea JSGPH.
| Clasificarea tumorală | UICC | Propoziția JSGPH | |
|---|---|---|---|
| Tis | Carcinom in situ | ||
| T1 | Tumor limitat la canalul biliar | ||
| T2a | Depășește peretele canalului și invadează țesutul adipos perihilar | ||
| T2b | Invadează parenchimul hepatic | ||
| T3 | Invazie unilaterală a arterei/vinei hepatice | ||
| T4 | Invazie a ramurii principale a HA/PV, Bismut IV, sau Bismut III cu invazie contralaterală a A/V | Invazie vasculară a mărcii principale a HA/PV, cu invazie vasculară bilaterală sau contralaterală | |
| Stadiul TNM | |||
| 0 | Tis N0 M0 | ||
| I | T1 N0 M0 | ||
| II | T2 N0 M0 | ||
| IIIa | T3 N0 M0 | ||
| IIIb | T1-3 N1 M0 | T4 N0 M0 | |
| Iva | T4 N× M0 | T× N1 M0 | |
| Ivb | T× N× M1 | ||
HA, artera hepatică; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, metastaza ganglionilor limfatici tumorali; UICC, Union for International Cancer Control; PV, vena portală.
La nivel european a fost creat un registru internațional al tumorilor perihiliare tratate chirurgical, condus de „International Cholangiocarcinoma Group for the Staging of PHC”. Acest grup a publicat o nouă clasificare1 care ia în considerare dimensiunea tumorii, împreună cu implicarea biliară, venoasă, arterială, ganglionară și metastatică, atât preoperator, cât și postoperator. Cu toate acestea, restricțiile acestei clasificări constau în faptul că ea se limitează la a descrie caracteristicile tumorii și intervenția chirurgicală care trebuie efectuată, fără a continua să împartă pacienții în grupuri sau stadii în funcție de aceste variabile. Ca urmare nu este posibil să se extragă concluzii prognostice și este, de asemenea, imposibil să se compare rezultatele diferitelor grupuri.
Publicațiile anterioare arată că clasificarea preoperatorie utilizată cel mai mult în prezent pentru a decide asupra tipului de rezecție este Bismuth-Corlette, în timp ce clasificarea TNM 7 este utilizată pentru a defini prognosticul pe termen lung.
Strategii de diagnostic
Simptomele asociate mai frecvent cu PHC sunt: icterul (90%), pierderea în greutate și durerea abdominală (35%), pruritul (26%) și colangita acută (10%).17 Din cauza acestor simptome, diagnosticul inițial se face de obicei cu ajutorul ecografiei abdominale, acesta fiind un bun test de screening. Alte teste de diagnostic pentru acest tip de tumoră ar fi:
- –
Ecografie Doppler abdominală: aceasta permite evaluarea permeabilității arteriale și portale (tromboză), ceea ce poate condiționa rezecabilitatea tumorii și strategia terapeutică, deși nu este testul de elecție pentru evaluarea afectării vasculare.
- –
Tomografia axială computerizată abdominală: aceasta este utilă pentru diagnosticarea tumorii primare și a extensiei bolii, cu o sensibilitate de 80% în evaluarea extensiei biliare. Este tehnica de elecție pentru evaluarea preoperatorie a anatomiei vasculare, cu o sensibilitate de 93% și, respectiv, 87% pentru evaluarea afectării arteriale și portale. Are o sensibilitate scăzută pentru evaluarea preoperatorie a afectării ganglionilor limfatici (50%).14,24 Este, de asemenea, utilă în efectuarea testelor volumetrice și în calcularea volumului hepatic rămas după rezecția chirurgicală. Este, de asemenea, cel mai economic test pentru stadializarea preoperatorie.
- –
Rezonanța magnetică și colangiografia prin rezonanță magnetică (RM-colangiografia): cel mai bun test pentru diagnosticul tumorii primare și pentru evaluarea extensiei biliare. Are o sensibilitate de 86%-100% și este mai bună decât colangiografia directă, fiind în același timp un test neinvaziv.25 Pe de altă parte, are o sensibilitate scăzută pentru evaluarea afectării vasculare (73%) și o sensibilitate de 80% pentru invazia parenchimului hepatic.
- –
Colangiografia directă: colangiopancreatografia endoscopică retrogradă (ERCP) și colangiografia hepatică transparietală (TPHC): acestea ne informează asupra nivelului de obstrucție biliară și fac posibilă prelevarea de probe din leziune pentru citologie, cu o sensibilitate de 20%. În prezent, acestea au fost înlocuite în diagnostic cu colangiografia prin rezonanță magnetică. Ele sunt foarte utile pentru drenajul biliar preoperator și în tratamentul paliativ al CPS, cu inserarea de stenturi cu acoperire metalică de preferință.26-28
- –
Ecografia endoscopică: este utilă pentru evaluarea afectării ganglionare în zona trunchiului celiac și a regiunii peripancreatice, stabilind stadializarea preoperatorie și făcând posibilă efectuarea de biopsii aspirative cu ac fin.
- –
Tomografia cu emisie de pozitroni: aceasta este utilă în studiul pacienților cu suspiciune de implicare metastatică, precum și în implicarea adenopatiilor în trunchiul celiac. Sensibilitatea sa este controversată și poate varia de la 38% la 90%, în funcție de seriile publicate.14,24,29
- –
Markerii tumorali: aceștia au o utilitate limitată, iar CA 19,9 este cel mai frecvent utilizat. Majoritatea studiilor i-au evaluat în neoplaziile pancreatice și, într-o măsură mai mică, în CC, fără a preciza localizarea sau caracteristicile acestora. Nivelurile serice ale acestor markeri sunt puternic influențate de obstrucția biliară și de icter din cauza eliminării lor biliare. Au fost propuse valori normale diferite, în funcție de prezența hepatopatiei (300U/ml) sau a icterului (1000U/ml), în timp ce în cancerul pancreatic se obțin sensibilități mai mari de 70%, cu niveluri de specificitate mai mari de 95%. Concentrația sa la acești pacienți variază foarte mult și nu se corelează cu dimensiunea tumorii, deși se corelează cu implicarea metastatică. Sensibilitatea și specificitatea acestui marker pot fi crescute prin combinarea lui cu CEA, mai ales în cazurile Lewis A negative (neproducători de CA 19,9).30
Din datele de mai sus se poate deduce că, de obicei, începem studiul cu ajutorul unei ecografii pentru diagnosticul de HCC. Aceasta are loc în contextul unui pacient cu icter, în timp ce tomografia computerizată și colangiografia prin rezonanță magnetică sunt cele mai bune teste de stadializare și cele mai recomandabile înainte de intervenția chirurgicală. Rezonanța magnetică sau tomografia computerizată pot fi utilizate pentru testarea volumetrică, în funcție de tipul de aparat sau de programele informatice disponibile în fiecare spital. În cazul în care există îndoieli cu privire la răspândirea în ganglionii limfatici, care ar putea contraindica intervenția chirurgicală, se recomandă tomografia cu emisie de pozitroni sau endoscopia prin aspirație cu ac fin.
Criterii de nerezecabilitate
Operația este singurul tratament curativ pentru CPS și oferă cea mai bună supraviețuire pe termen lung. Criteriile adoptate pentru rezecția chirurgicală s-au extins în ultimii ani, de la cele descrise inițial de echipa de la Memorial Sloan Kettering Cancer Center de Burke et al.31 în 1998, până la introducerea recentă a abordărilor care utilizează rezecția vasculară și hepatectomiile extinse3,5,32.-34 Criteriile de nerezecabilitate variază de la un spital la altul, iar cele mai răspândite sunt: afectarea vasculară pe o parte cu afectare biliară contralaterală până la divizarea radicalilor de nivelul al doilea, metastaze hepatice la distanță, afectarea vasculară a ambilor lobi hepatici, afectarea extrahepatică sau peritoneală și afectarea adenopatică a trunchiului celiac, a arterei mezenterice superioare sau a regiunii paraaortice.3,5,8,31
Într-un studiu multicentric publicat de De Jong et al.34 care a analizat 305 pacienți operați pentru HCC în 7 centre diferite din SUA și Europa, și care a inclus pacienți cu afectare portală, în analiza multivariabilă, singurii 2 factori de prognostic statistic semnificativi au fost afectarea marjei de rezecție și afectarea ganglionilor limfatici (P=.02). În studiul publicat de Ebata și colaboratorii15 , care a analizat 1352 de pacienți operați în 8 spitale japoneze pentru CPH cu intenție curativă, analiza multivariabilă a factorilor de prognostic statistic semnificativi a arătat că aceștia sunt: invazia vasculară, invazia pancreasului, afectarea ganglionilor limfatici, prezența metastazelor și afectarea marjei de rezecție. Implicarea ganglionilor limfatici și metastazele au fost factorii care au dus la o supraviețuire mai slabă la 5 ani în comparație cu ceilalți (10%, 20% și, respectiv, 63%). Aceste rezultate susțin utilizarea intervenției chirurgicale pentru aceste tumori, dacă în ciuda extensiei locale este posibilă efectuarea unei rezecții R0, având în vedere că este posibilă creșterea supraviețuirii la 5 ani indiferent de extensia locală.
Din cauza tuturor considerațiilor de mai sus, se recomandă ca fiecare caz să fie evaluat individual și să se recurgă la intervenția chirurgicală dacă se poate realiza o rezecție R0 în absența metastazelor la distanță sau a afectării peritoneale. Prin urmare, afectarea bilaterală biliară și vasculară locală nu ar trebui să fie criterii de nerezecabilitate dacă este posibil să se opereze păstrând mai mult de 30% din volumul hepatic și realizând o rezecție oncologică.
Strategii terapeuticeDrenaj biliar
Din moment ce majoritatea pacienților cu HCC debutează cu icter, una dintre cele mai importante dileme privește utilitatea drenajului biliar preoperator. Totuși, acesta nu este lipsit de complicații, iar cele asociate cu ERCP cu inserția unui stent sunt: pancreatita, perforația duodenală, migrația duodenală, obstrucția cateterului și, cel mai important, colangita. Drenajul prin CTPH prezintă o frecvență mai mică a colangitei preoperatorii, dar este asociat cu hemoragie, migrarea cateterului, până la 5% diseminare tumorală în traiectoria cateterului și disconfort și durere în zona de intrare. În general, conform studiilor publicate, ERCP are o morbiditate asociată de 60%, iar cifra corespunzătoare pentru CTPH este de 31%.14,35
Din cauza motivelor de mai sus, utilitatea drenajului biliar preoperator în chirurgia hepatobiliopancreatică a fost pusă sub semnul întrebării.36,37 Aceste studii, care includ toate tipurile de chirurgie hepatobiliară, au arătat că drenajul biliar preoperator la pacienții cu icter crește morbiditatea asociată fără a îmbunătăți supraviețuirea, crescând în principal complicațiile care implică infecții. Studiul multicentric european publicat în 2013 de Farges et al.38 a analizat retrospectiv 366 de pacienți care au fost supuși unei hepatectomii sau unei hepatectomii extinse și rezecție biliară din cauza HCC. Aceștia au fost clasificați în funcție de efectuarea sau nu a drenajului biliar preoperator. Grupul fără drenaj preoperator (non-PBD) a fost alcătuit din 186 de pacienți, iar grupul cu drenaj biliar (PBD) a cuprins 180 de pacienți. Grupurile au fost omogene în ceea ce privește vârsta, stadiul tumorii și rezecția portală. Grupul PBD a prezentat mai multe hepatectomii drepte (56% vs. 44%). Atunci când cele două grupuri au fost comparate în funcție de tipul de intervenție chirurgicală efectuată, acei pacienți supuși hepatectomiei drepte au prezentat un număr mai mare de insuficiență hepatică postoperatorie dacă aparțineau grupului non-PBD, cu o incidență de 16% vs 4% în grupul PBD (P=.009). În analiza multivariabilă a factorilor asociați cu o mortalitate mai mare în grupul de hepatectomie dreaptă, faptul de a avea un nivel al bilirubinei sub 3mg/dL înainte de operație a fost un factor semnificativ din punct de vedere statistic. Cu toate acestea, dacă au fost comparate ambele grupuri de pacienți cu hepatectomie stângă, grupul PBD a prezentat un număr mai mare de septicemii postoperatorii, cu o incidență de 6%, față de 0% în grupul non-PBD (P=.014). Acest studiu arată că, deși este adevărat că drenajul biliar crește incidența sepsisului postoperator, drenajul biliar ar trebui efectuat la acei pacienți care urmează să fie supuși hepatectomiei drepte pentru a reduce morbimortalitatea asociată cu insuficiența hepatică postoperatorie, iar alte studii susțin această teorie.39 Având în vedere că în tratamentul CPS singurele studii care au demonstrat o supraviețuire mai mare sunt cele care susțin rezecțiile extinse pentru a obține rezecția R0, drenajul biliar este recomandat atunci când este indicată intervenția chirurgicală, iar aceasta poate necesita eventual o hepatectomie extensivă de peste 50% din volumul hepatic sau o trisegmentectomie, sau dacă există colangită. Există controverse cu privire la punctul de tăiere al nivelului de bilirubină pentru a indica drenajul, iar >10mg/dL este unul dintre cele mai utilizate.5,37 Se recomandă efectuarea drenajului biliar prin CTPH, cu amplasarea drenajului extern, care evită manipularea tumorii. Aceasta are o incidență mai mică a infecțiilor decât CPRE și face posibilă, la acei pacienți cu drenaj unilateral care nu-și normalizează nivelul bilirubinei, utilizarea drenajului biliar bilateral.35,40
Diseminarea tumorii la locul de puncție a fost descrisă în până la 5%-10% din cazurile în care s-a utilizat CTPH,14,24 deși aceste studii nu precizează când s-a utilizat drenajul extern sau intern-extern și nu iau în considerare timpul scurs până la intervenția chirurgicală. Unii autori recomandă utilizarea drenajului nasobiliar poziționat endoscopic pentru a preveni diseminarea în punctul de puncție, cu o incidență mai mică de colangită și obstrucție a stentului decât în cazul CPRE41. Cu toate acestea, aceleași studii admit dificultatea drenajului biliar bilateral preoperator cu ajutorul acestui sistem, ceea ce împiedică normalizarea nivelurilor de bilirubină înainte de intervenția chirurgicală la pacienții la care drenajul unilateral a eșuat.42
Pentru a reduce morbiditatea asociată cu infecțiile în urma drenajului biliar preoperator, se sugerează ca bila să fie cultivată sistematic după drenaj și în timpul intervenției chirurgicale. Mai multe studii au arătat că 78%-94% din aceste culturi sunt pozitive pentru pacienții drenați, spre deosebire de 20%-30% pentru pacienții nedrenați,43-45 iar enterococul este organismul cel mai frecvent izolat. Aceste grupuri apără utilizarea antibioticelor profilactice, care, deși cresc rezistența la antibiotice a speciilor izolate, în studiile publicate se demonstrează că astfel se obține o morbiditate a infecțiilor postoperatorii similară cu cea a grupurilor nedrenate. Antibioticul ales va depinde de culturi și de antibiogramă, deși majoritatea grupurilor au folosit cel puțin o cefalosporină de generația a treia sau fluorochinolone+metronidazol, atunci când nu a fost disponibilă cultura sau când aceasta a fost negativă.43,44,46
Drenajul biliar paliativ este folosit la pacienții care nu pot fi supuși rezecției. Drenajul poate fi realizat prin ERCP, lăsând un stent metalic acoperit, sau prin CTPH în acele cazuri în care este imposibil de realizat un drenaj corect al ambelor canale biliare cu ajutorul ERCP.
Așa definitiv, drenajul biliar preoperator trebuie utilizat la toți pacienții cu bilirubină peste sau egală cu 10mg/dL și la cei la care rezecțiile hepatice vor fi mai mari de 50% din volumul hepatic. Tipul de abordare depinde de spital, deși CTPH cu drenaj extern este recomandabil pentru a evita manipularea tumorii și incidența mai mică a colangitei. Unii autori recomandă ca pacienții drenați să primească antibiotice profilactice adecvate culturilor biliare.
Embolizarea portală preoperatorie
Embolizarea portală preoperatorie a fost descrisă în anii 1980, inițial de Makuuchi et al.47 și apoi de Kinoshita et al.48 Scopul embolizării portale este de a crește volumul hepatic rămas în acele cazuri în care acesta este considerat insuficient în volumetria preoperatorie, reducând probabilitatea de insuficiență hepatică postoperatorie. Într-o metaanaliză publicată recent de Higuchi și Yamamoto49 care a inclus 836 de pacienți cu PHC cu embolizare portală preoperatorie, morbiditatea a fost de 1% și mortalitatea de 0,09%. Progresia tumorală în timpul procedurii care a împiedicat intervenția chirurgicală s-a ridicat la 19,4%. Aceste rezultate susțin ideea că utilizarea acesteia în CSP este justificată la acei pacienți cu un volum hepatic rămas preoperator mai mic de 30%.
Laparoscopie de stadializare
Cu progresele înregistrate în ultimii ani în ceea ce privește sensibilitatea și specificitatea testelor imagistice neinvazive, laparoscopia de stadializare cade în desuetudine. Cele mai importante criterii de nerezecabilitate sunt afectarea ganglionilor limfatici, extensia biliară și invazia vasculară. Acestea sunt dificil de evaluat în timpul laparoscopiei, a cărei precizie și eficacitate sunt în scădere de ani de zile. Acest lucru este demonstrat de recenta revizuire realizată de Rotellar și Pardo50 , în care precizia și eficacitatea se situau la 41% și, respectiv, 72% în 2002, și la 14% și 32% în studiile publicate în 2011. Această scădere se datorează în principal îmbunătățirii testelor neinvazive, cum ar fi colangiografia prin rezonanță magnetică. Eficacitatea acesteia crește dacă sunt selectați pacienții care prezintă un risc ridicat de a prezenta diseminare peritoneală sau metastaze hepatice, evitându-se astfel laparotomii inutile.50-52 Tehnicile imagistice neinvazive sunt recomandate în stadiile avansate (T2/3/4) care prezintă o posibilă afectare peritoneală sau ganglionară avansată și care nu pot fi punctate cu ajutorul eco-endoscopiei înainte de crearea drenajului biliar preoperator. Noi efectuăm întotdeauna laparoscopie de stadializare cu ajutorul ecografiei intraoperatorii pentru a îmbunătăți sensibilitatea la afectarea locorregională și ganglionară.53
Tratament chirurgical
Chirurgia este în continuare singurul tratament curativ pentru CPS,3,14 și realizează o rată de supraviețuire de 20%-40% la 5 ani (tabelul 2).10,11 Rezecția chirurgicală trebuie efectuată întotdeauna dacă este posibil să se obțină o rezecție R0. Principalii factori care afectează supraviețuirea în urma intervenției chirurgicale sunt afectarea marginilor de rezecție, fie microscopic (R1), fie macroscopic (R2), împreună cu afectarea ganglionilor limfatici (N1 și N2).14,17,44,54 Mai multe studii au arătat că supraviețuirea crește dacă rezecția este lărgită pentru a crea margini negative.3,5,33,45 Tehnicile propuse includ hepatectomii extinse cu rezecția segmentului caudat, rezecție biliară, limfadectomie hilară până la trunchiul celiac și reconstrucție cu hepatojejunostomie.
Supraviețuirea după rezecția CPS în funcție de seriile publicate.
| Autor | Anul | Cazuri | Supraviețuire la 5 ani (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20,2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Supraviețuire după rezecția hepatică datorată colangiocarcinomului perihilar.
Doar 2 ani de urmărire.
Tehnica „no-touch” descrisă pentru prima dată de Neuhaus și colab.32 presupune rezecția în bloc a hilului hepatic fără manipularea tumorii, crescând supraviețuirea pacienților până la 5 ani în peste 15% din cazuri.3,33,34,55 Această tehnică constă practic în rezecția venei porte și a arterei hepatice drepte atunci când acestea se află în apropierea tumorii, împiedicând astfel disecția acesteia dacă aceasta presupune manipularea tumorii, împreună cu rezecția biliară completă cu limfadenectomie largă până la rădăcina trunchiului celiac și reconstrucția cu hepatico-jejunostomie. Va fi preferabilă selectarea lobului hepatic drept (tehnica esențială „non-touch technique”, conform lui Neuhaus),33 cu condiția ca extensia tumorală să facă posibilă includerea arterei hepatice drepte, care este cea mai apropiată de tumoră. Acest tip de chirurgie radicală conduce la o rată acceptabilă de morbiditate postoperatorie, de 50%-70% în funcție de seria în cauză, cu o mortalitate de 10%-20%.3,5 Supraviețuirea pacienților cu PHC la 5 ani se situează între 20% și 40%, în timp ce studiile publicate care includ rezecția portală și seriile care utilizează „no-touch technique” ating 58% la 5 ani (fig. 2 și 3). 3,5,33
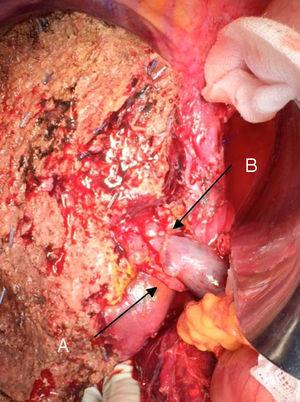
Hepatectomie stângă pentru tumora lui Klatskin, cu rezecția venei porte: (A) artera hepatică dreaptă a mezenteriului superior; (B) vena portă.
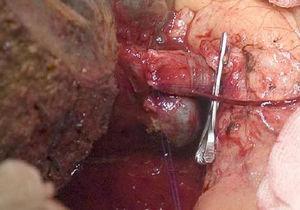
Hepatectomia dreaptă cu reconstrucția venei porte.
De asemenea, este important de subliniat studiile recente care arată o creștere a supraviețuirii pacienților cu afectare vasculară preoperatorie în urma rezecției portale. Aceștia ating chiar rate de supraviețuire care sunt egale sau mai mari decât cele ale pacienților fără afectare vasculară preoperatorie și care, prin urmare, nu au fost supuși rezecției portale.33,56,57 În aceste studii, incidența complicațiilor hepatice și vasculare este similară cu cea din grupul fără rezecție portală, cu excepția pacienților supuși rezecției arteriale, aceștia prezentând o rată de morbimortalitate mai mare decât ceilalți. Datorită tuturor acestor considerente, se recomandă intervenția chirurgicală pentru acei pacienți cu afectare portală unilaterală sau cu afectare a confluenței în testele preoperatorii, realizând o rezecție în bloc și reconstrucție vasculară. Rezecția și reconstrucția arterială nu sunt recomandate decât dacă artera este clar afectată, deoarece acest lucru este asociat cu rezultate postoperatorii mai slabe, astfel că în astfel de cazuri este preferabilă hepatectomia dreaptă.
Pentru a rezuma, principiile chirurgicale care vor fi urmate vor fi: chirurgie radicală cu rezecție biliară și caudală și limfadenectomie, cu margini R0 și fără manipulare a tumorii, chiar dacă aceasta implică rezecția și reconstrucția venei porte și a arterei hepatice.
Concluzii
În prezent, singurul tratament curativ constă în rezecția chirurgicală. Rezecția radicală în bloc și reconstrucția vasculară este tehnica care a obținut cea mai mare rată de supraviețuire pe termen lung. Pentru a reduce morbimortalitatea postoperatorie, se recomandă efectuarea unui drenaj biliar pentru a preveni insuficiența hepatică, cu profilaxie antibiotică după drenaj și embolizare portală atunci când volumul hepatic rămas în viitor va fi mai mic de 30%. Rezecția R0, afectarea ganglionilor limfatici și metastazele la distanță sunt în continuare cei mai importanți factori de prognostic.
Conflict de interese
Această revizuire nu a fost prezentată sau publicată parțial sau integral în nicio revistă sau congres.
.