Chimia ne ajută să înțelegem proprietățile și compoziția lumii din jurul nostru. Aici veți învăța despre stările materiei, precum și multe despre o stare în special (trei ghicitori – nu este solidă sau lichidă…).
Statele materiei
În funcție de temperatură, presiune și de proprietățile unei substanțe, o substanță poate lua diferite forme fizice. Noi numim aceste forme fizice stări ale materiei. Există trei stări foarte bine cunoscute ale materiei: Solidele, lichidele și gazele. Există și alte stări ale materiei. Printre acestea se numără Plasma (o stare a materiei asemănătoare unui gaz, dar care conține electroni și ioni în mișcare liberă – atomi care au pierdut electroni) și Condensatele Bose-Einstein (BEC) (unde de materie care pot apărea cu anumite tipuri de atomi la temperaturi foarte scăzute).
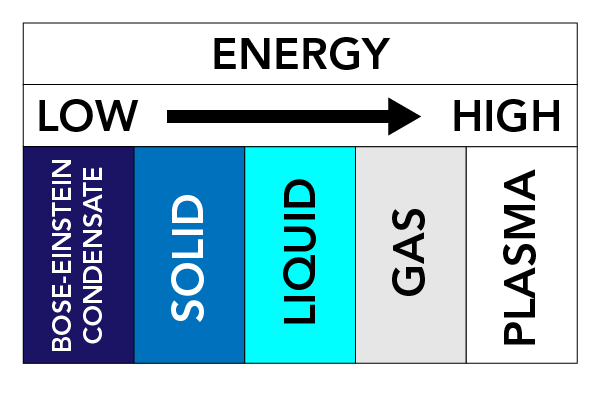
Forțele dintre particule și presiunea asupra particulelor mențin particulele împreună. Dacă încălzim materia (adăugăm energie), particulele încep să se miște mai repede și tind să se împrăștie. Această mișcare a particulelor are un efect mare asupra stării unei substanțe.
Solidele
În solide, forțele care țin particulele împreună sunt relativ puternice, iar particulele rămân foarte aproape unele de altele. Particulele pot vibra, dar nu se deplasează prea mult. Acesta este motivul pentru care solidele sunt dure și rigide. Lăsate de capul lor, solidele își vor păstra forma.
Lichidele
În lichide, forțele dintre particule sunt mai slabe decât în solide. Particulele sunt încă destul de apropiate, dar se pot mișca liber. Lichidele pot curge în interiorul unui recipient și nu au o anumită formă fixă.
Gaze
Gazele sunt dificil de relaționat, deoarece sunt adesea invizibile, dar se găsesc peste tot. Le puteți simți atunci când, de exemplu, bate vântul. Uneori le puteți mirosi când, de exemplu, simțiți mirosul mâncării care se gătește sau când un sconcs a fost supărat. Unele gaze sunt importante pentru sănătatea noastră (de exemplu, oxigenul), în timp ce altele pot fi mortale (de exemplu, hidrogenul sulfurat și clorul). Înainte de o intervenție chirurgicală, este posibil să vi se administreze un gaz anestezic, care conține substanțe chimice, pentru a calma durerea și pentru a vă face inconștient în timpul procedurii. Gazele sunt, de asemenea, responsabile de forța exploziilor. Să aruncăm o privire mai atentă asupra gazelor.
Tipuri de gaze
Există gaze elementare (formate dintr-un singur element) și gaze care sunt compuși (formate din mai multe elemente). Simbolurile gazelor elementare pot fi găsite în orice tabel periodic al elementelor. Ele sunt rezumate în tabelul de mai jos.
Gaz diatomic |
Formula chimică |
Monatomic Gaz |
Formula chimică |
|
|
Hidrogen |
H2 |
H2 |
Heliu |
He |
|
Oxigen |
O2 |
Neon |
Ne |
|
|
Nitrogen |
Nitrogen |
N2 |
Argon |
Ar |
Fluor |
F2 |
Cripton |
Kr |
|
Clorul |
Cl2 |
Xenon |
Xe |
Un gaz diatomic este un gaz în care unitatea de bază este o moleculă formată din doi atomi uniți între ei. Un gaz monatomic este unul în care unitatea de bază este un singur atom. Cu toate acestea, majoritatea gazelor sunt compuși cu două sau mai multe elemente diferite unite chimic. Cel mai frecvent este vaporii de apă, H2O. Iată denumirile, formulele și utilizările unor gaze compuse:
Denumire comună |
Formula chimică |
Unde vă îl găsiți în mod normal |
Dioxid de carbon |
CO2 |
Atmosferă, gazele de eșapament ale mașinilor, pop, plămânii noștri |
|
Propan |
C3H8 |
C3H8 |
BBQ-uri, sobe de tabără, combustibil pentru unele vehicule |
Metan |
CH4 |
Component al efectului de seră. gazelor cu efect de seră și a gazelor naturale |
|
Amonia |
NH3 |
Utilizat la fabricarea îngrășămintelor, produse de curățare |
.