Pentru a înțelege geometria moleculară, polaritatea și alte proprietăți de acest tip, este necesar să se cunoască unele proprietăți de bază ale compusului dat și structura sa Lewis. SF4 este o formulă chimică pentru tetrafluorura de sulf. Este un gaz incolor și coroziv care este utilizat în sinteza mai multor compuși organofluorurați. SF4 este un compus destul de periculos, dar este utilizat pe scară largă în companiile chimice și farmaceutice.
| Numele moleculei | Tetrafluorură de sulf ( SF4) |
| Numărul de electroni de valență din moleculă | 34 |
| Hibridizarea SF4 | sp3 hibridizare |
| Unghiurile de legătură | 102 grade și 173 grade |
| Geometria moleculară a SF4 | Trigonal bipiramidal |
Pentru a înțelege proprietățile acestei molecule, cum ar fi reactivitatea, polaritatea și multe altele, este necesar să se cunoască mai întâi structura SF4 Lewis.
Contenit
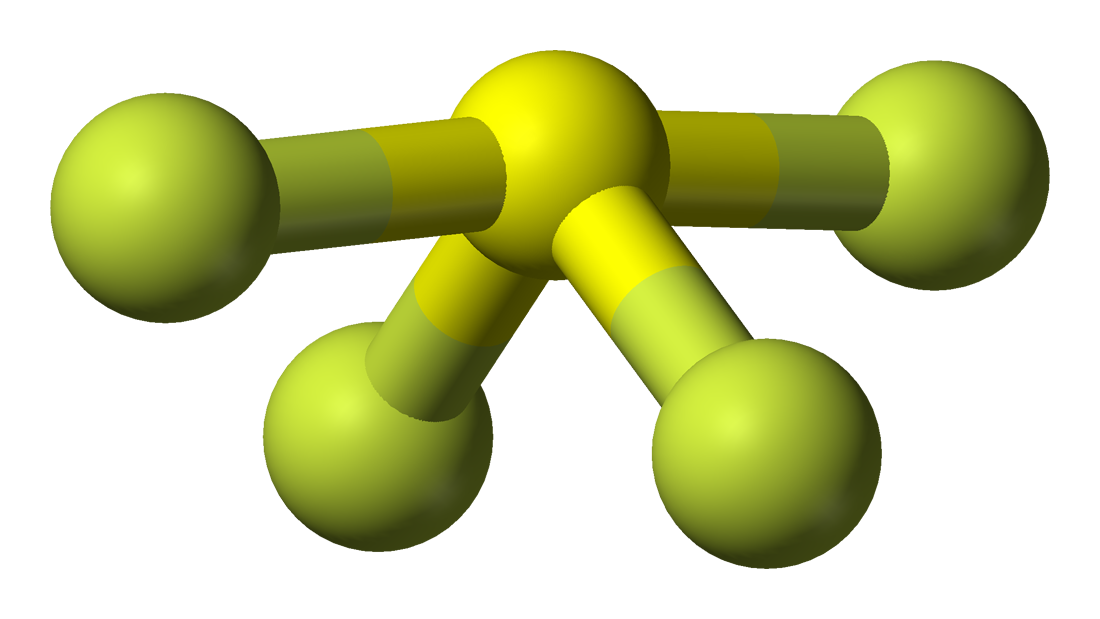
Geometria moleculară a SF4
Este ușor de înțeles geometria moleculară a unei anumite molecule prin utilizarea formulei moleculare sau a modelului VSEPR. O formulă moleculară ajută la cunoașterea numărului exact și a tipului de atomi prezenți în compusul dat. Aici există un atom de sulf și patru atomi de fluor în compus, ceea ce îl face similar cu formula moleculară a lui AX4E.
Moleculele care au formula moleculară AX4E au geometrie moleculară trigonal bipiramidală. Aici doi atomi de fluor care formează legături cu atomul de sulf sunt pe poziții ecuatoriale, iar ceilalți doi sunt pe poziții axiale. Deoarece există o pereche singuratică pe atomul central, aceasta respinge perechea de electroni de legătură, ceea ce modifică puțin forma și o face să apară ca un balansoar. Electronii urmează acest model de aranjare conform regulii VSEPR pentru a minimiza forțele de respingere dintre perechile de electroni solitari pentru a maximiza stabilitatea moleculei.
În consecință, SF4 are o geometrie moleculară bipiramidală trigonală.
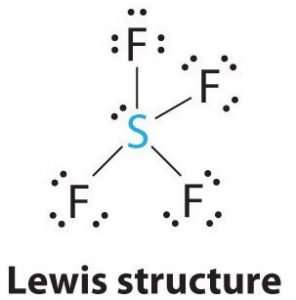
SF4 Structura Lewis
Structura Lewis este o reprezentare picturală a legăturilor și a electronilor de valență din moleculă. Legăturile formate între doi atomi sunt reprezentate cu ajutorul liniilor, în timp ce electronii de valență care nu formează nicio legătură sunt reprezentați prin puncte. Electronii de valență care participă la formarea legăturilor se numesc perechi de electroni de legătură, în timp ce electronii care nu participă sau nu formează nicio legătură se numesc perechi de electroni nelegate sau perechi solitare.
Pentru a desena structura Lewis a SF4, trebuie mai întâi să cunoaștem numărul total de electroni de valență din această moleculă.
După cum probabil se poate vedea, există un atom de sulf în acest compus și patru atomi de fluor. Pentru a cunoaște numărul total de electroni de valență ai acestui compus, trebuie să cunoaștem electronii de valență ai ambilor atomi în mod individual.
- Electronii de valență ai sulfului: 6
- Electronii de valență ai fluorului: 4* (7)
( deoarece există patru atomi de fluor, trebuie să luăm în considerare electronii de valență ai tuturor atomilor)
Numărul total de electroni de valență în SF4 = numărul de electroni de valență în sulf + numărul de electroni de valență în fluor
= 6 + 28
= 34 de electroni de valență
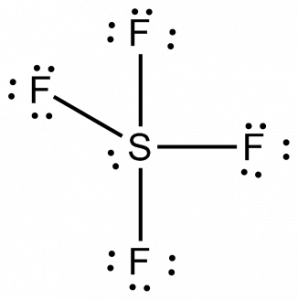
Acum că știm numărul total de electroni de valență, ne va fi ușor să înțelegem formarea legăturii între atomi și, de asemenea, aranjamentul complet al moleculei.
Sulfurul va fi atomul central în această moleculă, deoarece este cel mai puțin electronegativ, cu patru atomi de fluor care formează legături pe laturile acestui atom central. Fiecare atom de fluor va forma o legătură cu atomul central, ceea ce înseamnă că vor exista patru legături în structura moleculei folosind patru electroni de valență ai atomilor de fluor și 4 electroni ai atomului de sulf. Așadar, acum sunt utilizați opt electroni de valență, reducând numărul de electroni de valență de la 34 la 24. Toți atomii de fluor au șase electroni de valență, iar atomul central are doi electroni de valență.
Desenați linii între S și F pentru a arăta legăturile, iar pentru perechile solitare de electroni, folosiți puncte. Fiecare atom de fluor va avea trei perechi de 6 electroni de valență ( reprezentate prin puncte) pe atom, împreună cu o legătură cu sulful. În schimb, atomul central va avea doi electroni de valență și patru legături.
În consecință, atomul central, sulful, va avea o pereche de electroni solitari și patru perechi de electroni de legătură în structura Lewis a SF4. În același timp, fiecare atom de fluor va avea trei perechi solitare.
Este SF4 polar?
După ce cunoaștem structura Lewis și geometria moleculară a compusului dat, devine mai ușor să reprezentăm polaritatea moleculei. În cazul de față, o pereche solitară pe atomul central de sulf și patru perechi de electroni de legătură conduc la distribuția asimetrică a electronilor pe atomul central.
De asemenea, deoarece forma moleculei este ca un balansoar, doi atomi de fluor își pot anula reciproc momentul de dipol, dar ceilalți doi nu o pot face din cauza aranjamentului electronilor. Și cum atomii de fluor sunt mai electronegativi decât atomul de sulf, rezultă o distribuție inegală a sarcinii. Prin urmare, momentul dipolar nu este anulat, ceea ce face ca molecula să fie polară. Deci da, SF4 este polar.
Hibridizarea SF4
Pentru a cunoaște hibridizarea moleculei SF4, să ne uităm mai întâi la regiunile de densitate electronică pentru atomul central.
Sulfura are patru perechi de electroni de legătură și o pereche solitară, ceea ce face ca numărul total de regiuni de densitate electronică să fie 5. Prin urmare, atomul de sulf utilizează cinci orbitali hibridizați, un orbital 3s, trei orbitali 3p și un orbital 3d. Această dispunere a electronilor în jurul atomului și a orbitalilor hibridizați duce la hibridizarea sp3d. Se poate folosi, de asemenea, numărul steric pentru a cunoaște hibridizarea; aici, numărul steric este 5 pentru atomul de sulf.
Astfel, SF4 are hibridizare sp3d.
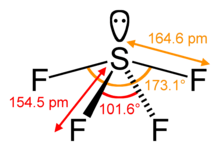
SF4 Unghiurile și forma legăturii
Atomul de sulf central formează patru legături cu atomii de fluor vecini și are o pereche de electroni solitari. Atomii de fluor de pe pozițiile ecuatoriale au unghiurile de legătură de 102 grade, iar cei axiali au 173 grade, care sunt puțin diferite de geometria moleculară bipiramidală trigonală, ceea ce duce la o formă de balansoar.
Perechea singuratică de pe atomul central duce la modificarea unghiurilor de legătură de la 120 de grade la 102 grade pentru atomii de fluor ecuatoriali și la 173 de grade în loc de 180 de grade pentru atomii de fluor axiali.
Observații finale
Pentru a concluziona toate proprietățile putem spune că,
- Tetrafluorura de sulf are 34 de electroni de valență, din care formează patru legături covalente și o pereche solitară de electroni pe atomul central în structura sa Lewis.
- Există trei perechi solitare pe fiecare atom de fluor.
- Aceasta are o geometrie moleculară de formula AX4E; formează o formă de balansoar și are o geometrie moleculară bipiramidală trigonală.
- SF4 are o hibridizare sp3d și este de natură polară.