Multiplex Ligation-dependent Probe Amplification (MLPA) este o tehnică moleculară dezvoltată de MRC-Holland în 2002. Pe scurt, MLPA este o tehnică sensibilă care permite cuantificarea secvențelor de acizi nucleici, rapid și eficient. Este realizată în multe laboratoare din întreaga lume și poate fi aplicată pentru a detecta modificările numărului de copii (cum ar fi delețiile sau duplicațiile) ale unei gene, pentru a identifica starea de metilare a ADN-ului, pentru a detecta polimorfismele de un singur nucleotid (SNP) și mutațiile punctuale și pentru a cuantifica ARNm. Prin urmare, este utilizat în multe domenii de cercetare și diagnosticare, cum ar fi citogenetica, cercetarea cancerului și genetica umană, printre altele.
Cum funcționează?
MLPA constă în următoarele etape (figura 1):
- Denaturare
- Hibridizare
- Ligare
- Amplificare (prin PCR)
- Separarea fragmentelor și analiza datelor
Figura 1 – Vizualizarea tehnicii MLPA (adaptare după Schouten, Jan P., et al.1). Putem observa, de asemenea, o electroferogramă tipică obținută prin analiza MLPA care arată o deleție a exonului 46 (săgeată roșie). (Electroferogramă adaptată din https://commons.wikimedia.org/wiki/File:MLPA_in_GeneMarker.jpg)
1-Denaturare și 2 – Hibridizare
Denaturarea presupune separarea catenelor de ADN recorectate, astfel încât ADN-ul bicatenar devine monocatenar.
Hibridizarea presupune hibridizarea probei de ADN cu sonde specifice. Deoarece este o tehnică multiplex, puteți analiza fiecare probă cu până la 60 de sonde simultan, vizând astfel diferite situsuri!
Aceste sonde au o secvență de amorsă care se leagă de amorsă PCR în procesul de amplificare. Toate sondele diferite vor avea aceeași secvență de legare a primerului. În plus, sondele au, de asemenea, o secvență de hibridizare complementară cu situl țintă care va permite sondei să se lege de ADN. Ambele sonde se vor hibridiza pe situsuri adiacente de pe șirul de ADN.
Una dintre sondele din pereche conține o secvență stuffer, care are o lungime diferită pentru fiecare situs țintă. Lungimea secvenței stuffer se modifică între diferitele sonde, permițând multiplexarea. Astfel, vă puteți aștepta ca fiecare produs de amplificare să aibă o lungime unică!
3-Ligare
Etapa de ligare va lega cele două sonde între ele. În această etapă, se utilizează o enzimă specifică numită ADN ligază. Aceasta leagă sondele care sunt deja hibridizate pe locurile adiacente ale catenei de ADN din locul țintă. Ligaza utilizată în protocoalele MLPA este ligază-65, o enzimă ligază dependentă de NAD, care poate fi utilă și în alte aplicații.
Acum, întrebarea rămâne: dacă scopul nostru este de a lega ambele sonde, de ce sunt ele molecule separate pentru început? Ei bine, ambele sonde conțin situsurile de legare pentru PCR-primeri. Aceasta înseamnă că, dacă am folosi sondele ca o singură moleculă, am obține un produs de amplificare, chiar și fără situsul țintă al ADN-ului, ceea ce ne-ar da o amplificare nespecifică. Enzima ligază este extrem de specifică: dacă există nepotriviri între sondă și situsul țintă, ligazele nu vor putea lega sondele și nu va avea loc nicio amplificare. În consecință, MLPA detectează mutații punctuale specifice și chiar distinge între pseudogene și gena țintă reală.
4-Amplificare
Postul următor este amplificarea, care este în esență o reacție în lanț a polimerazei (PCR) (tabelul 1). Pentru etapa PCR, se adaugă o polimerază, dNTP-uri și un primer înainte și invers. Deoarece toate sondele au aceeași secvență PCR-primeri, va fi necesară adăugarea unei singure perechi de primeri universali pentru a studia toate țintele noastre. Primerul forward este marcat fluorescent, permițând vizualizarea și cuantificarea în timpul analizei.
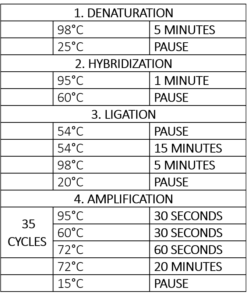
Tabelul 1 – Programul termociclatorului pentru reacția MLPA
5-Fragment Separation and Data Analysis
După amplificare, fragmentele sunt separate prin electroforeză capilară. Electroforeza capilară separă fragmentele pe baza lungimii lor și prezintă fragmente de lungimi diferite ca modele de vârfuri, numite electroferogramă (figura 1). Fiecare amplicon are o dimensiune diferită cunoscută, datorită secvenței de umplutură de pe fiecare sondă specifică și, prin urmare, fiecare amplicon poate fi cuantificat în timpul analizei datelor.
Datele obținute prin electroforeză capilară vor fi datele de intrare pentru analiză. MRC- Holland pune la dispoziție un software gratuit pentru analiza datelor – Coffalyser.
Prin compararea fiecărei probe cu un set de probe de referință, se poate obține un raport de sonde. Acest raport de sonde ne va informa cu privire la numărul de copii pe care le are o genă. Deoarece majoritatea genelor umane sunt diploide, dacă proba prezintă două copii, raportul va fi de 1,0; adică probele probei probei au obținut același număr de gene ca și proba de referință.
Dar dacă raportul este de 0,5, a existat o singură copie a genei la individul respectiv, ceea ce înseamnă probabil o deleție heterozigotă a genei țintă. Dacă, pe de altă parte, raportul este de 1,5, există, probabil, o duplicare heterozigotă a unei gene.
MRC-Holland oferă multe kituri diferite care pot avea soluția pentru problemele dumneavoastră. Cu toate acestea, dacă încercați să găsiți ceva un pic mai obscur sau să studiați ceva care nu se găsește în niciun kit, puteți să vă proiectați propriile sonde. Vă sfătuiesc să citiți cu atenție protocolul de proiectare a sondelor sintetice.
Avantajele MLPA
- MLPA este o tehnică foarte sensibilă, robustă și de mare randament.
- Ea poate discerne între mutațiile punctiforme, precum și duplicarea/deleția genelor. Prin urmare, are un mare avantaj față de alte tehnici, cum ar fi secvențierea, care pot găsi doar mutații punctuale. Mai mult decât atât, spre deosebire de FISH, MLPA poate detecta mici modificări genetice.
- Rezultatele sunt disponibile în 24 de ore și, deoarece este o reacție multiplex, permite o colectare rapidă și eficientă a informațiilor.
- Mici modificări ale protocolului MLPA pot permite o varietate de aplicații. De exemplu, prin adăugarea unei etape suplimentare de digestie, MLPA poate fi utilizată și pentru a detecta modele de metilare în ADN (Methylation specific-MLPA (MS-MLPA)).
Limitații ale MLPA
- MLPA este extrem de sensibilă la impurități. Prin urmare, trebuie să existe o precauție extremă atunci când se pregătesc probele și se efectuează tehnica.
- Se poate produce o scădere a semnalului de la o sondă din cauza unui polimorfism sau a unei mutații rare și ar putea fi necesară testarea acesteia prin alte tehnici.
MLPA este o tehnică excelentă care poate fi utilizată pentru aplicații variate și care oferă rezultate rapid și eficient. Cu toate acestea, nu vine fără sughițuri. După cum știm cu toții, fiecare tehnică are anumite dezavantaje și fiecare aplicație trebuie să fie studiată temeinic, pentru a ne asigura că folosim cea mai eficientă și sensibilă tehnică.
Ați folosit vreodată MLPA? Ce părere aveți despre această tehnică?
.