- Introducere
- Metode
- Fibroblaste de șoarece
- Diagnostic și medicație la pacienți
- Dezvoltare experimentală
- Măsurarea perioadei refractare efective
- Stock Solutions and Drug Application
- Analiza parametrilor potențialului de acțiune
- Analiză statistică
- Rezultate
- Efectele MK-0448 asupra curentului Kv1.5
- Efecte ale MK-0448 asupra potențialelor de acțiune
- Discuție
- Limitări ale studiului
- Concluzie
- Declarație privind conflictul de interese
- Recunoștințe
Introducere
În căutarea unor medicamente antiaritmice mai sigure pentru tratamentul fibrilației atriale (FA), au fost concepuți inhibitori selectivi ai IKur ca agenți antiaritmici atrial-selectivi de clasa III cu potențial terapeutic în FA. Deoarece vizează canalele Kv1.5, care sunt funcționale numai în atrii (Mays et al., 1995), acești agenți sunt considerați ca fiind lipsiți de efecte proaritmice în ventricule și, prin urmare, s-au bucurat de un mare interes în comunitatea științifică (pentru o analiză, a se vedea Ford și Milnes, 2008; Tamargo et al, 2009; Ravens, 2010; Ravens și Wettwer, 2011).
Am investigat anterior efectele electrofiziologice ale mai multor inhibitori IKur, inclusiv 4-aminopiridina, AVE0118, XEN-D0101, toți aceștia au ridicat faza de platou a potențialelor de acțiune (PA) atriale drepte umane înregistrate în trabeculele apendicelui atrial obținute de la pacienți în ritm sinusal (SR) sau în FA (Wettwer și colab, 2004; Christ et al., 2008; Ford et al., 2013). În mod interesant, durata potențialului de acțiune (APD90) și perioada refractară efectivă (ERP) au fost scurtate în cazul preparatelor de SR, dar prelungite în cazul preparatelor de FA.
Recent, au fost publicate pentru prima dată rezultate la om cu un alt inhibitor selectiv al Kv1.5, MK-0448 (Pavri et al., 2012). MK-0448 nu a reușit să afecteze ERP atrială relativă la voluntari sănătoși, iar autorii au concluzionat că nu se poate aștepta ca blocarea IKur să exercite efecte antiaritmice utile din punct de vedere terapeutic în FA. Deoarece nu se știe nimic despre efectele MK-0448 în țesutul atrial uman ex-vivo, am investigat efectele sale asupra formelor AP-urilor atriale și ERP cu tehnici standard de microelectrozi în trabecule izolate din apendicele atriale drepte ale pacienților în SR și FA, care au trebuit să fie supuși unei intervenții chirurgicale pe cord deschis. În preparatele SR, MK-0448 a ridicat potențialul de platou și a scurtat APD și ERP la 1 Hz, așa cum era de așteptat din partea blocantelor IKur. De asemenea, confirmăm că MK-0448 blochează în mod eficient curentul Kv1.5 în fibroblastele de șoarece care exprimă în mod stabil gena hKCNA5.
Metode
Fibroblaste de șoarece
Celele HK2BN9 care exprimă canale Kv1.5 umane au fost oferite cu amabilitate de Dr. Tamkun (Snyders et al., 1993). Celulele au fost cultivate în mediu Dulbecco’s modified eagle medium conținând 10% ser fetal de vițel și 1% penicilină/streptomicină în condiții atmosferice de 5% CO2 la 37°C. 250 μg/ml G418 a fost adăugat în mediu pentru selecție. Expresia Kv1.5 a fost indusă prin tratarea celulelor cu 1 μM dexametazonă cu 24 de ore înainte de un experiment. Celulele au fost studiate cu un montaj standard de clampare de tensiune cu celule întregi cu un singur electrod, așa cum a fost descris anterior (Radicke et al., 2006). Soluția de baie a conținut (în mM): NaCl 150, KCl 5,4, MgCl2 2, CaCl2 2,0, HEPES 10, glucoză 10, pH 7,4, temperatură 25°C. Soluția electrodului conținea (în mM): KCl 40, aspartat de potasiu 80, NaCl 8, CaCl2 2, MgATP 5, EGTA 5, GTP 0,1, HEPES 10, pH 7,4 ajustat cu KOH. Rezistențele seriilor au fost cuprinse între 5 și 10 MΩ și au fost compensate cu până la 85%. Capacitatea celulară a fost măsurată cu pași mici de clemă hiperpolarizantă de la -40 mV la -42 mV, valoarea medie a fost de 20,8 ± 1,2 pA/pF (n = 33) și nu a fost diferită între celulele testate la 0,5 și 3 Hz. Generarea impulsurilor de clemă de tensiune, colectarea și analiza datelor au fost efectuate cu software-ul ISO2 (MFK, Niedernhausen, Germania). Datele nu au fost corectate pentru potențialul de joncțiune, care a fost de 11,7 mV, așa cum a fost calculat cu software-ul JPCalc (P.H. Barry, Sydney, Australia).
Diagnostic și medicație la pacienți
Tesutul atrial a fost obținut de la pacienți supuși unei intervenții chirurgicale cardiace din cauza unei boli coronariene sau valvulare. Toți pacienții și-au dat consimțământul informat în scris. Studiul a fost aprobat de comitetul de etică al Facultății de Medicină a Universității de Tehnologie din Dresda (nr. EK790799). Pacienții sunt enumerați în tabelul 1. Studiul a inclus 13 preparate expuse la medicamente și 9 preparate TMC de la pacienți în ritm sinusal (grupul SR), 9 preparate expuse la medicamente și 9 preparate TMC de la pacienți cu fibrilație atrială permanentă (grupul AF, definit ca fibrilație atrială permanentă de ≥6 luni la momentul recoltării țesuturilor) și 3 preparate expuse la medicamente de la pacienți cu fibrilație atrială intermitentă (episoade de fibrilație atrială cu încetare spontană care durează de la câteva secunde până la câteva ore). Medicația pacienților a inclus de obicei inhibitori ECA, β -blocante, nitrați, medicamente hipolipemiante și diuretice.
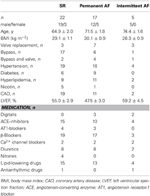
Tabelul 1. Caracteristicile pacienților ale căror trabecule au fost folosite pentru expunerea la medicamente.
Dezvoltare experimentală
Pietrețele (50-100 mg în greutate) de apendice atriale drepte umane au fost transportate la laborator într-o soluție specială de transport fără Ca2+ la 20-25°C, compoziție în mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgSO4, 50 taurină, 5 MOPS, 30 2,3-butan-dionă monoxime (BDM), pH 7,0. Fie trabeculele libere (<1 mm în diametru și 2-5 mm în lungime), fie trabeculele împreună cu peretele atrial atașat au fost disecate și montate pe fundul unei băi de organe de 5 ml perfuzate cu 50 ml de soluție Tyrode oxigenată în recirculare, la un debit de 7 ml/min la 36 ± 1°C (compoziție în mM: 126.7 NaCl, 0,42 NaH2PO4, 22 NaHCO3, 5,4 KCl, 1,8 CaCl2, 1,5 MgCl2, pH 7,4 la echilibru cu 5% CO2 în O2). Preparatele au fost stimulate electric la o rată bazală de 1 Hz cu stimuli izolați de undă pătrată cu durata de 1 ms, de 2 ori intensitatea de prag. Potențialele transmembranare au fost înregistrate cu microelectrozi de sticlă umplute cu 2,5 M KCl. Rezistențele de vârf ale electrozilor au fost cuprinse între 20 și 80 MΩ. Atât sincronizarea stimulilor de conducere, cât și preprocesarea răspunsurilor potențiale transmembranare au fost efectuate cu un sistem de înregistrare a potențialului de acțiune asistat de calculator (Wettwer et al., 2004). Pentru analiza parametrilor potențialului de acțiune a fost utilizat programul de înregistrare Chart for Windows, versiunea 7.3.5 (ADInstruments Pty Ltd., Castle Hill, Australia).
Care experiment a fost precedat de o perioadă de echilibrare de 60 de minute, în timpul căreia preparatele au fost lăsate să se stabilizeze și BDM rezidual a fost complet spălat. Valorile numerice ale principalilor parametri ai potențialului de acțiune trebuiau să rămână constante, adică într-un interval de ±5% timp de cel puțin 10 min. Atunci când microelectrodul se deplasa în afara celulei, se făcea o nouă înțepătură în același loc și experimentul era continuat dacă noua înregistrare nu diferea de cea veche prin apreciere vizuală și prezenta o diferență mai mică de 3% la analiza numerică finală.
Măsurarea perioadei refractare efective
Perioada refractară efectivă (ERP) a fost măsurată printr-un singur stimul suplimentar interpolat după trenuri de 10 impulsuri regulate de stimulare la frecvența bazală de 1 Hz cu intervale descrescătoare în pași de 5 ms de la ultimul impuls regulat până când stimulul suplimentar nu a reușit să provoace un potențial de acțiune. După o scurtă perioadă de recuperare, preparatul a fost expus la MK-0448 (3 μM) la 1 Hz timp de încă 60 min și ERP a fost testat încă o dată în prezența medicamentului.
Stock Solutions and Drug Application
MK-0448 a fost sintetizat de Xention Ltd. Cambridge, Marea Britanie. În câteva experimente, MK-0448 a fost aplicat în concentrații cumulativ crescânde prin adăugarea directă de alicote dintr-o soluție stoc de 10 mM cu DMSO ca solvent la 50 ml de mediu de baie circulant. Concentrația de DMSO nu a depășit niciodată 0,2%, o concentrație care nu a indus nicio modificare semnificativă atunci când a fost aplicată singură. Preparatele au fost expuse la fiecare concentrație de MK-0448 timp de 20 de minute.
Analiza parametrilor potențialului de acțiune
Au fost analizați următorii parametri standard ai PA atrial: potențialul de membrană în repaus, RMP (mV), amplitudinea potențialului de acțiune, APA (mV), durata potențialului de acțiune la 20, 50 și 90% din repolarizare, APD20, APD50 și APD90 (ms), rata maximă de depolarizare, dV/dtmax (V/s) și „potențialul de platou” definit ca fiind potențialul mediu absolut de membrană (mV) în fereastra de timp între 20 și 30% din APD90 (PLT20). Preparatele cu potențiale de repaus mai puțin negative decât -65 mV și amplitudini mai mici de 80 mV au fost eliminate.
Analiză statistică
Pentru analiza statistică a fost utilizat GraphPad Prism (versiunea 4.03). În curbele concentrație-răspuns (a se vedea tabelul 2), valorile obținute la concentrații crescânde au fost comparate cu controalele pre-medicament prin One-Way ANOVA urmată de testul de comparație multiplă Bonferroni. Parametrii potențiali de acțiune individuali ai preparatelor SR și AF permanente în prezența a 3 μM MK-0448 au fost comparați cu controalele pre-medicament prin testul t al lui Student împerecheat (a se vedea tabelul 3). Diferențele sunt considerate semnificative din punct de vedere statistic pentru P < 0,05.

Tabel 2. Efectele dependente de concentrație ale MK-0448 la 1, 3 și 10μM (1 Hz).
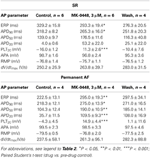
Tabel 3. Efectele MK-0448 (3μM) asupra parametrilor potențialului de acțiune și a perioadei refractare efective (ERP) a trabeculelor atriale drepte umane de la pacienți în SR și FA (frecvența de stimulare 1 Hz).
Rezultate
Efectele MK-0448 asupra curentului Kv1.5
Kv1.5 curenți, care a fost măsurat în timpul schimbărilor de potențial în trepte de la un potențial de menținere de -60 mV la diferite potențiale de testare între -40 și +80 mV a avut un potențial de prag de -30 mV, s-a activat rapid și s-a inactivat cu greu în 500 ms (datele nu sunt prezentate). Pentru testarea medicamentelor am ales pași de voltaj-clamp de 50 ms de durată la +50 mV care au provocat amplitudini medii de curent de 85,0 ± 10,5 pA/pF la 0,5 Hz (n = 16) și 110,6 ± 16,9 pA/pF la 3 Hz n = 17, P = 0,2133). MK-0448 (100 nM) a blocat amplitudinea curentului Kv1.5 într-o manieră dependentă de frecvență (Figura 1A). La 0,5 Hz, blocajul a atins o stare de echilibru în 5-10 min de la aplicarea medicamentului și s-a recuperat parțial în timpul unei perioade de 5 minute în care celula a fost blocată continuu la -60 mV (Figura 1B). Atunci când celulele au fost expuse la MK-0448 în timpul unei perioade de 5 min menținute la -60 mV, pentru a menține canalele în stare închisă, IKv1.5 din primul impuls de după repaus nu a fost diferit de cel de dinainte de repaus. Impulsurile ulterioare în prezența medicamentului au evidențiat un debut rapid al inhibiției, crescând cu fiecare impuls până la atingerea stării de echilibru (figura 1C). MK-0448 (100 nM) a redus IKv1.5 de la 82,3 ± 31,5 pA/pF la 22,4 ± 6,0 pA/pF (n = 5) în decurs de 3 minute de trepte continue de tensiune-clamp la 0,5 Hz, și de la 113,8 ± 52,7 pA/pF la 12,9 ± 2,5 pA/pF la 3 Hz (n = 4). Aceste rezultate sunt în concordanță cu faptul că inhibarea MK-0448 a Kv1.5 este condiționată de activarea canalului.

Figura 1. Efectele MK-0448 asupra curenților Kv1.5 măsurați în celulele HK2BN9 la 25°C. (A) Fixare de tensiune și urme de curent obținute înainte (negru) și după suprafuzarea celulelor cu 100 nM MK-0448 (verde) timp de 10 min. Rata impulsurilor de clemă după cum este indicat. (B) Debutul efectului de blocare a MK-0448 (100 nM) asupra curentului Kv1.5 de vârf și recuperarea din blocaj în timpul a 5 min la un potențial de menținere de -60 mV. Urmele individuale de curent din partea de sus au fost obținute la punctele de timp indicate cu litere mici în graficul de jurnal din partea de jos. (C) Debutul efectului medicamentului în urma expunerii în timpul a 5 min de blocaj continuu la -60 mV. Frecvența pasului: 3 Hz.
Efecte ale MK-0448 asupra potențialelor de acțiune
Potențialele de acțiune înregistrate în trabeculele atriale drepte de la pacienții în SR au avut configurația tipică de tip spike-and-dome (Figura 2), în țesutul AF permanent forma a fost triunghiulară și este rezultatul remodelării electrice . Cel mai izbitor efect dependent de concentrație al MK-0448 (1-10 μM) asupra potențialelor de acțiune SR la frecvența de stimulare bazală de 1 Hz a fost o creștere robustă a potențialului de platou (PLT20) (Figura 2; Tabelul 2). În acest set de experimente, APD90 a avut tendința de a fi scurtat (nesemnificativ), în timp ce APD20 și APD50 au fost prelungite, atingând nivelul de semnificație statistică numai la cea mai mare concentrație (a se vedea tabelul 2). Potențialul de membrană în repaus (RMP), amplitudinea potențialului de acțiune (APA) și viteza maximă de depolarizare (dV/dtmax) nu au fost afectate în mod semnificativ de MK-0448 (a se vedea tabelul 2). Înainte și după tratamentul medicamentos, toate preparatele au urmat stimularea, chiar și la cea mai mare concentrație.
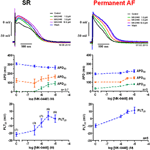
Figura 2. Efectele dependente de concentrație ale MK-0448 asupra potențialelor de acțiune înregistrate în trabeculele atriale drepte de la pacienți în ritm sinusal (SR) și fibrilație atrială (FA) permanentă. Sus: Trasee individuale pentru experimente tipice, înregistrate în prezența unor concentrații crescânde de compus (a se vedea codul de culori). Timpul de expunere la fiecare concentrație: 20 min; control: control înainte de administrarea medicamentului. Mijlocul și partea de jos: Valori medii ± s.e.m. din 7 experimente în SR și 5 în AF, ale duratei potențialului de acțiune la 90, 50 și 20% din repolarizare (APD90, APD50 și APD20) și ale potențialului de platou (PLT20). Frecvența de stimulare: 1 Hz. Vă rugăm să rețineți că nu toate preparatele au fost expuse la întreaga gamă de concentrații (numărul de preparate indicat în paranteze).
Efectele MK-0448 asupra ERP au fost studiate doar la 3 μM. Această concentrație a produs modificări maxime în 40-50 min de la aplicarea medicamentului, iar acestea au fost parțial reversibile după 60 min de spălare. În 6 preparate de la pacienți în SR, APD90 și ERP au fost semnificativ scurtate (figura 3; tabelul 3). Efecte similare au fost observate în 2 preparate de la pacienți în FA intermitentă (Figura 3).
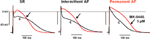
Figura 3. Efectele MK-0448 (3 μM, urmă roșie, săgeată) asupra potențialelor de acțiune înregistrate în trabeculele atriale drepte de la pacienți în ritm sinusal (SR), fibrilație atrială intermitentă (iAF) și fibrilație atrială cronică (AF). Sunt prezentate înregistrări originale de la un preparat din fiecare grup. c, control pre-medicament (urmă neagră). Frecvența de stimulare 1 Hz.
În trabeculele de FA permanentă, MK-0448 a ridicat, de asemenea, semnificativ potențialul de platou într-o măsură similară cu cel din SR, dar, spre deosebire de SR, a prelungit APD la cele trei niveluri de repolarizare analizate (figurile 2, 3; tabelul 3). În preparatele de FA permanentă, APA, RMP și dV/dtmax nu au fost, de asemenea, afectate în mod semnificativ, cu excepția RMP cu 10 μM MK-0448.
Din cauza disponibilității limitate, am putut studia doar efectele MK-0448 în 2 trabecule de la pacienți în FA intermitentă, o înregistrare tipică este prezentată în figura 3; alte 3 au fost utilizate ca TMC. Similar cu rezultatele obținute în preparatele de SR, MK-0448 a scurtat APD90 și ERP în cele 2 preparate de FA intermitentă.
În experimentele de control potrivite în timp cu țesuturi de la pacienți în SR, FA intermitentă și FA, parametrii potențialului de acțiune nu s-au modificat semnificativ (datele nu sunt prezentate).
Discuție
Modificările caracteristice ale parametrilor potențialului de acțiune observate cu MK-0448 în trabeculele atriale drepte umane sunt în concordanță cu blocarea canalelor Kv1.5, așa cum a fost raportat anterior pentru mai multe medicamente .
MK-0448 a fost descris ca fiind foarte selectiv pentru Kv1 exprimat.5 față de o mare varietate de canale ionice cardiace standard. canalele hERG sunt de aproximativ 10.000 de ori mai puțin sensibile decât Kv1.5. Canalele hERG sunt de aproximativ 10.000 de ori, curentul de rectificare interioară Kir2.1 și Kir3.1/3.4 de aproximativ 1000 de ori, iar Kv7.1 (IKs) de aproximativ 10 până la 100 de ori mai puțin sensibile decât Kv1.5 (Pavri et al., 2012). Datele de tensiune-clampare într-un sistem de expresie heterologă confirmă faptul că MK-0448 (100 nM) a produs un blocaj robust al Kv1.5 uman cu un debut de acțiune destul de lent și o recuperare parțială a blocării la -60 mV. Deși rezultatele noastre nu permit o caracterizare precisă a interacțiunii medicament-canal, acestea indică în mod clar faptul că canalele în repaus se recuperează din blocaj și că activarea este necesară pentru dezvoltarea blocului, sugerând o legare preferențială la canalele deschise și/sau inactivate.
În experimentele anterioare, am demonstrat că concentrații mici de 4-aminopiridină inhibă selectiv Iso (IKur) în miocitele atriale umane (Wettwer et al., 2004). Acest blocant a ridicat potențialul de platou în preparatele SR (EC50~15 μM). În plus, 4-AP la concentrații care sunt considerate a fi selective pentru blocarea IKur a scurtat semnificativ APD90 în SR, dar a prelungit APD90 în trabeculele de FA permanentă (Wettwer et al., 2004). Cele mai proeminente efecte ale MK-0448 asupra AP-urilor atriale umane, și anume, ridicarea potențialului de platou, scurtarea APD90 în SR și prelungirea APD20, APD50 și APD90 în FA permanentă, sunt în concordanță cu constatările noastre anterioare cu alți inhibitori IKur, astfel încât suntem încrezători să concluzionăm că MK-0448 blochează într-adevăr IKur în trabeculele atriale umane.
În comparație cu inhibarea canalelor hERG, inhibarea IKs nu a fost asociată cu un efect ventricular proaritmic în modelele animale (Lynch și colab., 1999). Cu toate acestea, modularea IKs prin MK-0448 ar putea, de asemenea, să reducă rezerva de repolarizare în ventricul și să devină aritmogenă în ventricule în condiții adecvate (Lynch și colab., 1999). Este important de remarcat faptul că este dificil de evaluat riscul proaritmic ventricular al unui medicament care modulează IKs la voluntarii sănătoși cu rezervă de repolarizare ventriculară normală. Prin urmare, selectivitatea atrială a MK-0448 ar trebui să fie evaluată cu atenție la pacienți.
Se propune ca scurtarea APD90 și ERP de către blocantele Kv1.5 în SR să fie cauzată de ridicarea marcantă a potențialului de platou într-un interval de tensiune în care mai multe canale hERG sunt activate și, deși inactivate rapid, își pot reveni din inactivare la potențiale mai negative și astfel grăbesc repolarizarea finală (Gintant, 2000).
În afară de modificările distincte ale formelor potențialelor de acțiune, pierderea adaptării ratei ERP și APD90 la frecvență a fost recunoscută ca fiind un semn distinctiv al remodelării atriale atât la pacienți (de ex, Attuel și colab., 1982; Daoud și colab., 1996), cât și în studiile ex vivo (Franz și colab., 1997; Dobrev și Ravens, 2003). În studiul nostru de față și în recentul studiu „prima dată la om” cu MK-0448, toate testele electrofiziologice au fost efectuate într-un interval de frecvențe mult sub cel al FA și s-ar putea argumenta că, pe baza datelor noastre SR, nu este surprinzător faptul că MK-0448 nu a prelungit AERP la voluntarii sănătoși (Pavri et al, 2012).
Dovezile experimentale și clinice sugerează că fibrilația atrială se datorează micro-reintrării declanșate de focare ectopice situate în apropierea venelor pulmonare (Haissaguerre et al., 1998). Intervențiile farmacologice pentru întreruperea microreintrării trebuie să prelungească perioada refractară efectivă, în timp ce suprimarea focarelor ectopice necesită o reducere a excitabilității. Cu condiția ca MK-0448 să blocheze într-adevăr în mod selectiv IKur, este mai probabil ca acesta să crească refractaritatea atrială (în FA) decât să reducă excitabilitatea, deși nu este clar cum se leagă creșterea marcată a amplitudinii de platou de prelungirea ERP în FA. Cu toate acestea, trebuie subliniat faptul că forma generală a potențialului de acțiune cardiac este determinată de multiple conductanțe ionice, prin urmare, interpretarea datelor privind potențialul de acțiune nu poate fi concludentă în ceea ce privește canalele ionice care contribuie la o anumită modificare.
În SR, am observat chiar scurtarea ERP cu MK-0448 și nu putem judeca dacă acesta este un efect anti sau proaritmic în atrii. Într-adevăr, acest lucru poate fi răspuns doar în cadrul unui studiu prospectiv de fază 2 la pacienții cu FA. Cu toate acestea, este demn de remarcat faptul că nu a fost raportată nicio proaritmie pentru MK-0448 (Pavri et al., 2012) sau scurtarea AERP la voluntarii sănătoși. Alți inhibitori Kv1.5, de exemplu, XEN-D010101, care au fost evaluați în clinică, de asemenea, nu au raportat proaritmii (atriale sau ventriculare) la voluntarii sănătoși (Ford et al., 2013). Studiile genetice au relevat o asociere a mutațiilor de „pierdere a funcției” în gena KCNA5 care codifică pentru Kv1.5 cu FA familială „solitară” (Olson et al., 2006). Cu toate acestea, în acest studiu a existat o genotipare/fenotipare incompletă a membrilor familiei și nicio dovadă de legătură primară. Într-adevăr, probabilitatea de a observa aceste date doar din întâmplare este între 10 și 15%. Un studiu recent efectuat pe mai mult de 300 de pacienți cu FA singuratică cu debut precoce a evidențiat 3 mutații „gain-of-function” în KCNA5 în plus față de mai multe mutații loss-of-function, susținând ipoteza că susceptibilitatea la FA poate fi crescută fie de o modificare a funcției KCNA5 (Christophersen et al., 2013).
Limitări ale studiului
În unele preparate atriale umane, APD nu rămâne stabilă în timpul superfuziei prelungite cu soluții saline (de obicei, ~2 h).-Clasificarea pacienților în SR și FA poate să nu fie întotdeauna fiabilă, de ex, grupul SR poate include țesut atrial de la pacienți care au avut episoade nerecunoscute de FA paroxistică sau cu debut recent.
Concluzie
În rezumat, blocantul IKur MK-0448 ridică în mod constant platoul potențialului de acțiune în trabeculele atriale umane, indiferent de formele inițiale ale potențialelor de acțiune de control și indiferent dacă preparatele au fost obținute de la pacienți în SR sau FA permanentă. În preparatele SR, MK-0448 a produs scurtarea APD90 și ERP, dar în țesutul cu FA permanentă, au fost observate efecte proeminente de prelungire a APD90 și ERP cu acest medicament. Pentru prevenirea recurenței FA persistente, prelungirea ERP de către MK-0448 în preparatele de FA este cu siguranță un mod de acțiune extrem de dorit, care poate proteja miocardul atrial în timpul fazei de remodelare inversă după cardioversie, deși, dacă se datorează modulării IKs, acest lucru poate veni cu riscul de a induce proaritmii ventriculare. Rămâne de stabilit dacă medicamentele IKur selective (i) sunt mai eficiente în prelungirea ERP la rate atriale mai mari, (ii) convertesc farmacologic FA cu debut recent, (iii) reduc povara FA în FA paroxistică și (iv) previn recurența FA persistente.
Declarație privind conflictul de interese
James Milnes și John Ford sunt angajați ai Xention Ltd., John Ford este co-fondator și deține acțiuni la Xention Ltd., Ursula Ravens a acționat în calitate de consultant pentru Xention. Simone Loose, Judith Mueller, Michael Knaut, Erich Wettwer nu au nimic de dezvăluit.
Recunoștințe
Autorii recunosc cu recunoștință sprijinul financiar al Uniunii Europene (FP7-Health T2-2010-261057 „EUTRAF”) și al Xention Limited. Dorim să mulțumim tuturor pacienților și chirurgilor cardiaci Klaus Matschke și Michael Knaut pentru sprijinul lor neprețuit, precum și lui Konstanze Fischer pentru asistența tehnică de specialitate.
Amos, G. J., Wettwer, E., Metzger, F., Li, Q., Himmel, H. M., și Ravens, U. (1996). Diferențe între curenții exteriori ai miocitelor atriale și ventriculare subepicardice umane. J. Physiol. 491(Pt 1), 31-50.
Pubmed Abstract | Pubmed Full Text
Attuel, P., Childers, R., Cauchemez, B., Poveda, J., Mugica, J. și Coumel, P. (1982). Eșecul în adaptarea ratei de adaptare a perioadei refractare atriale: relația sa cu vulnerabilitatea. Int. J. Cardiol. 2, 179-197. doi: 10.1016/0167-5273(82)90032-8
Pubmed Abstract | Pubmed Full Text | Refresh Full Text
Christ, T., Wettwer, E., Voigt, N., Hala, O., Radicke, S., Matschke, K., et al. (2008). Efectele specifice patologiei ale blocantului I(Kur)/I(to)/I(K,ACh) AVE0118 asupra canalelor ionice în fibrilația atrială cronică umană. Br. J. Pharmacol. 154, 1619-1630. doi: 10.1038/bjp.2008.209
Pubmed Abstract | Pubmed Full Cross | Refef Full Text
Christophersen, I. E., Olesen, M. S., Liang, B., Andersen, M. N., Larsen, A. P., Nielsen, J. B., et al. (2013). Variația genetică în KCNA5: impactul asupra curentului de potasiu specific atrial IKur la pacienții cu fibrilație atrială solitară. Eur. Heart J. 34, 1517-1525. doi: 10.1093/eurheartj/ehs442
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Daoud, E. G., Bogun, F., Goyal, R., Harvey, M., Man, K. C., Strickberger, S. A., et al. (1996). Efectul fibrilației atriale asupra refracției atriale la om. Circulation 94, 1600-1606. doi: 10.1161/01.CIR.94.7.1600
Pubmed Abstract | Pubmed Full Text | Textul integral | Textul integral al revistei CRF
Dobrev, D., and Ravens, U. (2003). Remodelarea canalelor ionice ale cardiomiocitelor în fibrilația atrială umană. Basic Res. cardiol. 98, 137-148. doi: 10.1007/s00395-003-0409-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ford, J., Milnes, J., Wettwer, E., Christ, T., Rogers, M., Sutton, K., et al. (2013). Proprietăți electrofiziologice și farmacologice umane ale XEN-D010101: un nou inhibitor Kv1.5/IKur selectiv atrial. J. Cardiovasc. Pharmacol. 61, 408-415. doi: 10.1097/FJC.0b013e31828780eb
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Ford, J. W., și Milnes, J. T. (2008). Noi medicamente care vizează curentul cardiac ultra-rapid de rectificare întârziată (I Kur): raționament, farmacologie și dovezi pentru o potențială valoare terapeutică. J. Cardiovasc. Pharmacol. 52, 105-120. doi: 10.1097/FJC.0b013e318171919b0c
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Franz, M. R., Karasik, P. L., Li, C., Moubarak, J., și Chavez, M. (1997). Remodelarea electrică a atriului uman: efecte similare la pacienții cu fibrilație atrială cronică și flutter atrial. J. Am. Coll. Cardiol. 30, 1785-1792. doi: 10.1016/S0735-1097(97)00385-9
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Gintant, G. A. (2000). Caracterizarea și consecințele funcționale ale tranzitoriului curentului redresor întârziat în repolarizarea ventriculară. Am. J. Physiol. inima Circ. Physiol. 278, H806-H817.
Pubmed Abstract | Pubmed Full Text
Haissaguerre, M., Jais, P., Shah, D. C., Takahashi, A., Hocini, M., Quiniou, G., et al. (1998). Inițierea spontană a fibrilației atriale prin bătăi ectopice originare din venele pulmonare. N. Engl. J. Med. 339, 659-666. doi: 10.1056/NEJM1998090903339391003
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Lynch, J. J. Jr., Houle, M. S., Stump, G. L., Wallace, A. A., Gilberto, D. B., Jahansouz, H., et al. (1999). Eficacitatea antiaritmică a blocării selective a curentului cardiac de rectificare întârziată cu activare lentă, I(Ks), în modelele canine de aritmie ventriculară ischemică malignă. Circulation 100, 1917-1922. doi: 10.1161/01.CIR.100.18.1917
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Mays, D. J., Foose, J. M., Philipson, L. H., și Tamkun, M. M. (1995). Localizarea proteinei canalului Kv1.5 K+ în țesutul cardiac explantat. J. Clin. Invest. 96, 282-292. doi: 10.1172/JCI118032
Pubmed Abstract | Pubmed Full Text | Pubmed Full CrossRef Full Text
Olson, T. M., Alekseev, A. E., Liu, X. K., Park, S., Zingman, L. V., Bienengraeber, M., et al. (2006). Canalopatia canalului Kv1.5 datorată mutației de pierdere a funcției KCNA5 cauzează fibrilația atrială umană. Hum. Mol. Genet. 15, 2185-2191. doi: 10.1093/hmg/ddl143
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Pavri, B. B., Greenberg, H. E., Kraft, W. K., W. K., Lazarus, N., Lynch, J. J., Salata, J. J., et al. (2012). MK-0448, un inhibitor specific al Kv1.5: siguranță, farmacocinetică și electrofiziologie farmacodinamică în modele animale experimentale și la om. Circ. Arrhythm. Electrophysiol. 5, 1193-1201. doi: 10.1161/CIRCEP.111.969782
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Radicke, S., Cotella, D., Graf, E. M., Banse, U., Jost, N., Varro, A., et al. (2006). Modularea funcțională a curentului de ieșire tranzitoriu Ito de către KCNE beta-subunități și distribuția regională în inimile umane care nu suferă de insuficiență și care suferă de insuficiență. Cardiovasc. Res, 71, 695-703. doi: 10.1016/j.cardiores.2006.06.017
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Ravens, U. (2010). Terapia antiaritmică în fibrilația atrială. Pharmacol. Ther. 128, 129-145. doi: 10.1016/j.pharmthera.2010.06.004
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | CrossRef Full Text
Ravens, U., and Wettwer, E. (2011). Canale redresoare întârziate ultra-rapide: baza moleculară și implicații terapeutice. Cardiovasc. Res. 89, 776-785. doi: 10.1093/cvr/cvq398
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Regan, C. P., Wallace, A. A., Cresswell, H. K., Atkins, C. L., și Lynch, J. J. Jr. (2006). Efectele electrofiziologice cardiace in vivo ale unui nou blocant IKur de oxid de difenilfosfină, (2-Isopropil-5-metilciclohexil) oxid de difenilfosfină, la șobolan și primate neumane. J. Pharmacol. Exp. Ther. 316, 727-732. doi: 10.1124/jpet.105.094839
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Snyders, D. J., Tamkun, M. M., și Bennett, P. B. (1993). Un canal de potasiu cu activare rapidă și inactivare lentă clonat din inima umană. Analiză funcțională după exprimarea stabilă în culturi de celule de mamifere. J. Gen. Physiol. 101, 513-543. doi: 10.1085/jgp.101.4.513
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Tamargo, J., Caballero, R., Gomez, R. și Delpon, E. (2009). Blocanți ai canalelor I(Kur)/Kv1.5 pentru tratamentul fibrilației atriale. Expert Opin. Investig. Drugs 18, 399-416. doi: 10.1517/13543780902762850
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Wang, Z., Fermini, B. și Nattel, S. (1993). Curent de ieșire indus de depolarizare susținută în miocitele atriale umane. Dovezi pentru un nou curent K+ redresor întârziat similar cu curenții canalului clonat Kv1.5. Circ. Res. 73, 1061-1076. doi: 10.1161/01.RES.73.6.1061
Pubmed Abstract | Pubmed Full Text | Reflect Full Text
Wettwer, E., Hala, O., Christ, T., Heubach, J. F., Dobrev, D., Knaut, M., et al. (2004). Rolul IKur în controlul formei potențialului de acțiune și al contractilității în atriul uman: influența fibrilației atriale cronice. Circulation 110, 2299-2306. doi: 10.1161/01.CIR.0000145155.60288.71
Pubmed Abstract | Pubmed Full Text | Refef Full Text
.