De Alyssa Cecchetelli și Lukas Morgan
Organismele model sunt instrumente vitale folosite de cercetătorii din întreaga lume. Aceste organisme împărtășesc multe gene cu oamenii, sunt ușor de întreținut în laborator și au timpi de generare scurți care facilitează studierea efectelor manipulărilor genetice. În această postare pe blog, vom acoperi cinci organisme model populare, dar există mult mai multe.
Șoarecele de casă (Mus musculus)
 Să începem cu cel mai preferat organism model de mamifere de către mulți cercetători: șoarecele (Mus musculus). Șoarecii au multe avantaje ca organism model de mamifere pentru cercetători, deoarece au un timp de generație relativ scurt pentru mamifere – timpul dintre naștere și fătare – de aproximativ 10 săptămâni. Șoarecii adulți se reproduc la fel de des ca la fiecare trei săptămâni, astfel încât oamenii de știință pot observa simultan mai multe generații de șoareci la un moment dat.
Să începem cu cel mai preferat organism model de mamifere de către mulți cercetători: șoarecele (Mus musculus). Șoarecii au multe avantaje ca organism model de mamifere pentru cercetători, deoarece au un timp de generație relativ scurt pentru mamifere – timpul dintre naștere și fătare – de aproximativ 10 săptămâni. Șoarecii adulți se reproduc la fel de des ca la fiecare trei săptămâni, astfel încât oamenii de știință pot observa simultan mai multe generații de șoareci la un moment dat.
Pentru că șoarecii sunt mai asemănători din punct de vedere genetic și fiziologic cu oamenii decât multe alte organisme model, ei sunt adesea utilizați pentru a studia bolile umane. Bolile la șoareci prezintă multe fenotipuri similare cu bolile umane și au ajutat cu succes cercetătorii să dezvolte o varietate de terapii. De exemplu, mulți oameni de știință folosesc șoarecii pentru a studia boli precum cancerul, deoarece șoarecii recapitulează mai bine interacțiunile complexe dintre celulele canceroase, medicamentele terapeutice și restul corpului decât studiile în alte organisme model sau în culturi de celule. De exemplu, laboratorul lui Scott Lowe a utilizat șoareci pentru a studia modul în care diferite mutații în leucemie influențează diferite regimuri de tratament (Zuber et al., 2009). Prin injectarea șoarecilor cu vectori retrovirali care adăposteau diferite mutații întâlnite în leucemie, laboratorul Lowe a reușit să identifice un set de mutații care făceau celulele canceroase mai rezistente la chimioterapie. Puteți găsi aceste plasmide la Addgene.
Un alt avantaj al șoarecilor ca organisme model este acela că sunt tratabili din punct de vedere genetic. Șoarecii pot fi ușor de manipulat cu instrumente precum CRISPR pentru a crea linii transgenice.
Musca de fructe (Drosophila melanogaster)
 Un alt organism model popular este Drosophila melanogaster, sau așa cum este cunoscută mai frecvent: musca de fructe. Musca de fructe a fost folosită în cercetarea științifică de peste un secol, dar a fost adusă în prim-plan de Thomas Hunt Morgan, care este cunoscut ca fiind „părintele” cercetării Drosophilei. Morgan a descoperit că genele se găseau în cromozomi folosind musca de fructe cu mult înainte ca noi să știm că ADN-ul este material genetic (Jennings, 2011).
Un alt organism model popular este Drosophila melanogaster, sau așa cum este cunoscută mai frecvent: musca de fructe. Musca de fructe a fost folosită în cercetarea științifică de peste un secol, dar a fost adusă în prim-plan de Thomas Hunt Morgan, care este cunoscut ca fiind „părintele” cercetării Drosophilei. Morgan a descoperit că genele se găseau în cromozomi folosind musca de fructe cu mult înainte ca noi să știm că ADN-ul este material genetic (Jennings, 2011).
Musca de fructe este un organism model excelent, deoarece este ușor și ieftin de crescut și întreținut în laborator, are un ciclu de viață scurt, de 8 până la 14 zile, și produce un număr mare de descendenți care sunt puși în exterior. Muștele de fructe sunt, de asemenea, relativ ușor de manipulat din punct de vedere genetic. Oamenii de știință pot crea o nouă linie de muște în doar 6 săptămâni, în comparație cu lunile necesare pentru a crea o linie de șoareci transgenici. De-a lungul anilor, musca a devenit un organism model ideal pentru a studia o serie de subiecte, inclusiv dezvoltarea, genetica și sistemul nervos. Musca a apărut, de asemenea, ca un model important de boală umană cu potențial pentru descoperirea de medicamente terapeutice, deoarece se estimează că 75% dintre genele care provoacă boli la om au un omolog funcțional la muscă (Pandey și Nichols, 2011).
Un avantaj imens al utilizării muștelor de fructe este gama de instrumente genetice, cum ar fi sistemul GAL4/UAS și LexA, care permite oamenilor de știință să controleze cu ușurință nivelul și expresia spațio-temporală a unei gene de interes. Acest tip de control al expresiei genelor este posibil în alte sisteme model, dar poate fi destul de dificil și necesită mult timp. GAL4/UAS a fost descris pentru prima dată în 1993 de laboratorul lui Norbert Perrimon și a fost îmbunătățit continuu de atunci. Dacă sunteți interesați de aceste sisteme, verificați laboratorul lui Gerald Rubin, care a creat un set de vectori modulari care pot fi utilizați pentru a controla în mod optim expresia genelor în celule specifice ale muștelor (Pfeiffer et al., 2010).
Yeast (Saccharomyces cerevisiae)
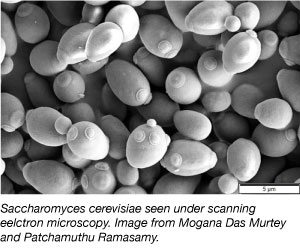 Yeast, unul dintre cele mai simple organisme eucariote, este un organism model utilizat în mod obișnuit în cercetarea științifică. Da, același tip pe care îl folosim în pâine și alte produse de panificație! Drojdia este ieftină, simplă și ușor de lucrat, deoarece poate supraviețui într-o varietate de condiții de mediu și se dublează la fiecare 2 ore. Drojdia este, de asemenea, primul genom eucariot care a fost secvențiat în întregime și este foarte ușor de manipulat genetic.
Yeast, unul dintre cele mai simple organisme eucariote, este un organism model utilizat în mod obișnuit în cercetarea științifică. Da, același tip pe care îl folosim în pâine și alte produse de panificație! Drojdia este ieftină, simplă și ușor de lucrat, deoarece poate supraviețui într-o varietate de condiții de mediu și se dublează la fiecare 2 ore. Drojdia este, de asemenea, primul genom eucariot care a fost secvențiat în întregime și este foarte ușor de manipulat genetic.
Celele de drojdie sunt un organism model excelent nu numai pentru motivele de mai sus, ci și pentru că, de fapt, ele împărtășesc multe proprietăți și procese biologice cu propriile noastre celule. Ca și în cazul celulelor umane, ADN-ul drojdiei este împachetat în cromozomi și aproximativ 23 % din genele de drojdie au un corespondent la om (Liu et al., 2017) . Astfel, drojdia poate fi utilizată pentru a studia baza moleculară a bolilor umane care sunt cauzate de o anumită genă. De exemplu, mai multe gene mutante în cancerele umane au un omolog implicat în diviziunea celulară a drojdiei (Pray, 2008). Descoperirile științifice în drojdie pot fi apoi pot fi studiate în continuare în alte organisme model care recapitulează mai bine condițiile in vivo similare cu cele umane.
De exemplu, datorită simplității lor, drojdia a devenit un model experimental important în studiul bolilor neurologice, cum ar fi boala Parkinson (PD). PD se caracterizează în primul rând prin plierea defectuoasă a proteinelor care duce la o acumulare de agregate proteice denumite „corpuri lewy” în creier. Modelele de drojdie ale PD, cum ar fi cele care supraexprimă proteina toxică α-sinucleină (cea mai frecventă proteină care se găsește în corpurile lewy), au fost de neprețuit în înțelegerea mecanismelor moleculare de bază care stau la baza bolii (Menezes et al., 2015). Deoarece drojdiile sunt organisme unicelulare, ele pot fi, de asemenea, utilizate pentru a depista cu ușurință mai mulți compuși terapeutici într-un singur experiment.
Pestele zebră (Danio rerio)
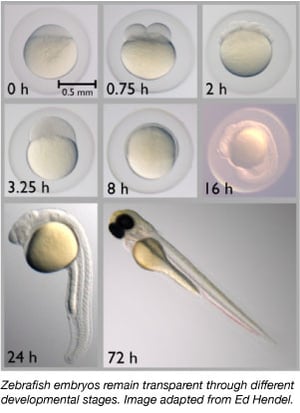 Din anii 1960, peștele zebră a devenit treptat un organism model important. Aceștia împărtășesc aproximativ 70% din genele lor cu oamenii și 85% dintre genele umane asociate cu o boală au un omolog la peștele zebră (Howe et al., 2013). Peștii zebră sunt mici, ușor de întreținut, deoarece sunt adăpostiți în grupuri mari, sunt ușor de reprodus și produc 50-300 de ouă la un moment dat. De asemenea, embrionii de pește zebră sunt puși și fertilizați în exterior, ceea ce permite oamenilor de știință să îi manipuleze cu ușurință. Oamenii de știință pot injecta pur și simplu embrioni unicelulari cu ADN sau ARN pentru a le modifica genomul sau pentru a crea animale transgenice.
Din anii 1960, peștele zebră a devenit treptat un organism model important. Aceștia împărtășesc aproximativ 70% din genele lor cu oamenii și 85% dintre genele umane asociate cu o boală au un omolog la peștele zebră (Howe et al., 2013). Peștii zebră sunt mici, ușor de întreținut, deoarece sunt adăpostiți în grupuri mari, sunt ușor de reprodus și produc 50-300 de ouă la un moment dat. De asemenea, embrionii de pește zebră sunt puși și fertilizați în exterior, ceea ce permite oamenilor de știință să îi manipuleze cu ușurință. Oamenii de știință pot injecta pur și simplu embrioni unicelulari cu ADN sau ARN pentru a le modifica genomul sau pentru a crea animale transgenice.
Pestele zebră este un organism model ideal pentru studiile de dezvoltare embrionară, deoarece embrionii lor sunt complet transparenți. Astfel, oamenii de știință pot observa cu ușurință stadiile timpurii de dezvoltare, ceea ce poate fi dificil la alte specii de vertebrate. Transparența permite, de asemenea, oamenilor de știință să observe cu ușurință proteinele și țesuturile marcate prin fluorescență pentru a evalua mai bine procesele de dezvoltare.
De exemplu, laboratorul Stainier a studiat proliferarea și diferențierea celulelor β în pancreasul în curs de dezvoltare al peștelui zebră. Ei au marcat mai întâi aceste celule folosind plasmide. Apoi, folosind HOTcre, o metodă care folosește inducția termică pentru a controla expresia temporală a diferitelor transgene, grupul Stainer a determinat că există, de fapt, două populații distincte de celule β care își au originea în diferite regiuni ale pancreasului și care produc niveluri diferite de insulină (Hesselson et al., 2009).
Vârcolacul (Caenorhabditis elegans)
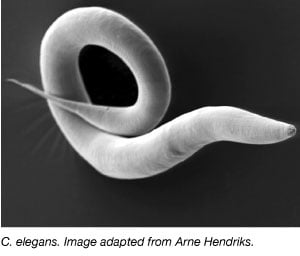 Vârcolacul, Caenorhabditis elegans, a fost utilizat pe scară largă ca organism model încă din anii 1970, când Sydney Brenner l-a adus în laborator pentru a studia dezvoltarea neuronală (Brenner, 1973). C. elegans sunt viermi mici, transparenți, care au un ciclu de viață rapid și puiet de dimensiuni mari. Majoritatea C. elegans sunt, de asemenea, hermafrodiți autofertili, ceea ce facilitează efectuarea de experimente mari pe mai multe generații. În mod similar cu alte organisme model, genomul C.elegans este, de asemenea, complet secvențiat și peste 60% din genele umane au un ortolog în C. elegans, ceea ce îl face ideal pentru a studia procesele de bază ale biologiei moleculare.
Vârcolacul, Caenorhabditis elegans, a fost utilizat pe scară largă ca organism model încă din anii 1970, când Sydney Brenner l-a adus în laborator pentru a studia dezvoltarea neuronală (Brenner, 1973). C. elegans sunt viermi mici, transparenți, care au un ciclu de viață rapid și puiet de dimensiuni mari. Majoritatea C. elegans sunt, de asemenea, hermafrodiți autofertili, ceea ce facilitează efectuarea de experimente mari pe mai multe generații. În mod similar cu alte organisme model, genomul C.elegans este, de asemenea, complet secvențiat și peste 60% din genele umane au un ortolog în C. elegans, ceea ce îl face ideal pentru a studia procesele de bază ale biologiei moleculare.
C. elegans sunt, de asemenea, destul de ușor de manipulat genetic. Animalele transgenice pot fi realizate prin simpla microinjectare de ADN în vierme, cum ar fi animalele care exprimă markeri fluorescenți (Mello et al., 1991). Genele pot fi, de asemenea, eliminate cu ușurință prin interferență ARN (RNAi) prin hrănirea viermelui cu bacterii care exprimă plasmide specifice (L4440) care conțin gena de interes (Fire et al., 1998). Descoperirea RNAi la vierme i-a recompensat de fapt pe deponenții Andrew Fire și Craig Mello cu Premiul Nobel în 2006.
Unul dintre avantajele majore ale C. elegans este că sunt transparente pe tot parcursul vieții lor. Astfel, orice modificare genetică, cum ar fi exprimarea unei proteine fluorescente sau întreruperea unei gene, poate fi ușor vizualizată într-un organism viu, de la dezvoltarea embrionară până la vârsta adultă. Această capacitate de a manipula genetic și de a vizualiza celulele și țesuturile permite oamenilor de știință să efectueze studii in vivo, ceea ce poate fi destul de dificil în cazul altor organisme model. Viermii au fost utilizați pentru a investiga o serie de sisteme și procese biologice, inclusiv sistemul nervos, dezvoltarea, semnalizarea celulară, îmbătrânirea și mecanotransducția, pentru a numi doar câteva dintre acestea. De exemplu, laboratorul lui Andrew Leifer a utilizat viermele pentru a studia semnalizarea calciului în întregul creier adult, folosind o plasmidă care exprimă un senzor de calciu codificat genetic, GCaMP6 (Nguyen et al., 2015). Dacă vă interesează plasmidele și resursele de C. elegans, consultați pagina Addgene’s Worm Expression.
Căutați mai multe organisme model? Consultați partea a doua din seria de organisme model populare și citiți despre noile sisteme dezvoltate pentru organismele model emergente!
Brenner, Sydney. „The genetics of Caenorhabditis elegans”. Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. „Distinct populations of quiescent and proliferative pancreatic β-cells identified by HOTcre mediated labeling”. Proceedings of the National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. „The zebrafish reference genome sequence and its relationship to the human genome”. Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. „Drosophila-un model versatil în biologie & medicină”. Materials today 14.5 (2011): 190-195.
Mello, Craig C., et al. „Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences”. The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. „Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans”. Proceedings of the National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan, și Charles D. Nichols. „Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery” (Modele de boli umane în Drosophila melanogaster și rolul muștei în descoperirea medicamentelor terapeutice). Pharmacological reviews 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.
.