Atomii și aurul
În 1911, Rutherford și colaboratorii săi Hans Geiger și Ernest Marsden au inițiat o serie de experimente revoluționare care aveau să schimbe complet modelul acceptat al atomului. Ei au bombardat foi foarte subțiri de folie de aur cu particule alfa în mișcare rapidă.

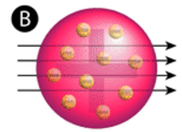

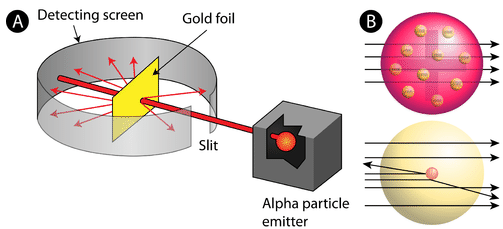
Figura \(\PageIndex{2}\) (A) Configurația experimentală pentru experimentul cu folii de aur al lui Rutherford: Un element radioactiv care emitea particule alfa a fost îndreptat spre o foaie subțire de folie de aur care era înconjurată de un ecran care să permită detectarea particulelor deviate. (B) Conform modelului budincii de prune (sus), toate particulele alfa ar fi trebuit să treacă prin folia de aur cu o deviație mică sau deloc. Rutherford a constatat că un procent mic de particule alfa au fost deviate în unghiuri mari, ceea ce ar putea fi explicat printr-un atom cu un nucleu foarte mic, dens și încărcat pozitiv în centrul său (jos).
Conform modelului atomic acceptat, în care masa și sarcina unui atom sunt distribuite uniform în tot atomul, oamenii de știință se așteptau ca toate particulele alfa să treacă prin folia de aur cu doar o ușoară deviere sau chiar deloc. În mod surprinzător, așa cum se arată în figura \(\PageIndex{2}\) (în timp ce majoritatea particulelor alfa erau într-adevăr nedeviate, un procent foarte mic (aproximativ 1 din 8000 de particule) a ricoșat în folia de aur la unghiuri foarte mari. Unele au fost chiar redirecționate înapoi spre sursă. Nicio cunoștință anterioară nu i-a pregătit pentru această descoperire. Într-un citat celebru, Rutherford a exclamat că a fost „ca și cum ai fi tras un obuz de 15 inch într-o bucată de țesut și acesta s-ar fi întors și te-ar fi lovit.”
Rutherford a trebuit să vină cu un model complet nou al atomului pentru a explica rezultatele sale. Deoarece marea majoritate a particulelor alfa trecuseră prin aur, el a motivat că cea mai mare parte a atomului era spațiu gol. În schimb, particulele care au fost puternic deviate trebuie să fi fost supuse unei forțe extrem de puternice în interiorul atomului. El a concluzionat că toată sarcina pozitivă și majoritatea masei atomului trebuie să fie concentrate într-un spațiu foarte mic din interiorul atomului, pe care l-a numit nucleu. Nucleul este micul, densul, nucleul central al atomului și este compus din protoni și neutroni.
Modelul atomic al lui Rutherford a devenit cunoscut sub numele de modelul nuclear. În atomul nuclear, protonii și neutronii, care cuprind aproape întreaga masă a atomului, sunt localizați în nucleul din centrul atomului. Electronii sunt distribuiți în jurul nucleului și ocupă cea mai mare parte a volumului atomului. Merită să subliniem cât de mic este nucleul în comparație cu restul atomului. Dacă am putea umfla un atom pentru a fi de mărimea unui mare stadion de fotbal profesionist, nucleul ar fi de mărimea unei bile.
Modelul lui Rutherford s-a dovedit a fi un pas important spre o înțelegere completă a atomului. Cu toate acestea, el nu a abordat complet natura electronilor și modul în care aceștia ocupau spațiul vast din jurul nucleului. Pentru acest lucru și pentru alte descoperiri, Rutherford a primit Premiul Nobel pentru Chimie în 1908. Din păcate, Rutherford ar fi preferat să primească Premiul Nobel pentru Fizică, deoarece considera că fizica este superioară chimiei. În opinia sa, „Toată știința este fie fizică, fie colecționare de timbre.”
.