Chemia pomaga nam zrozumieć właściwości i skład otaczającego nas świata. Tutaj dowiesz się o stanach skupienia materii, a także wiele o jednym stanie szczególnym (trzy zgadywanki – nie jest to ciało stałe ani ciecz…).
Stany skupienia materii
W zależności od temperatury, ciśnienia i właściwości substancji, może ona przybierać różne formy fizyczne. Te formy fizyczne nazywamy stanami skupienia materii. Istnieją trzy bardzo dobrze znane stany skupienia materii: Ciała stałe, ciecze i gazy. Istnieją również inne stany skupienia materii. Należą do nich plazma (stan materii podobny do gazu, ale zawiera swobodnie poruszające się elektrony i jony – atomy, które utraciły elektrony) i kondensaty Bosego-Einsteina (BEC) (fale materii, które mogą występować z niektórymi typami atomów w bardzo niskich temperaturach).
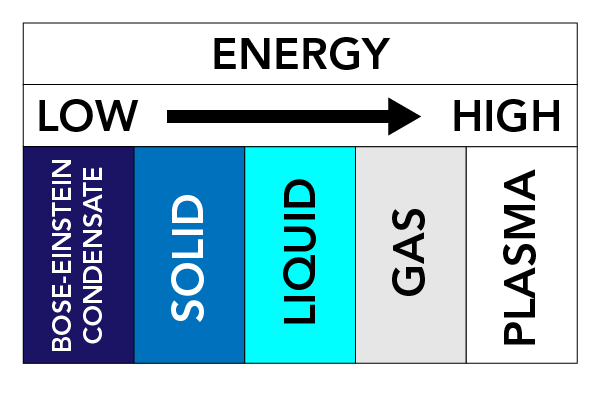
Siły między cząsteczkami i ciśnienie na cząsteczki utrzymują cząsteczki razem. Jeśli podgrzejemy materię (dodamy energii), cząsteczki zaczną poruszać się szybciej i będą miały tendencję do rozchodzenia się od siebie. Ten ruch cząsteczek ma duży wpływ na stan substancji.
Ciała stałe
W ciałach stałych, siły utrzymujące cząsteczki razem są stosunkowo silne, a cząsteczki pozostają bardzo blisko siebie. Cząsteczki mogą drgać, ale nie poruszają się zbytnio. To dlatego ciała stałe są twarde i sztywne. Pozostawione same sobie, ciała stałe zachowają swój kształt.
Płyny
W płynach, siły między cząsteczkami są słabsze niż w ciałach stałych. Cząsteczki są nadal dość blisko siebie, ale mogą poruszać się swobodnie. Ciecze mogą przepływać wewnątrz pojemnika, i nie mają żadnego konkretnego stałego kształtu.
Gazy
Gazy są trudne do odniesienia do, ponieważ są one często niewidoczne, ale znajdują się wszędzie wokół. Można je poczuć, kiedy, na przykład, wieje wiatr. Czasami można je wyczuć, gdy na przykład czujemy zapach gotującego się jedzenia lub gdy skunks został zdenerwowany. Niektóre gazy są ważne dla naszego zdrowia (np. tlen), podczas gdy inne mogą być śmiertelnie niebezpieczne (np. siarkowodór i chlor). Przed operacją możesz otrzymać gaz znieczulający, który zawiera substancje chemiczne, aby złagodzić ból i pozbawić Cię przytomności podczas zabiegu. Gazy są również odpowiedzialne za siłę eksplozji. Przyjrzyjmy się bliżej gazom.
Typy gazów
Są gazy elementarne (składające się z jednego pierwiastka) i gazy będące związkami (składające się z więcej niż jednego pierwiastka). Symbole gazów elementarnych można znaleźć w dowolnym układzie okresowym pierwiastków. Są one podsumowane w poniższej tabeli.
Gaz diatomiczny |
Wzór chemiczny |
Monatomowy Gaz |
Skład chemiczny |
|
|
Wodór |
H2 |
H2 |
H hel |
He |
|
tlen |
O2 |
Neon |
Ne |
|
|
Nitrogen |
N2 |
Argon |
Ar |
|
|
Fluor |
F2 |
Krypton |
Kr |
|
|
Chlor |
Cl2 |
Ksenon |
Xe |
Gaz diatomiczny to taki, w którym podstawową jednostką jest cząsteczka zbudowana z dwóch połączonych atomów. Gaz monatomowy to taki, w którym podstawową jednostką jest pojedynczy atom. Większość gazów to jednak związki, w których chemicznie połączone są dwa lub więcej różnych pierwiastków. Najbardziej powszechnym z nich jest para wodna, H2O. Oto nazwy, wzory i zastosowania niektórych gazów złożonych:
Nazwa zwyczajowa |
Wzór chemiczny |
Gdzie. gdzie zwykle można go znaleźć |
|
Dwutlenek węgla |
CO2 |
Atmosfera, spaliny samochodowe, pop, nasze płuca |
|
Propan |
C3H8 |
Kominki grill, kuchenki kempingowe, paliwo do niektórych pojazdów |
|
Metan |
CH4 |
Składnik gazów cieplarnianych i gazu ziemnego i gazu ziemnego |
|
Ammoniak |
NH3 |
Używany do produkcji nawozów, środków czyszczących |
.