By Alyssa Cecchetelli i Lukas Morgan
Organizmy modelowe są istotnymi narzędziami używanymi przez naukowców na całym świecie. Organizmy te dzielą wiele genów z ludźmi, są łatwe do utrzymania w laboratorium i mają krótki czas generacji, co ułatwia badanie efektów manipulacji genetycznych. W tym wpisie omówimy pięć popularnych organizmów modelowych, ale jest ich o wiele więcej.
Mysz domowa (Mus musculus)
 Zacznijmy od najbardziej preferowanego przez wielu badaczy organizmu modelowego ssaków: myszy (Mus musculus). Myszy mają wiele zalet jako organizmy modelowe ssaków dla naukowców, ponieważ mają stosunkowo krótki czas generacji dla ssaków – czas między urodzeniem się a urodzeniem – około 10 tygodni. Dorosłe myszy rozmnażają się tak często, jak co trzy tygodnie, więc naukowcy mogą jednocześnie obserwować kilka pokoleń myszy.
Zacznijmy od najbardziej preferowanego przez wielu badaczy organizmu modelowego ssaków: myszy (Mus musculus). Myszy mają wiele zalet jako organizmy modelowe ssaków dla naukowców, ponieważ mają stosunkowo krótki czas generacji dla ssaków – czas między urodzeniem się a urodzeniem – około 10 tygodni. Dorosłe myszy rozmnażają się tak często, jak co trzy tygodnie, więc naukowcy mogą jednocześnie obserwować kilka pokoleń myszy.
Ponieważ myszy są genetycznie i fizjologicznie bardziej podobne do ludzi niż wiele innych organizmów modelowych, są one często wykorzystywane do badania chorób ludzkich. Choroby u myszy wykazują wiele fenotypów podobnych do chorób ludzkich i z powodzeniem pomogły badaczom w opracowaniu różnych terapii. Na przykład wielu naukowców wykorzystuje myszy do badania chorób takich jak nowotwory, ponieważ myszy lepiej odtwarzają złożone interakcje między komórkami nowotworowymi, lekami terapeutycznymi i resztą organizmu niż badania na innych organizmach modelowych lub w hodowlach komórkowych. Na przykład laboratorium Scotta Lowe’a wykorzystało myszy do zbadania, jak różne mutacje w białaczce wpływają na różne schematy leczenia (Zuber i in., 2009). Poprzez wstrzykiwanie myszom wektorów retrowirusowych zawierających różne mutacje występujące w białaczce, laboratorium Lowe’a było w stanie zidentyfikować zestaw mutacji, które czyniły komórki nowotworowe bardziej odpornymi na chemioterapię. Możesz znaleźć te plazmidy w Addgene.
Inną zaletą myszy jako organizmów modelowych jest to, że są one genetycznie podatne. Myszy mogą być łatwo manipulowane za pomocą narzędzi takich jak CRISPR w celu stworzenia linii transgenicznych.
Mucha owocowa (Drosophila melanogaster)
 Innym popularnym organizmem modelowym jest Drosophila melanogaster, lub jak jest bardziej powszechnie znana: muszka owocowa. Muszka owocowa jest wykorzystywana w badaniach naukowych od ponad wieku, ale na pierwszy plan wysunął ją Thomas Hunt Morgan, który jest znany jako „ojciec” badań nad Drosophilą. Morgan odkrył, że geny znajdują się w chromosomach za pomocą muszki owocowej na długo przed tym, jak jeszcze wiedzieliśmy, że DNA jest materiałem genetycznym (Jennings, 2011).
Innym popularnym organizmem modelowym jest Drosophila melanogaster, lub jak jest bardziej powszechnie znana: muszka owocowa. Muszka owocowa jest wykorzystywana w badaniach naukowych od ponad wieku, ale na pierwszy plan wysunął ją Thomas Hunt Morgan, który jest znany jako „ojciec” badań nad Drosophilą. Morgan odkrył, że geny znajdują się w chromosomach za pomocą muszki owocowej na długo przed tym, jak jeszcze wiedzieliśmy, że DNA jest materiałem genetycznym (Jennings, 2011).
Mucha owocowa jest doskonałym organizmem modelowym, ponieważ jest łatwa i niedroga w hodowli i utrzymaniu w laboratorium, ma krótki cykl życia od 8 do 14 dni i produkuje dużą liczbę potomstwa, które są składane zewnętrznie. Muszki owocowe są również stosunkowo łatwe do manipulowania genetycznego. Naukowcy mogą stworzyć nową linię muszek w ciągu zaledwie 6 tygodni, w porównaniu do miesięcy potrzebnych do stworzenia transgenicznej linii myszy. Z biegiem lat mucha stała się idealnym organizmem modelowym do badania szeregu zagadnień, w tym rozwoju, genetyki i układu nerwowego. Mucha pojawiła się również jako ważny model choroby ludzkiej z potencjałem do odkrywania leków terapeutycznych, ponieważ szacuje się, że 75% genów wywołujących choroby u ludzi ma funkcjonalnego homologa w muszce (Pandey i Nichols, 2011).
Ogromną zaletą używania muszki owocowej jest cały wachlarz narzędzi genetycznych, takich jak GAL4/UAS i system LexA, który pozwala naukowcom łatwo kontrolować poziom i czasoprzestrzenną ekspresję interesującego ich genu. Ten rodzaj kontroli nad ekspresją genów jest możliwy w innych systemach modelowych, ale może być dość trudny i czasochłonny. GAL4/UAS został po raz pierwszy opisany w 1993 roku przez laboratorium Norberta Perrimona i od tego czasu jest ciągle udoskonalany. Jeśli jesteś zainteresowany tymi systemami, sprawdź laboratorium Geralda Rubina, który stworzył zestaw wektorów modularnych, które mogą być używane do optymalnej kontroli ekspresji genów w określonych komórkach muchy (Pfeiffer et al., 2010).
Drozda (Saccharomyces cerevisiae)
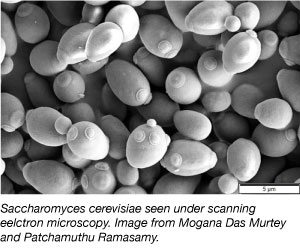 Drozda, jeden z najprostszych organizmów eukariotycznych, jest powszechnie używanym organizmem modelowym w badaniach naukowych. Tak, ten sam rodzaj, którego używamy w chlebach i innych wypiekach! Drożdże są tanie, proste i łatwe do pracy, ponieważ mogą przetrwać w różnych warunkach środowiskowych i podwajają się co 2 godziny. Drożdże są również pierwszym eukariotycznym genomem, który został całkowicie zsekwencjonowany i jest bardzo podatny na manipulacje genetyczne.
Drozda, jeden z najprostszych organizmów eukariotycznych, jest powszechnie używanym organizmem modelowym w badaniach naukowych. Tak, ten sam rodzaj, którego używamy w chlebach i innych wypiekach! Drożdże są tanie, proste i łatwe do pracy, ponieważ mogą przetrwać w różnych warunkach środowiskowych i podwajają się co 2 godziny. Drożdże są również pierwszym eukariotycznym genomem, który został całkowicie zsekwencjonowany i jest bardzo podatny na manipulacje genetyczne.
Komórki drożdży są wspaniałym organizmem modelowym nie tylko z powyższych powodów, ale dlatego, że faktycznie dzielą wiele biologicznych właściwości i procesów z naszymi własnymi komórkami. Podobnie jak komórki ludzkie, DNA drożdży jest upakowane w chromosomy, a około 23% genów drożdży ma swoje odpowiedniki u ludzi (Liu i in., 2017) . Dlatego drożdże mogą być wykorzystywane do badania molekularnych podstaw ludzkich chorób, które są wywoływane przez konkretny gen. Na przykład, kilka genów zmutowanych w ludzkich nowotworach ma homolog zaangażowany w podział komórek drożdży (Pray, 2008). Odkrycia naukowe dokonane na drożdżach mogą być dalej badane na innych organizmach modelowych, które lepiej odtwarzają warunki in vivo podobne do ludzkich.
Na przykład, ze względu na swoją prostotę, drożdże stały się ważnym modelem doświadczalnym w badaniach chorób neurologicznych, takich jak choroba Parkinsona (PD). PD charakteryzuje się przede wszystkim nieprawidłowym składaniem białek, które prowadzi do gromadzenia się w mózgu agregatów białkowych zwanych „ciałami Lewy’ego”. Drożdżowe modele PD, takie jak te, w których dochodzi do nadekspresji toksycznego białka α-synukleiny (najczęstszego białka występującego w ciałach Lewy’ego), są nieocenione w zrozumieniu podstawowych mechanizmów molekularnych leżących u podstaw tej choroby (Menezes i in., 2015). Ponieważ drożdże są organizmami jednokomórkowymi, mogą być również wykorzystywane do łatwego badania przesiewowego wielu związków terapeutycznych w jednym eksperymencie.
Zebrafish (Danio rerio)
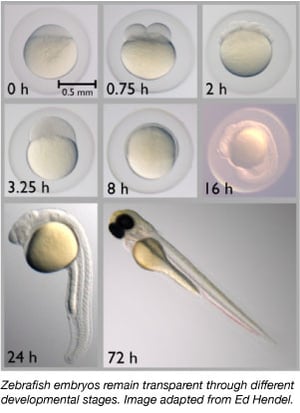 Od lat 60-tych XX wieku, zebrafish stopniowo stał się ważnym organizmem modelowym. Dzielą one około 70% swoich genów z ludźmi, a 85% ludzkich genów związanych z chorobami ma swojego homologa u zeberek (Howe i in., 2013). Zebrafish są małe, łatwe w utrzymaniu, ponieważ są trzymane w dużych grupach, łatwo je hodować i produkują 50-300 jaj na raz. Zarodki Zebrafish są również składane i zapładniane zewnętrznie, co pozwala naukowcom na łatwe manipulowanie nimi. Naukowcy mogą po prostu wstrzykiwać jednokomórkowym embrionom DNA lub RNA, aby edytować ich genom lub tworzyć zwierzęta transgeniczne.
Od lat 60-tych XX wieku, zebrafish stopniowo stał się ważnym organizmem modelowym. Dzielą one około 70% swoich genów z ludźmi, a 85% ludzkich genów związanych z chorobami ma swojego homologa u zeberek (Howe i in., 2013). Zebrafish są małe, łatwe w utrzymaniu, ponieważ są trzymane w dużych grupach, łatwo je hodować i produkują 50-300 jaj na raz. Zarodki Zebrafish są również składane i zapładniane zewnętrznie, co pozwala naukowcom na łatwe manipulowanie nimi. Naukowcy mogą po prostu wstrzykiwać jednokomórkowym embrionom DNA lub RNA, aby edytować ich genom lub tworzyć zwierzęta transgeniczne.
Zebrafish są idealnymi organizmami modelowymi do badań nad rozwojem embrionalnym, ponieważ ich embriony są całkowicie przezroczyste. Dzięki temu naukowcy mogą łatwo obserwować wczesne stadia rozwojowe, co może być trudne u innych gatunków kręgowców. Przezroczystość pozwala również naukowcom łatwo obserwować znakowane fluorescencyjnie białka i tkanki, aby lepiej ocenić procesy rozwojowe.
Na przykład, laboratorium Stainier badało proliferację i różnicowanie komórek β w rozwijającej się trzustce zebrafish. Najpierw znakowali te komórki za pomocą plazmidów. Następnie za pomocą HOTcre, metody, która wykorzystuje indukcję cieplną do kontroli czasowej ekspresji różnych transgenów, grupa Stainera ustaliła, że w rzeczywistości istnieją dwie odrębne populacje komórek β, które pochodzą z różnych regionów trzustki i produkują różne poziomy insuliny (Hesselson i in., 2009).
Robak (Caenorhabditis elegans)
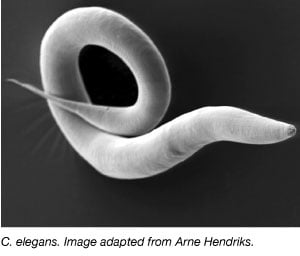 Robak, Caenorhabditis elegans, był szeroko wykorzystywany jako organizm modelowy od lat 70. XX wieku, kiedy Sydney Brenner wprowadził go do laboratorium w celu badania rozwoju neuronów (Brenner, 1973). C. elegans to małe, przezroczyste robaki, które mają szybki cykl życiowy i duże rozmiary czerwia. Większość C. elegans to również samopłodne hermafrodyty, co ułatwia prowadzenie dużych eksperymentów na wielu pokoleniach. Podobnie jak w przypadku innych organizmów modelowych, genom C. elegans jest w pełni zsekwencjonowany, a ponad 60% ludzkich genów ma ortologię w C. elegans, co czyni ją idealną do badania podstawowych procesów biologii molekularnej.
Robak, Caenorhabditis elegans, był szeroko wykorzystywany jako organizm modelowy od lat 70. XX wieku, kiedy Sydney Brenner wprowadził go do laboratorium w celu badania rozwoju neuronów (Brenner, 1973). C. elegans to małe, przezroczyste robaki, które mają szybki cykl życiowy i duże rozmiary czerwia. Większość C. elegans to również samopłodne hermafrodyty, co ułatwia prowadzenie dużych eksperymentów na wielu pokoleniach. Podobnie jak w przypadku innych organizmów modelowych, genom C. elegans jest w pełni zsekwencjonowany, a ponad 60% ludzkich genów ma ortologię w C. elegans, co czyni ją idealną do badania podstawowych procesów biologii molekularnej.
C. elegans są również dość podatne na manipulacje genetyczne. Transgeniczne zwierzęta mogą być wykonane przez proste mikro wstrzyknięcie DNA do robaka, np. zwierzęta, które wyrażają markery fluorescencyjne (Mello et al., 1991). Geny mogą być również łatwo zablokowane poprzez interferencję RNA (RNAi) poprzez karmienie robaka bakteriami wyrażającymi specyficzne plazmidy (L4440), które zawierają interesujący nas gen (Fire et al., 1998). Odkrycie RNAi u robaka przyniosło Andrew Fire i Craigowi Mello Nagrodę Nobla w 2006 roku.
Jedną z głównych zalet C. elegans jest to, że są one przezroczyste przez całe życie. Tak więc każda modyfikacja genetyczna, taka jak ekspresja białka fluorescencyjnego lub przerwanie genu, może być łatwo wizualizowana w żywym organizmie od rozwoju embrionalnego do dorosłości. Ta zdolność do genetycznej manipulacji i wizualizacji komórek i tkanek pozwala naukowcom na prowadzenie badań in vivo, co może być dość trudne w przypadku innych organizmów modelowych. Robaki były wykorzystywane do badania wielu systemów i procesów biologicznych, w tym układu nerwowego, rozwoju, sygnalizacji komórkowej, starzenia się i mechanotransdukcji, by wymienić tylko kilka z nich. Na przykład, laboratorium Andrew Leifera wykorzystało robaka do badania sygnalizacji wapniowej w całym dorosłym mózgu, używając plazmidu, który wyraża genetycznie zakodowany czujnik wapnia, GCaMP6 (Nguyen et al., 2015). Jeśli jesteś zainteresowany plazmidami C. elegans i zasobami sprawdź stronę Addgene’s Worm Expression.
Szukasz więcej organizmów modelowych? Sprawdź część drugą popularnej serii organizmów modelowych i przeczytaj o nowych systemach opracowywanych dla powstających organizmów modelowych!
Brenner, Sydney. „The genetics of Caenorhabditis elegans.” Genetics 77.1 (1974): 71-94. PubMed Central PMCID: PMC1213120.
Hesselson, Daniel, et al. „Distinct populacje quiescent i proliferacyjnych komórek β trzustki zidentyfikowane przez HOTcre mediated labeling.” Proceedings of the National Academy of Sciences 106.35 (2009): 14896-14901. PubMed PMID: 19706417. PubMed Central PMCID: PMC2736433.
Howe, Kerstin, et al. „The zebrafish reference genome sequence and its relationship to the human genome.” Nature496.7446 (2013): 498. PubMed PMID: 23594743. PubMed Central PMCID: PMC3703927.
Jennings, Barbara H. „Drosophila-a versatile model in biology & medicine.” Materials today 14.5 (2011): 190-195.
Mello, Craig C., et al. „Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences.” The EMBO journal 10.12 (1991): 3959-3970. PubMed PMID: 1935914. PubMed Central PMCID: PMC453137.
Nguyen, Jeffrey P., et al. „Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans.” Proceedings of the National Academy of Sciences 113.8 (2016): E1074-E1081. PubMed PMID: 26712014.
Pandey, Udai Bhan, and Charles D. Nichols. „Modele ludzkich chorób w Drosophila melanogaster i rola muchy w odkrywaniu leków terapeutycznych”. Pharmacological reviews 63.2 (2011): 411-436. PubMed PMID: 21415126. PubMed Central PMCID: PMC3082451.
.