Multiplex ligation-dependent probe amplification (MLPA) jest techniką molekularną opracowaną przez MRC-Holland w 2002 roku. W skrócie, MLPA jest czułą techniką, która pozwala na ilościowe oznaczenie sekwencji kwasów nukleinowych, szybko i efektywnie. Jest wykonywana w wielu laboratoriach na całym świecie i może być stosowana do wykrywania zmian liczby kopii (takich jak delecje lub duplikacje) genu, identyfikacji statusu metylacji DNA, wykrywania polimorfizmów pojedynczych nukleotydów (SNPs) i mutacji punktowych oraz ilościowego oznaczania mRNA. Dlatego też jest on wykorzystywany w wielu dziedzinach badawczych i diagnostycznych, takich jak cytogenetyka, badania nad rakiem i genetyka człowieka, między innymi.
Jak to działa?
MLPA składa się z następujących etapów (Rysunek 1):
- Denaturacja
- Hybrydyzacja
- Ligacja
- Amplifikacja (przez PCR)
- Rozdzielanie fragmentów i analiza danych
Rycina 1 – Wizualizacja techniki MLPA (zaadaptowana z Schouten, Jan P., et al.1). Możemy również zaobserwować typowy elektrofereogram uzyskany w wyniku analizy MLPA pokazujący delecję eksonu 46 (czerwona strzałka). (Elektroferogram zaadaptowany z https://commons.wikimedia.org/wiki/File:MLPA_in_GeneMarker.jpg)
1-Denaturacja i 2 – Hybrydyzacja
Denaturacja polega na rozdzieleniu wyżarzonych nici DNA, tak że dwuniciowe DNA staje się jednoniciowe.
Hybrydyzacja polega na hybrydyzacji próbki DNA do specyficznych sond. Ponieważ jest to technika multipleksowa, można analizować każdą próbkę do 60 sond jednocześnie, celując w ten sposób w różne miejsca!
Te sondy mają sekwencję primera, która wiąże się z primerem PCR w procesie amplifikacji. Wszystkie różne sondy będą miały tę samą sekwencję wiązania primera. Dodatkowo, sondy mają również sekwencję hybrydyzacji komplementarną do miejsca docelowego, która pozwoli sondzie związać się z DNA. Obie sondy będą hybrydyzować na sąsiednich miejscach na nici DNA.
Jedna z sond z pary zawiera sekwencję buforową, która ma różną długość dla każdego miejsca docelowego. Długość sekwencji buforowej zmienia się pomiędzy różnymi sondami, umożliwiając multipleksowanie. Tak więc, można oczekiwać, że każdy produkt amplifikacji będzie miał unikalną długość!
3-Ligacja
Krok ligacji spowoduje związanie dwóch sond razem. W tym kroku, specyficzny enzym zwany ligazą DNA jest używany. Wiąże on sondy, które są już zhybrydyzowane w sąsiadujących miejscach nici DNA w miejscu docelowym. Ligazą używaną w protokołach MLPA jest ligaza-65, enzym ligazowy zależny od NAD, który może być również przydatny w innych zastosowaniach.
Teraz pojawia się pytanie: jeśli naszym celem jest ligacja obu sond, dlaczego są one oddzielnymi cząsteczkami na początku? Cóż, obie sondy zawierają miejsca wiążące dla PCR-primerów. Oznacza to, że gdybyśmy mieli użyć sond jako pojedynczej cząsteczki, otrzymalibyśmy produkt amplifikacji, nawet bez docelowego miejsca DNA, co dałoby nam niespecyficzną amplifikację. Enzym ligaza jest niezwykle specyficzny: jeśli występują jakiekolwiek niedopasowania pomiędzy sondą a miejscem docelowym, ligaza nie będzie w stanie związać sond i nie dojdzie do amplifikacji. W konsekwencji MLPA wykrywa specyficzne mutacje punktowe, a nawet odróżnia pseudogeny od prawdziwego genu docelowego.
4-Amplifikacja
Kolejnym krokiem jest amplifikacja, która jest zasadniczo reakcją łańcuchową polimerazy (PCR) (Tabela 1). Na etapie PCR dodawana jest polimeraza, dNTPs oraz primer forward i reverse. Ponieważ wszystkie sondy mają tę samą sekwencję primera PCR, do badania wszystkich naszych celów konieczne będzie dodanie tylko jednej pary uniwersalnych primerów. Primer forward jest znakowany fluorescencyjnie, co pozwala na wizualizację i kwantyfikację podczas analizy.
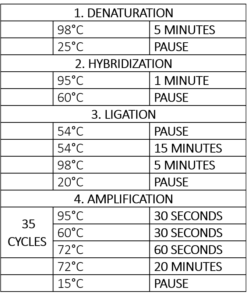
Tabela 1 – Program termocyklera dla reakcji MLPA
5-Fragment Separation and Data Analysis
Po amplifikacji, fragmenty są rozdzielane za pomocą elektroforezy kapilarnej. Elektroforeza kapilarna oddziela fragmenty na podstawie ich długości i pokazuje fragmenty o różnej długości jako wzory pików, zwane elektroforegramami (Rysunek 1). Każdy amplikon ma inny znany rozmiar, ze względu na sekwencję stuffer na każdej specyficznej sondzie, i dlatego każdy amplikon może być określony ilościowo podczas analizy danych.
Dane uzyskane przez elektroforezę kapilarną będą danymi wejściowymi do analizy. MRC-Holland udostępnia darmowe oprogramowanie do analizy danych – Coffalyser.
Poprzez porównanie każdej próbki z zestawem próbek referencyjnych, możemy uzyskać stosunek sond. Ten stosunek sond poinformuje nas o liczbie kopii danego genu. Ponieważ większość ludzkich genów jest diploidalna, jeśli próbka przedstawia dwie kopie, stosunek będzie wynosił 1,0; tzn. sondy próbki uzyskały tę samą liczbę genów co próbka referencyjna.
Jednakże, jeśli stosunek wynosi 0,5 u osobnika występowała tylko jedna kopia genu, co prawdopodobnie oznacza heterozygotyczną delecję genu docelowego. Jeśli, z drugiej strony, stosunek wynosi 1,5, prawdopodobnie mamy do czynienia z heterozygotyczną duplikacją genu.
MRC-Holland oferuje wiele różnych zestawów, które mogą stanowić rozwiązanie Państwa problemów. Jednakże, jeśli próbujesz znaleźć coś nieco bardziej niejasnego lub zbadać coś, czego nie ma w żadnym zestawie, możesz zaprojektować własne sondy. Radzę uważnie przeczytać protokół projektowania sond syntetycznych.
Wady MLPA
- MLPA jest bardzo czułą, solidną i wysokowydajną techniką.
- Może rozróżniać mutacje punktowe, jak również duplikacje/delecje genów. Dlatego ma ogromną przewagę nad innymi technikami, takimi jak sekwencjonowanie, które mogą znaleźć tylko mutacje punktowe. Ponadto, w przeciwieństwie do FISH, MLPA może wykryć małe zmiany w genach.
- Wyniki są dostępne w ciągu 24 godzin, a ponieważ jest to reakcja multipleksowa, pozwala na szybkie i skuteczne zbieranie informacji.
- Małe zmiany w protokole MLPA mogą pozwolić na różnorodne zastosowania. Na przykład, poprzez dodanie dodatkowego etapu trawienia, MLPA może być również wykorzystywana do wykrywania wzorców metylacji w DNA (Methylation specific-MLPA (MS-MLPA)).
Ograniczenia MLPA
- MLPA jest niezwykle wrażliwa na zanieczyszczenia. Dlatego należy zachować szczególną ostrożność podczas przygotowywania próbek i wykonywania tej techniki.
- Może wystąpić spadek sygnału z sondy z powodu rzadkiego polimorfizmu lub mutacji i może być konieczne zbadanie go innymi technikami.
MLPA jest wspaniałą techniką, która może być używana do różnych zastosowań i daje wyniki szybko i skutecznie. Jednakże, nie jest pozbawiona czkawki. Jak wszyscy wiemy, każda technika ma pewne wady, a każda aplikacja musi być dokładnie zbadana, aby upewnić się, że używamy najbardziej wydajnej i czułej techniki.
Czy kiedykolwiek używałeś MLPA? Jakie są Twoje przemyślenia na temat tej techniki?
.