Wprowadzenie
Ten nowotwór wywodzący się z nabłonka dróg żółciowych, czyli cholangiocarcinoma (CC), stanowi 10% nowotworów wątrobowo-żółciowych i 2% nowotworów złośliwych.1,2 CC można podzielić na 3 podtypy, w zależności od ich anatomicznego pochodzenia w obrębie przewodu żółciowego: wewnątrzwątrobowy lub obwodowy CC (ICC), okołowątrobowy CC lub guz Klatskina (PHC) oraz dystalny CC.
PHC, który jest przedmiotem niniejszej rewizji, jest najczęstszy i stanowi około 40%-60% wszystkich CC.2,3 Nowotwór ten jest agresywny i niemy, z niespecyficznymi objawami aż do zaawansowanego stadium, co prowadzi do późnego rozpoznania i krótkiego przeżycia bez operacji, wynoszącego od 6 do 12 miesięcy.4 Operacja, która jest jedyną dostępną opcją leczniczą, jest możliwa tylko u około 47% pacjentów w momencie rozpoznania.5-8 Najważniejsze czynniki prognostyczne dla tego nowotworu są zwykle związane z opcjami chirurgicznymi, a najważniejszymi czynnikami są stadium zaawansowania nowotworu, wielkość, zajęcie zwojów i naczyń, przerzuty wewnątrzwątrobowe i typ histologiczny.9-Przestrzeń anatomiczna zajmowana przez PHC jest ograniczona wejściem do przewodu torbielowatego na poziomie dystalnym oraz rozwidleniem prawego i lewego przewodu wątrobowego na poziomie proksymalnym.1,12 Najszerzej stosowane klasyfikacje obejmują wszystkie CC, które pochodzą ze zbiegu dróg żółciowych lub jego okolic. Niektóre grupy sugerują, że CC wywodzące się z miąższu wątroby mogą czasami zajmować zbiegowisko żółciowe, a ich początek znajduje się w przestrzeni anatomicznej wyznaczonej przez źródło tylnej gałęzi prawej żyły wrotnej i więzadło krzyżowe.13-15 Te ICC obejmujące zbiegowisko żółciowe byłyby leczone w taki sam sposób jak guzy o pochodzeniu pozawątrobowym, a przeżywalność jest podobna do PHC w tym samym stadium. Są to zwykle guzy wysoko rozwinięte, z lokoregionalną inwazją naczyń i węzłów chłonnych. Wątpliwości dotyczące biologicznego zachowania tych guzów spowodowały, że wiele grup wykluczyło je z grupy guzów okołowątrobowych. W badaniu opublikowanym przez Ebata i wsp.13,15 obejmującym 250 chorych poddanych resekcji z powodu CC z zajęciem zbiegów, analizowano stopień zaawansowania i przeżycie w zależności od tego, czy guz był wewnątrzwątrobowy z zajęciem zbiegów (ICC), czy też pochodził z zewnątrzwątrobowego przewodu żółciowego (PHC). W sumie 83 pacjentów miało ICC, a 167 PHC. Porównując stopnie zaawansowania, pacjenci z ICC wykazywali większą częstość zajęcia naczyń i węzłów chłonnych, z TNM wyższym niż w grupie PHC, prezentując III i IV stopień zaawansowania w 59% przypadków, w porównaniu z 38% w grupie PHC. Niemniej jednak, jeśli podzielić przeżycie w zależności od stadium w obu grupach, nie ma istotnych statystycznie różnic po 5 latach, z nieznacznie wyższym przeżyciem całkowitym w grupie PHC (odpowiednio 20% vs 29%; P=.057), tak że stwierdzono, że są one porównywalne pod względem leczenia i przeżycia. Dzięki ulepszonym testom diagnostycznym i wiedzy histopatologicznej w przyszłości być może będziemy w stanie lepiej określić, czy są to 2 odrębne jednostki, czy też klinicznie i biologicznie są takie same.
Charakterystyka histopatologiczna
90% PHC to gruczolakoraki. 10% to raki gruczołowo-kwarcowe lub płaskonabłonkowe, które w niektórych przypadkach były związane z występowaniem kamicy, torbieli lub anomalii dróg żółciowych w wywiadzie. Zgodnie z wyglądem guza, typem wzrostu oraz biologicznym i klinicznym zachowaniem PHC, klasyfikuje się je jako16,17:
- –
Rak guzowaty lub „tworzący masę” CC: jest to najczęstsza forma prezentacji w ICC, chociaż można go również znaleźć w dużej liczbie PHC. Charakteryzuje się tworzeniem się masy guza z wyraźnie określonymi brzegami. Ma on duży odczyn włóknisty, częsta jest również martwica centralna. Guz ten powstaje w otworze przewodu żółciowego, wnika w jego ścianę i rozprzestrzenia się, rosnąc trójwymiarowo, tworząc guzowatą masę, która daje objawy obturacyjne.16-19
- –
Infiltrujący CC okołoprzewodowy: guzy tego typu rosną wzdłuż przewodu żółciowego w postaci koncentrycznego podłużnego zgrubienia przez tkankę łączną wokół przewodu, powodując zwężenie lub całkowitą niedrożność uszkodzonego przewodu żółciowego.19 Większość PHC należy do tego typu i są one trudne do zidentyfikowania przy użyciu technik obrazowania.17
- –
Wewnątrzprzewodowy lub wewnątrzprzewodowy brodawkowaty CC: ta odmiana charakteryzuje się obecnością powierzchownych i wewnątrzściennych guzów w przewodzie żółciowym. Produkują one mucynę i powodują częściową niedrożność i poszerzenie przewodów.16 Guz ten charakteryzuje się niskim stopniem złośliwości i jest zwykle niewielkich rozmiarów, choć może rozprzestrzeniać się przez śluz żółciowy, dając początek guzom mnogim (papilomatoza lub brodawczakowatość).20
Znaczenie tego zróżnicowania polega na różnicach w przeżywalności w zależności od omawianego podtypu. W kilku badaniach wykazano, że pacjenci z typem wewnątrzprzewodowym brodawkowatym mają lepsze rokowanie niż pacjenci z odmianą twardówkowo-węzłową,21 ze średnim czasem przeżycia wynoszącym odpowiednio 55 i 33 miesiące,22 podczas gdy zajęcie naczyń i zwojów nerwowych jest rzadsze w podtypie wewnątrzprzewodowym brodawkowatym.
Podsumowując, większość PHC stanowią gruczolakoraki o wzorze wzrostu okołoprzewodowego, co wiąże się z gorszym rokowaniem, natomiast wariant ze wzrostem wewnątrzprzewodowym jest najrzadszy, chociaż charakteryzuje się lepszym rokowaniem.
Systemy klasyfikacji
Systemy klasyfikacji PHC można podzielić na klasyfikacje przed- i pooperacyjne. Z tych pierwszych, stosowanych podczas planowania operacji, najważniejszym systemem jest klasyfikacja Bismutha-Corlette’a. Wskazuje ona, który płat jest preferowany. Wskazuje ona, który płat jest preferencyjnie dotknięty chorobą, a tym samym wskazuje, jaki rodzaj hepatektomii powinien być zastosowany (ryc. 1).23 Klasyfikacja ta została wynaleziona w latach 70. i nie uwzględnia ani zajęcia węzłów chłonnych, ani przerzutów, dlatego obecnie ma mniejszą wartość prognostyczną.
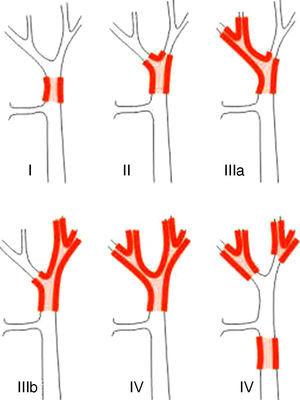
Klasyfikacja Bismuth-Corlette23.
Inną klasyfikacją przedoperacyjną stosowaną w USA jest klasyfikacja opublikowana przez Jarnagina i wsp.10 z Memorial Sloan Kettering Cancer Centre, New York. Klasyfikacja ta ma na celu przewidywanie resekcyjności guzów, biorąc pod uwagę 3 czynniki rozszerzenia miejscowego. Są to rozszerzenie dróg żółciowych, zajęcie naczyń krwionośnych i atrofia płata. Klasyfikacja ta nie uwzględnia zajęcia węzłów chłonnych ani przerzutów, dlatego też ma mniejszą wartość prognostyczną. Ponieważ resekcyjność różni się w poszczególnych grupach, a tendencja jest w kierunku coraz bardziej agresywnych metod leczenia, jej wartość będzie zależała od kryteriów nieresekcyjności obowiązujących w poszczególnych ośrodkach. Miejscowe zajęcie nie powinno być obecnie kryterium nieresekcyjności, pod warunkiem że jesteśmy w stanie osiągnąć R0 za pomocą resekcji chirurgicznej.
Spośród klasyfikacji pooperacyjnych najczęściej stosowana jest klasyfikacja TNM Unii Międzynarodowej Kontroli Raka (Union for International Cancer Control, UICC), wydanie siódme.12 Klasyfikacja ta uwzględnia dane patologiczne, takie jak rozległość miejscowa, zajęcie naczyń, zajęcie węzłów chłonnych i przerzuty, w celu stworzenia klasyfikacji, która obejmuje rozległość guza i ma charakter prognostyczny.
Ostatnio „Japanese Study Group on Perihilar Cholangiocarcinoma” (JSGPH) opublikowała opracowanie, w którym zaproponowała modyfikację klasyfikacji „Union for International Cancer Control”. Podstawowe różnice przedstawiono w tabeli 1, a polegają one przede wszystkim na13:
-
nieuznawaniu Bismuth IV za T4. W związku z tym klasyfikacja JSGPH nie uwzględnia obustronnego rozszerzenia dróg żółciowych jako czynnika pogarszającego rokowanie w przypadku uzyskania resekcji R0.
-
W odniesieniu do stadiów zaawansowania za najgorsze rokowanie uznaje zajęcie węzłów chłonnych. Dlatego uważają, że zajęcie węzłów chłonnych jest stadium iva, a nie iiib (TNM7).
Porównanie podstawowych różnic między klasyfikacją UICC TNM 7 a propozycją JSGPH.
| Klasyfikacja nowotworów | UICC | Propozycja JSGPH |
|---|---|---|
| Tis. | Carcinoma in situ | |
| T1 | Tumor confined to the biliary duct | |
| T2a | Przedziera się przez ścianę przewodu i atakuje tkankę tłuszczową okołowątrobową | |
| T2b | Wchodzi do miąższu wątroby | |
| T3 | Jednostronna inwazja tętnicy/żyły wątrobowej | |
| T4 | Inwazja głównej gałęzi HA/PV, Bizmut IV, lub Bismuth III z kontralateralną inwazją A/V | Naczyniowa inwazja głównej odnogi HA/PV, z obustronną inwazją naczyniową lub kontralateralną |
| Stopień zaawansowania TNM | ||
| 0 | Tis N0 M0 | |
| I | T1 N0 M0 | |
| II | T2 N0 M0 | |
| IIIa | T3 N0 M0 | |
| IIIb | T1-3 N1 M0 | T4 N0 M0 |
| Iva | T4 N× M0 | T× N1 M0 |
| Iva | T4 | |
| Ivb | T× N× M1 | |
HA, tętnica wątrobowa; JSGPH, Japanese Study Group on Perihilar Cholangiocarcinoma; TNM, przerzuty do węzłów chłonnych guza; UICC, Union for International Cancer Control; PV, żyła wrotna.
Na poziomie europejskim utworzono międzynarodowy rejestr guzów okołowrotnych leczonych chirurgicznie, prowadzony przez „International Cholangiocarcinoma Group for the Staging of PHC”. Grupa ta opublikowała nową klasyfikację1 , która bierze pod uwagę wielkość guza, wraz z zajęciem dróg żółciowych, żylnych, tętniczych, zwojów i przerzutów, zarówno przed jak i pooperacyjnie. Niemniej jednak, ograniczenia tej klasyfikacji polegają na tym, że opisuje ona jedynie cechy guza i operację, która ma być wykonana, bez dzielenia pacjentów na grupy lub stadia według tych zmiennych. W rezultacie nie jest możliwe wyciągnięcie wniosków prognostycznych, jak również nie jest możliwe porównanie wyników różnych grup.
Wcześniejsze publikacje wskazują, że klasyfikacją przedoperacyjną stosowaną obecnie najczęściej w celu podjęcia decyzji o rodzaju resekcji jest klasyfikacja Bismutha-Corlette’a, podczas gdy klasyfikacja TNM 7 jest używana do określenia długoterminowego rokowania.
Strategie diagnostyczne
Objawy związane z PHC to najczęściej: żółtaczka (90%), utrata masy ciała i ból brzucha (35%), świąd (26%) i ostre zapalenie dróg żółciowych (10%).17 Ze względu na te objawy wstępne rozpoznanie jest zwykle stawiane za pomocą USG jamy brzusznej i jest to dobre badanie przesiewowe. Inne badania diagnostyczne dla tego typu guza to:
- –
Ultrasonografia Dopplerowska jamy brzusznej: umożliwia ocenę drożności tętnic i wrót (zakrzepica), co może warunkować resekcyjność guza i strategię terapeutyczną, chociaż nie jest badaniem z wyboru w ocenie zajęcia naczyń.
- –
Komputerowa tomografia osiowa jamy brzusznej: jest przydatna w diagnostyce guza pierwotnego i rozszerzenia choroby, z 80% czułością w ocenie rozszerzenia dróg żółciowych. Jest to technika z wyboru dla przedoperacyjnej oceny anatomii naczyń, z czułością 93% i 87% odpowiednio dla oceny zajęcia tętnic i wrót. Ma niską czułość w przedoperacyjnej ocenie zajęcia węzłów chłonnych (50%).14,24 Jest również przydatna w wykonywaniu badań wolumetrycznych i obliczaniu objętości wątroby pozostałej po resekcji chirurgicznej. Jest to również najbardziej ekonomiczne badanie do przedoperacyjnej oceny stopnia zaawansowania.
- –
Rezonans magnetyczny i cholangiografia rezonansu magnetycznego (RM-cholangiografia): najlepsze badanie do rozpoznania guza pierwotnego i oceny poszerzenia dróg żółciowych. Jej czułość wynosi 86%-100% i jest lepsza od cholangiografii bezpośredniej, jest też badaniem nieinwazyjnym.25 Z drugiej strony ma niską czułość w ocenie zajęcia naczyń (73%) i czułość 80% w ocenie inwazji na miąższ wątroby.
- –
Bezpośrednia cholangiografia: endoskopowa cholangiopankreatografia wsteczna (ERCP) i cholangiografia przezwątrobowa (TPHC): informują o stopniu niedrożności dróg żółciowych i umożliwiają pobranie próbek ze zmiany do cytologii, a ich czułość wynosi 20%. Obecnie zostały one zastąpione w diagnostyce przez cholangiografię MR. Są bardzo przydatne w przedoperacyjnym drenażu dróg żółciowych oraz w paliatywnym leczeniu PHC, z założeniem preferencyjnie stentów powlekanych metalem.26-28
- –
Endoskopowa ultrasonografia: jest przydatna do oceny zajęcia zwojów w okolicy pnia celiakii i okolicy okołotrzustkowej, ustalania stopnia zaawansowania przedoperacyjnego i umożliwienia wykonania biopsji aspiracyjnej cienkoigłowej.
- –
Pozytonowa tomografia emisyjna: jest przydatna w badaniu chorych z podejrzeniem zajęcia przerzutów, jak również zajęcia gruczolaków w pniu celiakii. Jej czułość jest kontrowersyjna i może wahać się od 38% do 90%, w zależności od opublikowanych serii.14,24,29
- –
Markery nowotworowe: ich przydatność jest ograniczona, a najczęściej stosowany jest CA 19.9. W większości badań oceniano je w nowotworach trzustki i w mniejszym stopniu w CC, nie precyzując ich lokalizacji i charakterystyki. Na stężenie tych markerów w surowicy ma duży wpływ niedrożność dróg żółciowych i żółtaczka z powodu ich żółciowej eliminacji. Zaproponowano różne wartości prawidłowe, w zależności od obecności hepatopatii (300U/ml) lub żółtaczki (1000U/ml), natomiast w raku trzustki uzyskuje się czułość powyżej 70%, przy swoistości powyżej 95%. Jego stężenie u tych chorych jest bardzo zróżnicowane i nie koreluje z wielkością guza, choć koreluje z zajęciem przerzutami. Czułość i swoistość tego markera można zwiększyć, łącząc go z CEA, przede wszystkim w przypadkach Lewis A ujemnych (nieprodukujących CA 19,9).30
Z powyższych danych można wywnioskować, że w diagnostyce PHC najczęściej rozpoczynamy badania od badania ultrasonograficznego. Odbywa się to w kontekście chorego z żółtaczką, natomiast tomografia komputerowa i cholangiografia MR są najlepszymi badaniami stagingowymi i najbardziej zalecanymi przed zabiegiem operacyjnym. Do badania objętościowego można wykorzystać MR lub tomografię komputerową, w zależności od rodzaju aparatury lub programów komputerowych dostępnych w poszczególnych szpitalach. W przypadku wątpliwości co do rozsiewu do węzłów chłonnych, który może stanowić przeciwwskazanie do operacji, zaleca się wykonanie pozytonowej tomografii emisyjnej lub endoskopii aspiracyjnej cienkoigłowej.
Kryteria nieresekcyjności
Operacja jest jedynym sposobem leczenia PHC i zapewnia najlepsze długoterminowe przeżycie. Kryteria przyjęte dla resekcji chirurgicznej rozszerzyły się w ciągu ostatnich lat, od opisanych początkowo przez zespół z Memorial Sloan Kettering Cancer Center przez Burke’a i wsp.31 w 1998 roku, do ostatnio wprowadzonych podejść wykorzystujących resekcję naczyniową i rozszerzone hepatektomie.3,5,32-Kryteria nieresekcyjności różnią się w zależności od szpitala, a najbardziej rozpowszechnione to: zajęcie naczyń krwionośnych po jednej stronie z zajęciem dróg żółciowych po stronie przeciwnej do podziału radykalnego drugiego stopnia, odległe przerzuty do wątroby, zajęcie naczyń krwionośnych w obu płatach wątroby, zajęcie zewnątrzwątrobowe lub otrzewnej oraz zajęcie gruczolakowate pnia celiakii, tętnicy krezkowej górnej lub okolicy paraaortalnej.3,5,8,31
W wieloośrodkowym badaniu opublikowanym przez De Jong i wsp.34, w którym analizowano 305 chorych operowanych z powodu PHC w 7 różnych ośrodkach w USA i Europie, i które obejmowało chorych z zajęciem wnęki, w analizie wieloczynnikowej jedynymi 2 istotnymi statystycznie czynnikami prognostycznymi były zajęcie marginesu resekcji i zajęcie węzłów chłonnych (P=,02). W badaniu opublikowanym przez Ebatę i wsp.,15 analizującym 1352 chorych operowanych w 8 japońskich szpitalach z powodu PHC z zamiarem leczenia operacyjnego, w analizie wieloczynnikowej statystycznie istotnymi czynnikami rokowniczymi okazały się: inwazja naczyń, inwazja trzustki, zajęcie węzłów chłonnych, obecność przerzutów i zajęcie marginesu resekcji. Zajęcie węzłów chłonnych i obecność przerzutów były czynnikami powodującymi gorsze przeżycie 5 lat w porównaniu z pozostałymi (odpowiednio 10%, 20% i 63%). Wyniki te przemawiają za stosowaniem chirurgii w przypadku tych nowotworów, jeżeli pomimo miejscowego zaawansowania możliwe jest wykonanie resekcji R0, biorąc pod uwagę, że możliwe jest wydłużenie przeżycia do 5 lat niezależnie od miejscowego zaawansowania.
Ze względu na wszystkie powyższe względy zaleca się indywidualną ocenę każdego przypadku i zastosowanie chirurgii, jeżeli możliwe jest wykonanie resekcji R0 przy braku przerzutów odległych lub zajęcia otrzewnej. Obustronne zajęcie dróg żółciowych i miejscowych naczyń krwionośnych nie powinno być zatem kryterium nieresekcyjności, jeżeli możliwe jest operowanie z zachowaniem ponad 30% objętości wątroby i uzyskanie resekcji onkologicznej.
Strategie terapeutyczneDrenaż dróg żółciowych
Ponieważ większość chorych na PHC debiutuje z żółtaczką, jeden z najważniejszych dylematów dotyczy przydatności przedoperacyjnego drenażu dróg żółciowych. Nie jest to jednak zabieg wolny od powikłań, a te związane z ECPW z założeniem stentu to: zapalenie trzustki, perforacja dwunastnicy, migracja dwunastnicy, niedrożność cewnika i przede wszystkim zapalenie dróg żółciowych. Drenaż przez CTPH wiąże się z mniejszą częstością występowania przedoperacyjnego zapalenia dróg żółciowych, ale wiąże się z krwotokiem, migracją cewnika, do 5% rozsiewem nowotworu w obrębie trajektorii cewnika oraz dyskomfortem i bólem w strefie wejścia. Ogólnie, zgodnie z opublikowanymi badaniami, ERCP wiąże się z chorobowością 60%, a analogiczna liczba dla CTPH wynosi 31%.14,35
Z powyższych powodów przydatność przedoperacyjnego drenażu dróg żółciowych w chirurgii wątrobowo-trzustkowej została zakwestionowana.36,37 W badaniach tych, obejmujących wszystkie rodzaje chirurgii wątrobowo-żółciowej, wykazano, że przedoperacyjny drenaż dróg żółciowych u chorych z żółtaczką zwiększa związaną z tym chorobowość bez poprawy przeżywalności, zwiększając głównie powikłania związane z zakażeniami. W europejskim wieloośrodkowym badaniu opublikowanym w 2013 roku przez Fargesa i wsp.38 retrospektywnie przeanalizowano 366 chorych, u których z powodu PHC wykonano hepatektomię lub rozszerzoną hepatektomię i resekcję dróg żółciowych. Sklasyfikowano ich w zależności od tego, czy wykonano przedoperacyjny drenaż dróg żółciowych, czy też nie. Grupę bez przedoperacyjnego drenażu (non-PBD) stanowiło 186 chorych, a grupę z drenażem żółciowym (PBD) 180 chorych. Grupy były homogenne pod względem wieku, zaawansowania nowotworu i resekcji wrotnej. W grupie PBD wykonano więcej hepatektomii prawostronnych (56% vs 44%). Porównując obie grupy pod względem rodzaju wykonanej operacji, chorzy poddani hepatektomii prawej wykazywali większą liczbę przypadków pooperacyjnej niewydolności wątroby, jeśli należeli do grupy non-PBD, z częstością 16% vs 4% w grupie PBD (P=.009). W analizie wielowariantowej czynników związanych z większą śmiertelnością w grupie hepatektomii prawej, posiadanie poziomu bilirubiny poniżej 3mg/dL przed operacją było czynnikiem istotnym statystycznie. Jednak w przypadku porównania obu grup pacjentów po hepatektomii lewej, w grupie PBD stwierdzono większą liczbę przypadków posocznicy pooperacyjnej, z częstością 6%, w porównaniu do 0% w grupie bez PBD (P=.014). Badanie to pokazuje, że chociaż prawdą jest, iż drenaż dróg żółciowych zwiększa częstość występowania pooperacyjnej sepsy, to drenaż dróg żółciowych powinien być wykonywany u tych chorych, którzy mają być poddani prawej hepatektomii, aby zmniejszyć śmiertelność związaną z pooperacyjną niewydolnością wątroby, a inne badania potwierdzają tę teorię.39 Biorąc pod uwagę, że w leczeniu PHC jedynymi badaniami, które wykazały większą przeżywalność, są te, które popierają rozległe resekcje w celu osiągnięcia resekcji R0, drenaż dróg żółciowych jest zalecany, gdy wskazana jest operacja, i może ostatecznie wymagać rozległej hepatektomii obejmującej ponad 50% objętości wątroby lub trisegmentektomii, lub gdy występuje zapalenie dróg żółciowych. Istnieją kontrowersje co do punktu odcięcia stężenia bilirubiny wskazującego na drenaż, a jednym z najczęściej stosowanych jest >10mg/dl.5,37 Zaleca się wykonanie drenażu dróg żółciowych metodą CTPH, z umieszczeniem drenażu zewnętrznego, co pozwala uniknąć manipulacji przy guzie. Takie postępowanie wiąże się z mniejszą częstością zakażeń niż CPRE i umożliwia, u chorych z jednostronnym drenażem, u których nie dochodzi do normalizacji stężenia bilirubiny, zastosowanie obustronnego drenażu żółciowego.35,40
Rozprzestrzenianie się guza w miejscu wkłucia opisywano nawet w 5%-10% przypadków, w których stosowano CTPH,14,24 choć badania te nie precyzują, kiedy stosowano drenaż zewnętrzny czy wewnętrzno-zewnętrzny, i nie uwzględniają czasu, jaki upłynął do operacji. Niektórzy autorzy zalecają stosowanie endoskopowo umieszczonego drenażu dróg żółciowych w celu zapobiegania rozsiewowi w miejscu wkłucia, z mniejszą częstością występowania zapalenia dróg żółciowych i niedrożności stentu niż w przypadku CPRE.41 W tych samych badaniach zwraca się jednak uwagę na trudności związane z przedoperacyjnym obustronnym drenażem dróg żółciowych przy użyciu tego systemu, co utrudnia normalizację stężenia bilirubiny przed operacją u chorych, u których jednostronny drenaż okazał się nieskuteczny.42
Aby zmniejszyć chorobowość związaną z zakażeniami po przedoperacyjnym drenażu dróg żółciowych, sugeruje się systematyczne prowadzenie hodowli żółci po drenażu i podczas operacji. W kilku badaniach wykazano, że 78%-94% tych posiewów jest dodatnich u pacjentów drenowanych, w porównaniu z 20%-30% u pacjentów nie drenowanych,43-45 a enterokoki są najczęściej izolowanymi drobnoustrojami. Grupy te bronią stosowania profilaktycznych antybiotyków, które wprawdzie zwiększają antybiotykooporność izolowanych gatunków, ale w opublikowanych badaniach wykazano, że w ten sposób uzyskuje się zachorowalność na zakażenia pooperacyjne podobną jak w grupach bez drenażu. Wybór antybiotyku zależy od posiewu i antybiogramu, chociaż w większości grup stosowano co najmniej cefalosporyny trzeciej generacji lub fluorochinolony+metronidazol, gdy posiew nie był dostępny lub był ujemny.43,44,46
Paliatywny drenaż dróg żółciowych stosuje się u chorych, u których nie można wykonać resekcji. Drenaż może być wykonany przez ECPW, z pozostawieniem powlekanego stentu metalowego, lub przez CTPH w przypadkach, gdy nie można uzyskać prawidłowego drenażu obu dróg żółciowych za pomocą ECPW.
Tak więc definitywnie, przedoperacyjny drenaż dróg żółciowych powinien być stosowany u wszystkich pacjentów z bilirubiną powyżej lub równą 10mg/dL oraz u tych, u których resekcja wątroby będzie większa niż 50% objętości wątroby. Rodzaj podejścia zależy od szpitala, chociaż CTPH z drenażem zewnętrznym jest zalecane ze względu na unikanie manipulacji guzem i mniejszą częstość występowania zapalenia dróg żółciowych. Niektórzy autorzy zalecają, aby chorzy poddani drenażowi otrzymywali profilaktycznie antybiotyki odpowiednie dla ich kultur żółciowych.
Przedoperacyjna embolizacja wrotna
Przedoperacyjna embolizacja wrotna została opisana w latach 80. ubiegłego wieku, początkowo przez Makuuchi i wsp.47 , a następnie przez Kinoshitę i wsp.48 Celem embolizacji wrotnej jest zwiększenie pozostałej objętości wątroby w tych przypadkach, w których w przedoperacyjnej wolumetrii uznano ją za niewystarczającą, co zmniejsza prawdopodobieństwo pooperacyjnej niewydolności wątroby. W opublikowanej niedawno przez Higuchi i Yamamoto49 metaanalizie obejmującej 836 chorych na PHC, u których wykonano przedoperacyjną embolizację wrotną, zachorowalność wynosiła 1%, a śmiertelność 0,09%. Progresja guza podczas zabiegu, która uniemożliwiła operację, wyniosła 19,4%. Wyniki te potwierdzają tezę, że jej zastosowanie w PHC jest uzasadnione u tych chorych, u których pozostała przedoperacyjna objętość wątroby jest mniejsza niż 30%.
Staging laparoskopowy
W związku z postępem czułości i swoistości nieinwazyjnych badań obrazowych w ostatnich latach, laparoskopia stagingowa odchodzi do lamusa. Najważniejszymi kryteriami nieresekcyjności są zajęcie węzłów chłonnych, rozszerzenie dróg żółciowych i inwazja naczyń krwionośnych. Są one trudne do oceny podczas laparoskopii, której precyzja i skuteczność od lat spada. Wskazuje na to ostatnia rewizja dokonana przez Rotellara i Pardo,50 w której precyzja i skuteczność wynosiły odpowiednio 41% i 72% w 2002 roku oraz 14% i 32% w badaniach opublikowanych w 2011 roku. Spadek ten wynika głównie z udoskonalenia badań nieinwazyjnych, takich jak cholangiografia MR. Jej skuteczność wzrasta, jeśli wybierani są chorzy, u których istnieje duże ryzyko rozsiewu do otrzewnej lub przerzutów do wątroby, co pozwala uniknąć niepotrzebnych laparotomii.50-52 Nieinwazyjne techniki obrazowania są zalecane w zaawansowanych stadiach (T2/3/4), w których możliwe jest zaawansowane zajęcie otrzewnej lub węzłów chłonnych, a których nie można nakłuć za pomocą echo-endoskopii przed wykonaniem przedoperacyjnego drenażu dróg żółciowych. Zawsze wykonujemy laparoskopię stagingową z użyciem śródoperacyjnego badania ultrasonograficznego w celu zwiększenia czułości w wykrywaniu lokoregionalnego zajęcia węzłów chłonnych.53
Leczenie chirurgiczne
Leczenie chirurgiczne jest nadal jedynym sposobem leczenia PHC,3,14 i pozwala na uzyskanie 20%-40% przeżycia w ciągu 5 lat (tab. 2).10,11 Resekcja chirurgiczna musi być wykonana zawsze, jeśli możliwe jest uzyskanie resekcji R0. Głównymi czynnikami wpływającymi na przeżycie po operacji są zajęcie marginesów resekcji, zarówno mikroskopowo (R1), jak i makroskopowo (R2) oraz zajęcie węzłów chłonnych (N1 i N2).14,17,44,54 W kilku badaniach wykazano, że przeżycie wzrasta, jeśli resekcja jest poszerzona w celu uzyskania ujemnych marginesów.3,5,33,45 Proponowane techniki obejmują rozszerzoną hepatektomię z resekcją segmentu ogoniastego, resekcję dróg żółciowych, limfadenektomię wnękową aż do pnia celiakii i rekonstrukcję z hepatojejunostomią.
Survival Following Resection of the PHC According to the Series Published.
| Autor | Rok | Przypadki | Survival at 5 years (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó i wsp. | 2008 | 62 | 43 |
| Figueras i wsp. | 2009 | 19 | 63a |
| Unno i wsp. | 2010 | 125 | 35 |
| Young i wsp. | 2010 | 51 | 29 |
| Igami i in. | 2010 | 298 | 42 |
| Van Gulik i in. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20,2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Survival following hepatic resection due to perihilar cholangiocarcinoma.
Tylko 2 lata obserwacji.
Technologia „no-touch technique” opisana po raz pierwszy przez Neuhaus i wsp.32 Technika ta polega na blokowej resekcji wzgórza wątrobowego bez manipulacji guzem, zwiększając przeżycie chorych do 5 lat w ponad 15% przypadków.3,33,34,55 Technika ta polega zasadniczo na resekcji żyły wrotnej i prawej tętnicy wątrobowej, gdy znajdują się one blisko guza, co zapobiega ich przecięciu, jeśli wymaga to manipulacji guzem, wraz z całkowitą resekcją dróg żółciowych z szeroką limfadenektomią aż do nasady pnia celiakii i rekonstrukcją za pomocą hepaticojejunostomii. Preferowany jest wybór prawego płata wątroby (zasadnicza „technika non-touch” wg Neuhausa)33 , pod warunkiem, że rozrost guza umożliwia włączenie prawej tętnicy wątrobowej, która znajduje się najbliżej guza. Ten rodzaj radykalnej operacji prowadzi do akceptowalnego wskaźnika zachorowalności pooperacyjnej, wynoszącego 50%-70% w zależności od omawianej serii, przy śmiertelności wynoszącej 10%-20%.3,5 Przeżycie pacjentów z PHC w ciągu 5 lat wynosi 20%-40%, podczas gdy w opublikowanych badaniach obejmujących resekcję wrotną i seriach wykorzystujących technikę „no-touch” osiąga 58% w ciągu 5 lat (ryc. 2 i 3).3,5,33
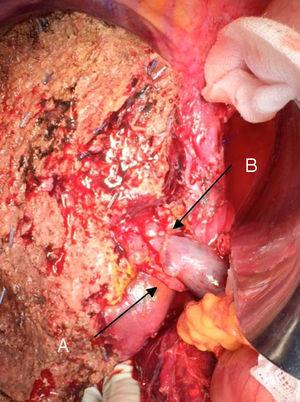
Lewa hepatektomia z powodu guza Klatskina, z resekcją żyły wrotnej: (A) prawa tętnica wątrobowa górnego mesenterium; (B) żyła wrotna.
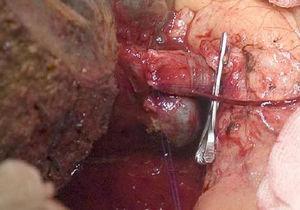
Prawostronna hepatektomia z rekonstrukcją żyły wrotnej.
Należy również podkreślić ostatnie badania, które wykazują wzrost przeżycia pacjentów z przedoperacyjnym zajęciem naczyń po resekcji wrotnej. Osiągają oni nawet wskaźniki przeżycia równe lub wyższe niż pacjenci bez przedoperacyjnego zajęcia naczyń, którzy z tego powodu nie zostali poddani resekcji wrotnej.33,56,57 W badaniach tych częstość występowania powikłań wątrobowych i naczyniowych jest podobna jak w grupie bez resekcji wrotnej, z wyjątkiem pacjentów poddanych resekcji tętnicy, ponieważ u nich wskaźnik śmiertelności jest wyższy niż u pozostałych. W związku z powyższym u chorych z jednostronnym zajęciem wrót lub zajęciem zbiegu w badaniach przedoperacyjnych zaleca się wykonanie zabiegu operacyjnego, resekcji en-bloc i rekonstrukcji naczyniowej. Resekcja i rekonstrukcja tętnicy nie są zalecane, chyba że jest ona wyraźnie zajęta, ponieważ wiąże się to z gorszym wynikiem pooperacyjnym, dlatego w takich przypadkach preferuje się hepatektomię prawostronną.
Podsumowując, zasady chirurgiczne, którymi należy się kierować, to: radykalna operacja z resekcją dróg żółciowych i ogonowych oraz limfadenektomią, z marginesami R0 i bez manipulacji guzem, nawet jeśli wiąże się to z resekcją i rekonstrukcją żyły wrotnej i tętnicy wątrobowej.
Wnioski
Obecnie jedynym leczeniem leczniczym jest resekcja chirurgiczna. Radykalna resekcja en-bloc i rekonstrukcja naczyniowa jest techniką, która osiągnęła najwyższy wskaźnik przeżycia w długim okresie. W celu zmniejszenia śmiertelności pooperacyjnej zaleca się wykonanie drenażu dróg żółciowych, aby zapobiec niewydolności wątroby, z profilaktyką antybiotykową po drenażu i embolizacją wrotną, gdy przyszła pozostała objętość wątroby będzie mniejsza niż 30%. Resekcja R0, zajęcie węzłów chłonnych i przerzuty odległe są nadal najważniejszymi czynnikami rokowniczymi.
Konflikt interesów
Ta zmiana nie była prezentowana ani publikowana częściowo lub w całości w żadnym czasopiśmie lub na żadnym kongresie.
Ta zmiana nie była prezentowana ani publikowana częściowo lub w całości w żadnym czasopiśmie lub na żadnym kongresie.