Należy znać pewne podstawowe właściwości danego związku i jego strukturę Lewisa, aby zrozumieć jego geometrię molekularną, polaryzację i inne takie właściwości. SF4 to wzór chemiczny tetrafluorku siarki. Jest to bezbarwny żrący gaz, który jest używany w syntezie kilku związków organofluorowych. SF4 jest dość niebezpiecznym związkiem, ale jest szeroko stosowany w firmach chemicznych i farmaceutycznych.
| Nazwa cząsteczki | Tetrafluorek siarki ( SF4) |
| No of Valence Electrons in the molecule | 34 |
| Hybrydyzacja SF4 | sp3 hybrydyzacja |
| Kąty wiązań | 102 stopnie i 173 stopnie |
| Geometria molekularna SF4 | Trigonalna dwupiramidowa |
Zrozumienie właściwości tej cząsteczki, takich jak jej reaktywność, polarność i inne, trzeba najpierw poznać strukturę Lewisa SF4.
Zawartość
Geometria molekularna SF4
Łatwo jest zrozumieć geometrię molekularną danej cząsteczki za pomocą wzoru molekularnego lub modelu VSEPR. Wzór molekularny pomaga poznać dokładną liczbę i rodzaj atomów obecnych w danym związku. Tutaj jest jeden atom siarki i cztery atomy fluoru w związku, co czyni go podobnym do wzoru molekularnego AX4E.
Cząsteczki o wzorze cząsteczkowym AX4E mają trójkątną dwupiramidową geometrię molekularną. Tutaj dwa atomy fluoru tworzące wiązania z atomem siarki są na pozycjach równikowych, a pozostałe dwa są na pozycjach osiowych. Ponieważ na atomie centralnym znajduje się jedna para samotna, odpycha ona wiążącą parę elektronów, co nieco zmienia kształt cząsteczki i sprawia, że wygląda ona jak huśtawka. Elektrony podążają za tym wzorem rozmieszczenia zgodnie z regułą VSEPR, aby zminimalizować siły odpychania pomiędzy samotnymi parami elektronów, aby zmaksymalizować stabilność cząsteczki.
Stąd, SF4 ma trygonalną dwupiramidową geometrię molekularną.
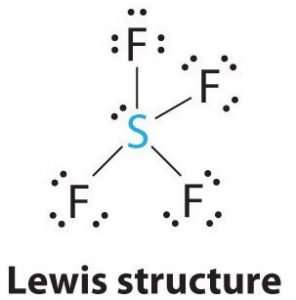
SF4 Struktura Lewisa
Struktura Lewisa jest obrazowym przedstawieniem wiązań i elektronów walencyjnych w cząsteczce. Wiązania tworzone pomiędzy dwoma atomami przedstawione są za pomocą linii, natomiast elektrony walencyjne nie tworzące żadnych wiązań przedstawione są za pomocą kropek. Elektrony walencyjne, które uczestniczą w tworzeniu wiązań nazywamy wiążącymi parami elektronów, natomiast elektrony, które nie uczestniczą lub nie tworzą żadnych wiązań nazywamy niewiążącymi parami elektronów lub parami samotnymi.
Aby narysować strukturę Lewisa SF4, musimy najpierw znać całkowitą liczbę elektronów walencyjnych w tej cząsteczce.
Jak zapewne można zauważyć, w tym związku jest jeden atom siarki i cztery atomy fluoru. Aby poznać całkowitą liczbę elektronów walencyjnych tego związku, musimy znać elektrony walencyjne obu atomów z osobna.
- Elektrony walencyjne siarki: 6
- Elektrony walencyjne fluoru: 4* (7)
( ponieważ są cztery atomy fluoru, musimy wziąć pod uwagę elektrony walencyjne wszystkich atomów)
Całkowita liczba elektronów walencyjnych w SF4 = liczba elektronów walencyjnych w siarce + liczba elektronów walencyjnych we fluorze
= 6 + 28
= 34 elektrony walencyjne
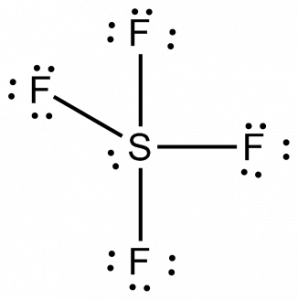
Teraz, gdy znamy całkowitą liczbę elektronów walencyjnych, łatwo będzie nam zrozumieć tworzenie wiązań między atomami i kompletny układ cząsteczki.
Siarka będzie centralnym atomem w tej cząsteczce, ponieważ jest najmniej elektronegatywny, z czterema atomami fluoru tworzącymi wiązania po bokach tego centralnego atomu. Każdy atom fluoru będzie tworzył wiązanie z atomem centralnym, co oznacza, że w strukturze cząsteczki będą cztery wiązania wykorzystujące cztery elektrony walencyjne atomów fluoru i 4 elektrony atomu siarki. Tak więc teraz wykorzystanych jest osiem elektronów walencyjnych, co zmniejsza liczbę elektronów walencyjnych z 34 do 24. Wszystkie atomy fluoru mają sześć elektronów walencyjnych, a atom centralny ma dwa elektrony walencyjne.
Narysuj linie między S i F, aby pokazać wiązania, a dla samotnych par elektronów użyj kropek. Każdy atom fluoru będzie miał trzy pary 6 elektronów walencyjnych (pokazane jako kropki) na atomie, wraz z jednym wiązaniem z siarką. W przeciwieństwie do tego, centralny atom będzie miał dwa elektrony walencyjne i cztery wiązania.
Stąd, centralny atom, siarki, będzie miał jedną samotną parę elektronów i cztery wiążące pary elektronów w strukturze Lewisa SF4. W tym samym czasie każdy atom fluoru będzie miał trzy samotne pary.
Czy SF4 jest polarny?
Kiedy znamy już strukturę Lewisa i geometrię cząsteczki danego związku, łatwiej jest przedstawić polarność cząsteczki. W tym przypadku jedna para samotna na centralnym atomie siarki i cztery wiążące pary elektronów prowadzą do asymetrycznego rozmieszczenia elektronów na centralnym atomie.
Ponadto, ponieważ kształt cząsteczki jest jak piłeczka, dwa atomy fluoru mogą znieść wzajemnie swój moment dipolowy, ale pozostałe dwa nie mogą ze względu na rozmieszczenie elektronów. A ponieważ atomy fluoru są bardziej elektroujemne niż atomy siarki, skutkuje to nierównomiernym rozłożeniem ładunku. Stąd moment dipolowy nie jest znoszony, co sprawia, że cząsteczka jest polarna. Więc tak, SF4 jest polarny.
Hybrydyzacja SF4
Aby poznać hybrydyzację cząsteczki SF4, przyjrzyjmy się najpierw regionom gęstości elektronowej dla atomu centralnego.
Siarka ma cztery wiążące pary elektronów i jedną samotną parę, co czyni jej całkowitą liczbę regionów gęstości elektronowej 5. Stąd atom siarki wykorzystuje pięć zhybrydyzowanych orbitali, jeden orbital 3s, trzy orbitale 3p i jeden orbital 3d. Takie rozmieszczenie elektronów wokół atomu i zhybrydyzowanych orbitali prowadzi do hybrydyzacji sp3d. Można również użyć liczby sterycznej, aby poznać hybrydyzację; tutaj, liczba steryczna wynosi 5 dla atomu siarki.
Tak więc SF4 ma sp3d hybrydyzacji.
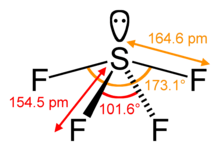
SF4 Kąty wiązań i kształt
Centralny atom siarki tworzy cztery wiązania z sąsiednimi atomami fluoru i ma jedną samotną parę elektronów. Atomy fluoru na pozycjach równikowych mają kąty wiązań 102 stopnie, a osiowych 173 stopnie, które są nieco inne niż trygonalna dwupiramidalna geometria molekularna prowadząca do kształtu see-saw.
Samotna para na centralnym atomie prowadzi do zmiany kątów wiązań ze 120 stopni do 102 stopni dla równikowych atomów fluoru i 173 stopni zamiast 180 stopni dla osiowych atomów fluoru.
Uwagi końcowe
Podsumowując wszystkie właściwości możemy powiedzieć, że,
- Tetrafluorek siarki posiada 34 elektrony walencyjne, z których tworzy cztery wiązania kowalencyjne i jedną samotną parę elektronów na atomie centralnym w swojej strukturze Lewisa.
- Na każdym atomie fluoru znajdują się trzy samotne pary.
- Ma geometrię molekularną o wzorze AX4E; tworzy kształt piły i ma trójkątną dwupiramidalną geometrię molekularną.
- SF4 ma hybrydyzację sp3d i jest polarny w przyrodzie.