Atomy i złoto
W 1911 roku, Rutherford i współpracownicy Hans Geiger i Ernest Marsden zainicjowali serię przełomowych eksperymentów, które całkowicie zmieniłyby przyjęty model atomu. Bombardowali oni bardzo cienkie arkusze złotej folii szybko poruszającymi się cząstkami alfa.

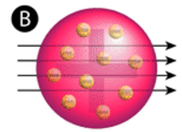

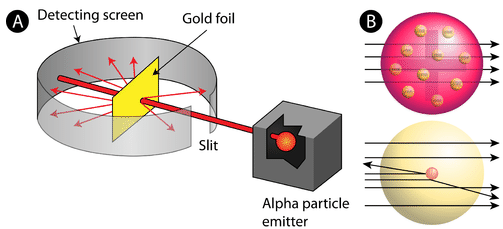
Rysunek (A) Układ doświadczalny do eksperymentu Rutherforda ze złotą folią: Radioaktywny pierwiastek emitujący cząstki alfa był skierowany w stronę cienkiego arkusza złotej folii, który był otoczony ekranem umożliwiającym detekcję odbitych cząstek. (B) Zgodnie z modelem budyniu śliwkowego (u góry) wszystkie cząstki alfa powinny były przejść przez złotą folię z niewielkim lub żadnym odchyleniem. Rutherford stwierdził, że niewielki procent cząstek alfa był odchylony pod dużym kątem, co można było wytłumaczyć atomem z bardzo małym, gęstym, dodatnio naładowanym jądrem w jego centrum (na dole).
Zgodnie z przyjętym modelem atomu, w którym masa i ładunek atomu są równomiernie rozłożone w całym atomie, naukowcy spodziewali się, że wszystkie cząstki alfa przejdą przez złotą folię z niewielkim odchyleniem lub nie przejdą wcale. Zaskakująco, jak pokazano na rysunku (podczas gdy większość cząstek alfa była rzeczywiście nieodbita, bardzo mały procent (około 1 na 8000 cząstek) odbił się od złotej folii pod bardzo dużymi kątami. Niektóre z nich zostały nawet przekierowane z powrotem w stronę źródła. Żadna wcześniejsza wiedza nie przygotowała ich do tego odkrycia. W słynnym cytacie Rutherford powiedział, że to było „tak, jakbyś wystrzelił 15-calowy pocisk w kawałek tkanki, a on wrócił i uderzył w ciebie.”
Rutherford musiał wymyślić zupełnie nowy model atomu, aby wyjaśnić swoje wyniki. Ponieważ ogromna większość cząstek alfa przeszła przez złoto, rozumował, że większość atomu to pusta przestrzeń. Z kolei cząstki, które były silnie odchylone, musiały doświadczyć ogromnej siły wewnątrz atomu. Doszedł do wniosku, że cały ładunek dodatni i większość masy atomu musi być skoncentrowana w bardzo małej przestrzeni we wnętrzu atomu, którą nazwał jądrem. Jądro jest maleńkim, gęstym, centralnym jądrem atomu i składa się z protonów i neutronów.
Model atomu Rutherforda stał się znany jako model jądrowy. W atomie jądrowym protony i neutrony, które składają się na prawie całą masę atomu, znajdują się w jądrze w centrum atomu. Elektrony są rozmieszczone wokół jądra i zajmują większą część objętości atomu. Warto podkreślić, jak małe jest jądro w porównaniu z resztą atomu. Gdybyśmy mogli wysadzić atom, aby był wielkości dużego profesjonalnego stadionu piłkarskiego, jądro byłoby wielkości marmuru.
Model Rutherforda okazał się ważnym krokiem w kierunku pełnego zrozumienia atomu. Nie zajmował się on jednak w pełni naturą elektronów i sposobem, w jaki zajmowały one ogromną przestrzeń wokół jądra. Za ten i inne spostrzeżenia Rutherford otrzymał w 1908 roku Nagrodę Nobla w dziedzinie chemii. Niestety, Rutherford wolałby otrzymać Nagrodę Nobla z fizyki, ponieważ uważał, że fizyka jest lepsza od chemii. Jego zdaniem „Cała nauka to albo fizyka, albo zbieranie znaczków”
.