Flaviviradae to duża rodzina patogenów wirusowych odpowiedzialnych za wywoływanie ciężkich chorób i śmiertelności u ludzi i zwierząt. Rodzina ta składa się z trzech rodzajów: Flavivirus, Pestivirus i Hepacivirus. Rodzaj Flavivirus, który jest największym z trzech rodzajów, zawiera ponad 70 wirusów, w tym wirus dengi (DV), wirus japońskiego zapalenia mózgu (JEV), wirus Zachodniego Nilu (WNV), wirus żółtej gorączki (YFV) i wirus Zika (ZIKV). Flawiwirusy wykazują jednorodność morfologiczną z ikozaedrycznym kapsydem i ściśle przylegającą, kolczastą otoczką. Wielkość kapsydu wynosi około 30 nm, a cały wirion mierzy 45 nm. Genom flawiwirusów jest jednoniciowym, sensownym RNA o wielkości około 10 kb. Koduje on 3 białka strukturalne: kapsydu (białko C), błony (M, które jest wyrażane jako prM, prekursor białka M i otoczki (białko E) oraz 7 białek niestrukturalnych: NS1, NS2A, NS2B, NS3, NS4A, NS4B i NS5 (rysunek 1 a,b).
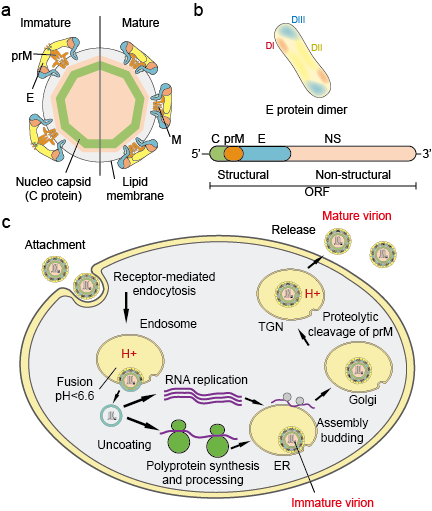
Rysunek 1. Cząstki flawiwirusów (a), białka (b) i cykl życiowy (c).
Browse All Flavivirus Related Products
Cykl życiowy flawiwirusów:
Wirusy przyczepiają się do powierzchni komórki gospodarza, a następnie wnikają do komórki przez endocytozę pośredniczoną przez receptor (Rysunek 1c). Zidentyfikowano kilka receptorów pierwotnych i współreceptorów o niskim powinowactwie dla flawiwirusów. Zakwaszenie pęcherzyka endosomalnego wyzwala zmiany konformacyjne wirionu, fuzję błony wirusowej i komórkowej oraz rozpad cząsteczki. Po uwolnieniu genomu do cytoplazmy, dodatnio-sensowny RNA ulega translacji do pojedynczej poliproteiny, która jest przetwarzana współ- i potranslacyjnie przez proteazy wirusowe i gospodarza. Replikacja genomu zachodzi na błonach wewnątrzkomórkowych. Składanie wirusa zachodzi na powierzchni retikulum endoplazmatycznego (ER), gdy białka strukturalne i nowo zsyntetyzowane RNA pączkują do światła ER. Powstałe w ten sposób nieinfekcyjne, niedojrzałe cząstki wirusowe i subwirusowe są transportowane przez sieć trans-Golgiego (TGN). Niedojrzałe cząstki wirionów są rozszczepiane przez proteazę gospodarza – furynę, w wyniku czego powstają dojrzałe, zakaźne cząstki. Cząstki subwirusowe są również rozszczepiane przez furynę. Dojrzałe wirusy i cząstki subwirusowe są następnie uwalniane przez egzocytozę.
Epidemiologia flawiwirusów:
Flawiwirusy przenoszone przez komary są przenoszone w przyrodzie w jednym lub więcej odrębnych lub nakładających się cyklach, które obejmują wektora komara, na ogół komary Aedes dla YFV i DENV oraz komary Culex dla JEV i WNV, oraz ssaka lub ptaka-gospodarza. Transmisja pomiędzy komarami a żywicielami kręgowymi jest określana jako transmisja pozioma i powoduje choroby u kręgowców. W przeciwieństwie do transmisji poziomej, flawiwirusy przenoszone przez komary mogą być utrzymywane w środowisku poprzez transmisję pionową, tzn. transmisję transgeneracyjną, która pozwala na rozprzestrzenianie się flawiwirusów wyłącznie w komarach. Najbardziej bezpośredni dowód potwierdzający pionowe przenoszenie flawiwirusów przenoszonych przez komary pochodzi z izolacji wirusa z zainfekowanych larw, przypuszczalnie poprzez transmisję transowarialną. Obserwacja ta jest zgodna z wykrywaniem antygenów wirusowych w tkankach jajników zakażonych komarów. (Rysunek 2)
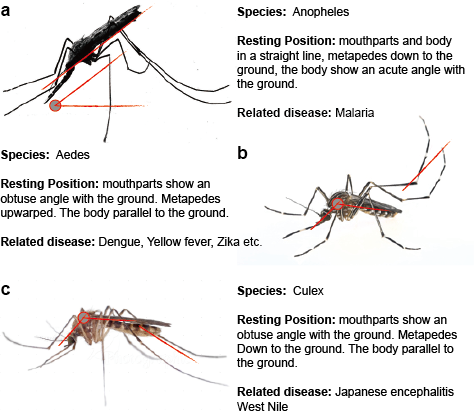
Rysunek 2. Trzy typowe komary, które przenoszą choroby.
Flawiwirusy mają globalne rozmieszczenie, a niektórzy członkowie rodzaju stanowią poważny problem dla zdrowia publicznego (np. wirus żółtej gorączki , wirus dengi , wirus Zachodniego Nilu i wirus japońskiego zapalenia mózgu ), z wysoką zachorowalnością i/lub śmiertelnością. W ostatniej dekadzie flawiwirusy wykazały zwiększoną częstość występowania, stwarzając zagrożenie dla ponad 3 miliardów ludzi na całym świecie, co czyni je paradygmatem pojawiających się chorób.
W ciągu ostatnich 50 lat wiele flawiwirusów, takich jak wirus dengi, Zachodniego Nilu i żółtej gorączki, wykazało dramatyczny wzrost częstości występowania, ciężkości choroby i/lub zasięgu geograficznego. Wirusowe patogeny pochodzące ze środowiska wykazują stosunkowo jednolitą charakterystykę epidemiologiczną. Komary, kleszcze i gryzące muchy służą jako wektory większości ludzkich chorób wirusowych. Choroba u ludzi pojawia się, gdy wektory są aktywne, zazwyczaj wiosną, latem i jesienią w klimacie umiarkowanym, i często wykazuje odrębne cechy epidemiologiczne, które odpowiadają siedlisku wektora (Rysunek 3).
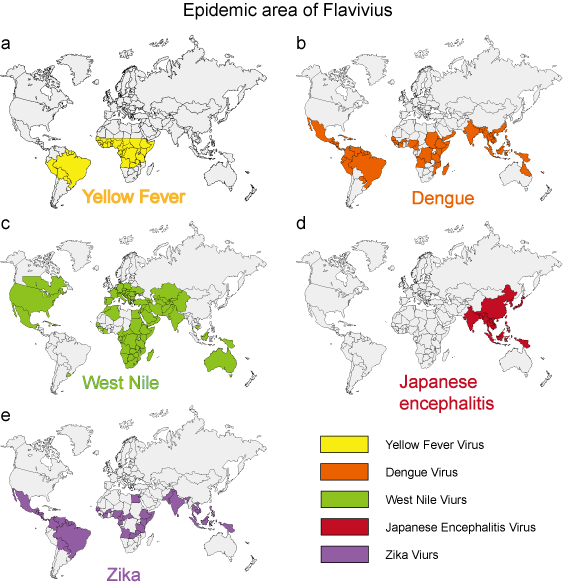
Rysunek 3. Obszar epidemii 5 typowych flawiwirusów.
Manifestacje:
Flawiwirusy różnią się znacznie pod względem potencjału patogennego i mechanizmów wywoływania chorób u ludzi (Tabela 1). Zakażenie człowieka flawiwirusami przenoszonymi przez komary i kleszcze jest inicjowane przez przeniesienie wirusa przez skórę za pośrednictwem śliny zakażonego stawonoga. Wirus replikuje się lokalnie i w regionalnych węzłach chłonnych, powodując wiremię. Główne syndromy i przykłady wywołujących je flawiwirusów obejmują: zapalenie mózgu (japońskie zapalenie mózgu), chorobę gorączkową z wysypką (wirus dengi), gorączkę krwotoczną (wirus choroby leśnej Kyasanur i czasami wirus dengi) oraz gorączkę krwotoczną z zapaleniem wątroby (wirus żółtej gorączki).
Tabela 1 Przegląd najważniejszych flawiwirusów
| Gatunek wirusa | Wektor przenoszący | Rozprzestrzenianie geograficzne | Syndrom. |
|---|---|---|---|
| Żółta gorączka | Mosquito (Aedes) | Patrz rysunek 3a | Gorączka krwotoczna |
| Denga | Mosquito (Aedes, Stegomyia) |
Patrz rysunek 3b | Zespół dengi, DHF, DSS |
| Gorączka Zachodniego Nilu | Komar (Culex), kleszcze (Argasidae) |
Patrz rysunek 3c | Zespół dengi, zapalenie mózgu |
| japońskie zapalenie mózgu | komar (Culex) | Patrz rysunek 3d | zapalenie mózgu |
| Zika | Mosquito (Aedes) | Patrz rysunek 3e | Mikrocefalia |
Diagnostyka:
Diagnostyka kliniczna różnych flawiwirusów nie jest wiarygodna ze względu na niespecyficzne objawy, a do potwierdzenia etiologii choroby konieczna jest diagnostyka laboratoryjna. W zakażeniach flawiwirusami wirus może być wykryty w surowicy lub osoczu, zazwyczaj po 2-7 dniach od początku choroby, a czas trwania tej fazy wiremii i wykryta wiremia różnią się w zależności od zakażającego wirusa (Tabela 2). Zazwyczaj po 5-7 dniach od początku choroby pojawia się odpowiedź immunologiczna przeciwko zakażeniu, z przeciwciałami IgM, których szczyt pojawia się po 15 dniach. Te przeciwciała IgM mogą utrzymywać się od miesięcy (jak w przypadku DENV) do lat (jak w przypadku zakażeń WNV). Pojawienie się IgG następuje po 8-10 dniach od początku choroby i może być wykrywane przez całe życie. Specyfika każdego z flawiwirusów ma znaczący wpływ na algorytmy diagnostyczne, które należy stosować w rozpoznawaniu zakażeń flawiwirusowych. Ogólnie rzecz biorąc, wiele laboratoriów wybrało testy serologiczne do diagnozowania infekcji wywołanych przez flawiwirusy, ze względu na ich dokładność i dostępność testów komercyjnych opartych na wysokich standardach jakości. Jednakże, obecność serologicznych reakcji krzyżowych pomiędzy różnymi wirusami oraz czas niezbędny do wykrycia przeciwciał w niektórych infekcjach, ograniczają przydatność serologii jako narzędzia diagnostycznego w ostrych infekcjach flawiwirusowych. Izolacja wirusa stanowi „złoty standard” w celu uzyskania potwierdzonej diagnozy flawiwirusa.
Przeglądaj wszystkie produkty Flavivirus ELSIA Kit i Flavivirus RDT
Tabela 2. Algorytmy diagnostyki flawiwirusów.
| Faza ostra | Faza rekonwalescencji | Preferowana próbka† | Oczekiwane obciążenie wirusowe | |
|---|---|---|---|---|
| YFV | RT-PCR, RT-qPCR, IgM, izolacja wirusa | IgM, IgG | Serum, osocze i tkanki | Wysoka |
| DENV | RT-PCR, RT-qPCR, NS1 Ag, IgM, izolacja wirusa | IgM, IgG | Serum, osocze, CSF i PBMCs | Up to 106 virions/ml |
| WNV | RT-PCR, IgM, IgG | IgM, IgG | CSF i surowica | Low |
| JEV | RT-PCR, IgM, IgG | IgM, IgG | CSF, surowica, krew i PBMCs | Low |
| ZIKV | RT-PCR, IgM, IgG | IgM, IgG | CSF i surowica | Low |
| Gould E A, Solomon T. Pathogenic flaviviruses . The Lancet, 2008, 371(9611): 500-509. | |
| Gaunt M W, Sall A A, de Lamballerie X, et al. Phylogenetic relationships of flaviviruses correlate with their epidemiology, disease association and biogeography . Journal of General Virology, 2001, 82(8): 1867-1876. | |
| Kuno G, Chang G J J, Tsuchiya K R, et al. Phylogeny of the genus Flavivirus . Journal of virology, 1998, 72(1): 73-83. | |
| Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle. Nature Reviews Microbiology, 2005, 3(1): 13-22. | |
| Huang Y J S, Higgs S, Horne K M E, et al. Flavivirus-mosquito interactions. Viruses, 2014, 6(11): 4703-4730. |
.